Bna-novel-miR311-HSC70-1模块调控甘蓝型油菜响应热胁迫的机制
鲁海琴 陈 丽,2 陈 磊 张盈川 文 静 易 斌 涂金星 傅廷栋 沈金雄,*
Bna-novel-miR311-模块调控甘蓝型油菜响应热胁迫的机制
鲁海琴1陈 丽1,2陈 磊1张盈川1文 静1易 斌1涂金星1傅廷栋1沈金雄1,*
1华中农业大学作物遗传改良国家重点实验室/ 国家油菜工程技术研究中心, 湖北武汉 430070;2长江师范学院现代农业与生物工程学院, 重庆 408100
HSP70 (heat shock protein 70)参与植物热胁迫应答, 增强植物耐热性, 但目前油菜中尚无miRNA调控基因的报道。本研究novel-miR311是利用高通量技术在甘蓝型油菜茎尖中筛选出的新miRNA。novel-miR311存在于油菜而不存在于拟南芥中, 5¢-RACE技术证实其2个靶基因属热应激同源蛋白基因(家族), 在甘蓝型油菜体内被剪切。构建novel-miR311超表达载体, 转化拟南芥和甘蓝型油菜, 其转基因阳性苗中基因表达量显著下降。高温胁迫试验表明, 拟南芥和甘蓝型油菜热胁迫后, 其阳性苗的生长势和存活率显著低于其对应的对照。qPCR结果显示, 油菜中基因表达量热胁迫后较热胁迫前上升。上述结果表明, 油菜novel-miR311介导基因的剪切降低了拟南芥和甘蓝型油菜耐热性。
甘蓝型油菜; 拟南芥; novel-miR311;; 高温胁迫
近年来, 极端高温天气频繁发生, 导致农作物减产严重。高温诱导下, 植物产生抵抗高温的蛋白进行防御, 如热休克蛋白HSP70 (heat shock protein 70)等, 其作为分子伴侣协助植物抵抗高温胁迫的影响[1-2]。HSP70家族蛋白高度保守, 主要有2个功能区, 与ATP结合并使其水解的核酸结合区(nucleotide binding domain, NBD)和底物结合区(substrate binding domain, SBD), 其行使功能需DnaJ (DnaJ like protein)和NEF (nucleotide exchange factor) 2类蛋白参与。首先HSP40 (DnaJ)通过其J结构域识别底物, 并将底物传递到HSP70; HSP70水解ATP后, 与底物结合并对底物进行修饰; 随后NEF (HSP110)与HSP70的NBD区结合, 促进ADP释放; 当新的ATP与HSP70结合, HSP110从HSP70上脱离, 且释放加工好的底物[3-6]。
MicroRNA (miRNA)是一类长度为20~24 nt具有重要功能的单链小分子RNA, 其为基因表达负调控因子, 最终以RNA诱导沉默复合物(RNA-induced silencing complex, RISC)行使其对靶基因的切割和抑制翻译等功能[7]。直到2002年才首次在植物中发现miRNA[8], 后续深入研究发现, miRNA参与调控植物生命活动的多个过程, 包括植物的生长发育、激素应答、营养元素的摄取与利用、以及多种生物与非生物胁迫[9-15]。参与响应植物热胁迫的miRNA也相继被报道, 其中主要是植物热胁迫下鉴定响应高温的miRNA, 如小麦高温胁迫下利用高通量技术鉴定响应热胁迫的miRNA[16], 玉米和番茄高温胁迫下鉴定高温相关的miRNA[17-19]。只有少数报道具体某个miRNA如何响应高温胁迫, 如番茄中过表达sha-miR319d提高其耐热性[20]; 过量表达miR160和miR157都增加棉花对高温胁迫的敏感性[21]; 紫花苜蓿和拟南芥中超表达miR156, 其耐热性都获得提高[22-23]。油菜是我国重要的食用植物油来源之一, 市场需求巨大[24], 然而油菜中响应热胁迫的miRNA研究报道尚少, 其中主要是油菜热胁迫下鉴定响应高温的miRNA, 如芥菜型和白菜型油菜高温胁迫下鉴定响应热胁迫的miRNA[25-26], 其具体应对高温胁迫的机制尚不清楚。
本研究通过高通量测序技术获得甘蓝型油菜中新miRNA (novel-miR311), 揭示其在拟南芥和甘蓝型油菜热胁迫时通过切割, 使本应大量产生的HSC70-1蛋白不能大量产生, 从而导致拟南芥和甘蓝型油菜耐热性降低, 以期为油菜抗高温育种提供新的思路。
1 材料与方法
1.1 材料
测序用的材料来源于甘蓝型油菜正常株型品系08-8008和矮秆突变体4942C-5 (轮回亲本)构建的回交BC5群体(取其中的矮秆紧凑单株和正常株型单株各8株, 抽薹初期取茎顶端组织分别混样, 2次重复); 转基因受体材料为甘蓝型油菜品种J572和哥伦比亚型拟南芥(); 5¢-RACE文库的供试材料为矮秆紧凑突变体4942C-5。
1.2 试验方法
1.2.1 5¢-RACE文库构建和5¢-RACE验证靶基因切割位点 利用GeneRacer kit (Invitrogen, USA)试剂盒构建5¢-RACE文库。流程如下: 取矮秆紧凑突变体4942C-5茎尖提取总RNA, 取5 µg总RNA不经过脱磷酸化处理和去帽子处理直接连RNA接头, 用SuperScript III反转录合成cDNA。靶基因切割位点验证: 以5¢-RACE文库为模板, 通过两轮Touchdown PCR扩增, 获得目标大小片段, 通过TA克隆把PCR产物连接到PGEM-Teasy载体上测序, 最终确定目标mRNA精确的剪切位点。具体步骤和PCR反应体系及反应条件参照陈丽[27]。
1.2.2 novel-miR311超表达载体的构建 将novel-miR311前体与NCBI甘蓝型油菜全基因组数据库比对寻到前体的侧翼序列, 为保证miRNA前体茎环结构能够在体内正确转录并切割, 选取茎环结构前后各-200 bp左右侧翼序列设计引物。利用超表达载体pS2300 (由本实验室赵伦博士提供)连接novel-miR311前体序列转化大肠杆菌(DH5α)挑取单克隆测序, 以序列正确的单克隆质粒转化农杆菌(GV3101)。
1.2.3 拟南芥的遗传转化 利用农杆菌蘸花法进行拟南芥的遗传转化。将转化的农杆菌进行培养, 采用花序浸花法侵染野生型拟南芥植株。将所收种子干燥春化后消毒播于50 μg mL-1卡那霉素的1/2 MS培养基上, 置于光照培养室中培养10 d左右, 挑取生长嫩绿且有根的植株移栽于温室培养, 进行后续鉴定。
1.2.4 油菜的遗传转化 采用农杆菌介导的方法进行油菜遗传转化, 方法参考陈丽[27]。
1.2.5 阳性苗鉴定 取得到的转基因油菜和拟南芥幼苗叶片, 用CTAB (hexadecyl trimethyl ammoni um bromide, 十六烷基三甲基溴化铵)法提取基因组DNA。以提取的DNA为模板, 一条载体上的引物, 一条基因内部的引物, 本研究中目的片段长度为456 bp。PCR体系包含1 µL模板、3 µL ddH2O、引物各0.5 µL、5 µL PCR Mix (擎科)。PCR程序为94℃ 3 min; 94℃ 30s, 58℃ 30s, 72℃ 1 min, 共32个循环; 72℃ 5 min。使用1%琼脂糖凝胶电泳检测PCR产物。
1.2.6 RNA提取 采用TRIzol Reagent法[27]抽提总RNA。
1.2.7 miRNA和靶基因的反转录及定量PCR
参照Varkonyi-Gasic等[28]设计miRNA的RT-PCR (reverse transcription PCR)引物。在Bio-Rad CFX96仪器上进行miRNA和靶基因的qPCR (quantitative real-time PCR)反应, miRNA以U6作为内参, 靶基因以基因作为内参。miRNA和靶基因的RT-PCR和qPCR具体方法参照陈丽[27]。使用2 delta-delta Ct方法[29]计算miRNA和基因的相对表达倍数变化。
1.2.8 高温胁迫处理 参照Leng等[30]的方法并略作修改进行拟南芥高温胁迫处理。挑选健壮的拟南芥转基因阳性株系和野生型种子, 使用75%的酒精清洗1 min, 后以0.1%升汞洗8~10 min, 再以无菌水洗3~4遍, 每遍4~5 min, 将晾干的种子播到1/2 MS培养基上, 光照培养室(16 h光照/8 h黑暗, 温度23℃, 湿度60%)生长10 d左右后, 置于光照培养箱(只有温度改变, 其他条件不变)进行42℃ 4 h培养, 放回光照培养室培养7 d后, 观察表型并照相。
油菜种子高温胁迫后发芽试验: 分别挑取健壮圆润的转基因油菜阳性苗和对照J572的种子100粒, 用锡箔纸包好, 分别将种子进行4℃ 2 h、37℃ 2 h、4℃ 2 h–室温1 h–70℃ 2 h、37℃ 2 h–室温1 h–70℃2 h和70℃ 2 h处理, 不经高温处理为对照。将用锡箔纸包好的种子分别置于恒温培养箱进行37℃处理、4℃冰箱进行4℃处理以及烘箱中进行70℃处理。处理后的种子摆入装有2层滤纸的10×10的培养方皿中, 置于光照培养室(16 h光照/8 h黑暗, 温度23℃, 湿度60%)中进行发芽试验, 期间向培养方皿中不定时加水。
油菜幼苗高温试验: 挑取健壮的转基因油菜阳性苗和对照J572的种子, 同时播种于装有营养土10×10的钵子里, 播种完将其置于油菜温室(温室条件与上述光照培养室一致)培养10 d左右(长出2片小真叶), 随后在光照培养箱(除温度外, 其他条件与油菜温室一致)进行43℃ 5 h、44℃ 5 h和45℃ 5 h培养, 处理后再置于原油菜温室培养7 d后观察表型并拍照。
2 结果与分析
2.1 Bna-novel-miR311及其靶基因
通过回交群体中矮秆紧凑型单株和正常株型单株混池的小RNA高通量测序, 在2种材料池中都鉴定到novel-miR311和其前体序列, 与拟南芥基因组比较, 发现它们仅在油菜中存在。利用MFOLD软件对novel-miR311前体序列进行折叠发现, 其可形成完美的发夹结构, 利于被Dicer-like (DCL1)酶切割, 且其最小折叠自由能为dG =-65.61 kJ mol-1, 符合miRNA的特征小于-18 kJ mol-1。
同时通过对上述2种材料池的降解组测序鉴定到被novel-miR311剪切的10个候选靶基因, 进一步分析发现, 其中8个靶基因为家族基因(5个为热应激同源蛋白基因, 3个为热诱导型蛋白基因); 另外2个靶基因为转导蛋白家族基因(表1)。5¢-RACE验证和()被novel-miR311切割(图1)。
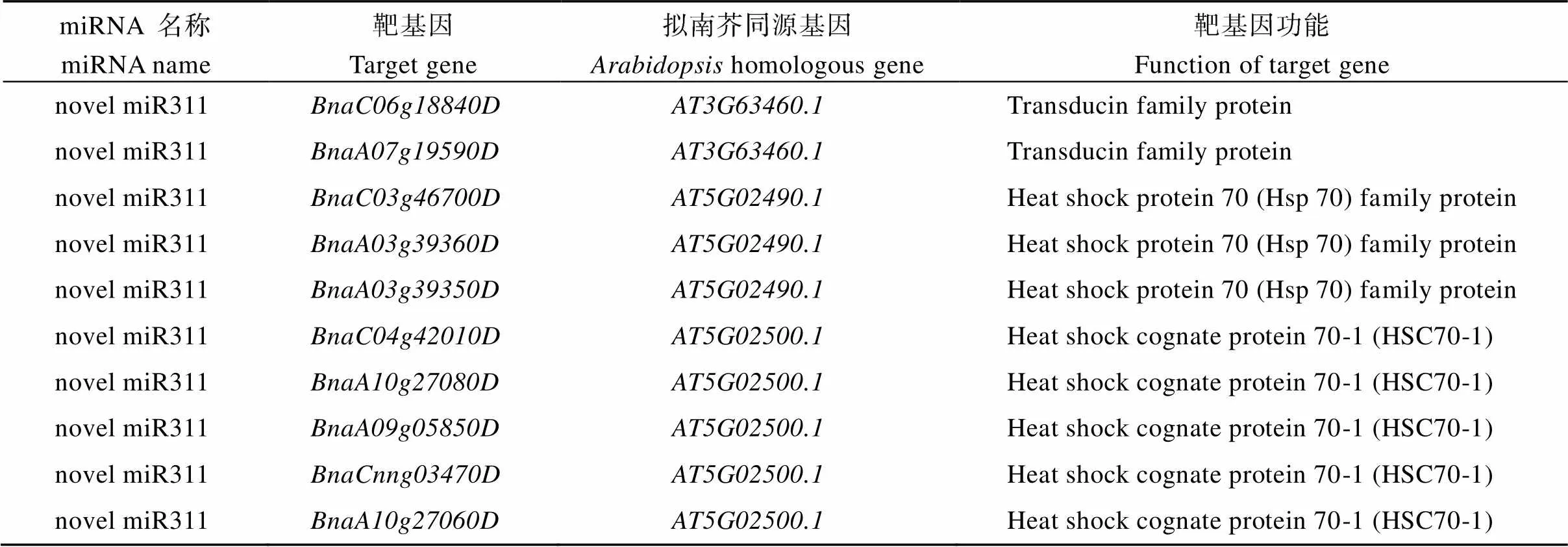
表1 novel-miR311降解组测序预测到的10个候选靶基因

图1 5¢-RACE验证靶基因
冒号表示碱基配对, 点号表示错配, 箭头表示切割位点, 数字表示挑斑克隆。
“:” represents the miRNA and its targets are labeled on the right, “.” represents mismatch, the arrow indicates the cleavage site, and the numbers above sequences represent the detected cleavage site of independent clones.
2.2 Bna-novel-miR311候选靶基因与其在拟南芥中的同源基因
利用NCBI公共数据库分别对油菜中的10个候选靶基因和其在拟南芥基因组中的同源基因的序列相似度比较分析发现, novel-miR311在油菜中的所有靶基因与其在拟南芥中的同源基因都有85%以上的相似度, 且油菜中10个靶基因的靶标位点与拟南芥中的同源基因相差无几, 特别是基因的靶序列在油菜和拟南芥中毫无差别(图2)。这一结果说明novel-miR311存在结合拟南芥中靶基因并进行靶标作用的可能, 故构建novel-miR311超表达载体, 转化拟南芥和油菜。

(图2)
a: 转导蛋白基因; b: 热激蛋白基因; c:热应激同源蛋白基因。红色部分为novel-miR311与靶基因结合部位。
a: transduction protein gene; b: heat shock proteingene; c: heat shock cognate proteingene. The red part is the binding site of novel-miR311 and target gene.
2.3 Bna-novel-miR311在拟南芥高温胁迫中的功能验证
2.3.1 Bna-novel-miR311及其靶基因在拟南芥组织中的表达分析 选取3个阳性拟南芥转基因株系, 分别检测novel-miR311及基因在其根、茎、叶、花和角果的表达量, 以野生型作为对照。野生型拟南芥中, 5个组织几乎全都检测不到novel-miR311的表达, 与拟南芥基因组中无novel-miR311前体序列相符合; 而基因的表达量在野生型中显著高于阳性株系(图3)。说明novel-miR311对拟南芥中与油菜的同源靶基因进行切割。
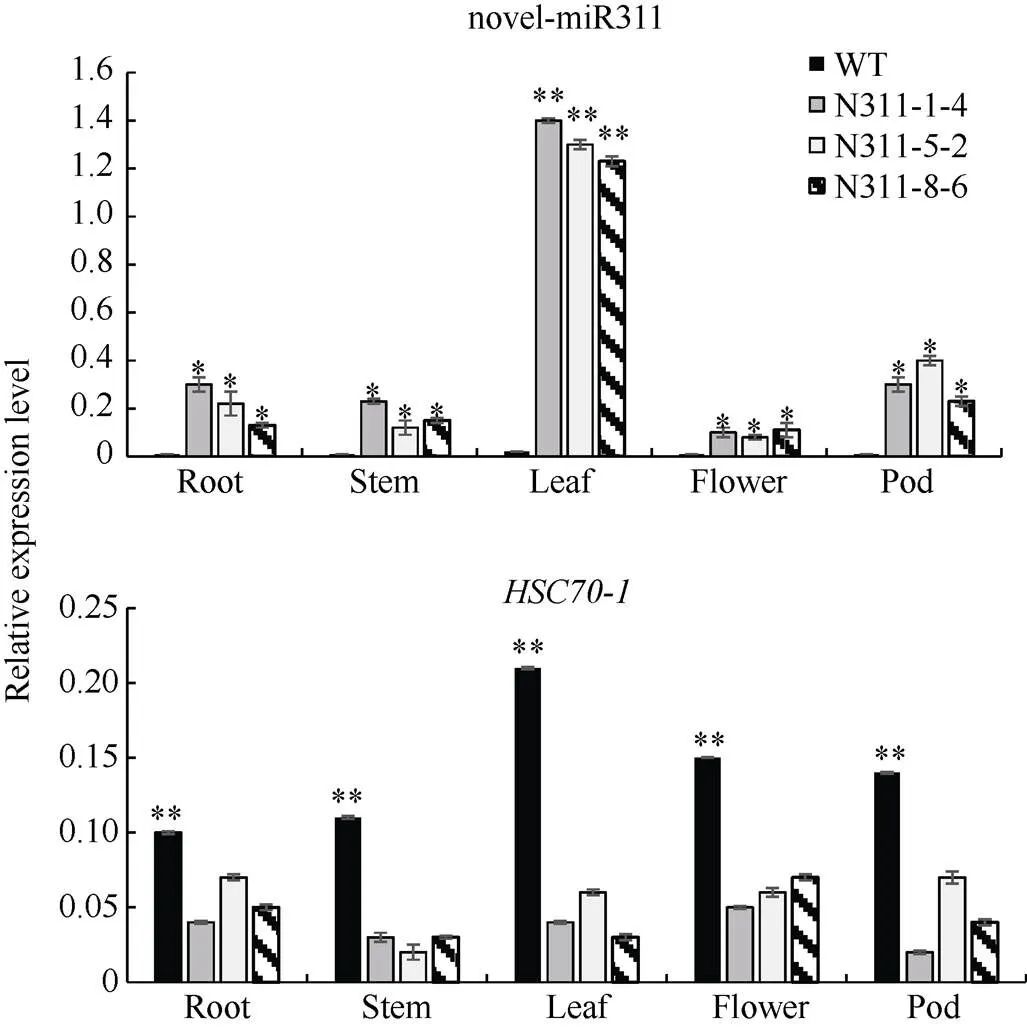
图3 野生型和阳性拟南芥中novel-miR311和HSC70-1分别在根、茎、叶、花和角果中的表达量
每次试验3次生物学重复。*和**分别表示< 0.05和< 0.01。
Data are shown as mean ± SD of three biological replicates. * and ** represent< 0.05 and< 0.01, respectively.
2.3.2 高温胁迫前后拟南芥阳性株系的表型观察
选取3个T3代拟南芥转基因株系和野生型进行高温胁迫试验, 经几批预试验发现, 42℃ 4 h处理下出现较明显的表型。图4-a方皿中拟南芥左半边为阳性苗, 右半边为野生型。novel-miR311 (N311)阳性苗的3个株系经42℃4 h处理后, 生长势和存活率显著低于野生型拟南芥。每个株系中热胁迫后阳性苗生长不受影响的百分比显著低于野生型, 而死亡百分比高于野生型(图4)。
2.4 Bna-novel-miR311在甘蓝型油菜高温胁迫中的功能验证
2.4.1 高温胁迫前后油菜阳性株系种子的发芽分析
选取3个T1代油菜转基因株系与对照J572种子进行高温胁迫后的发芽试验。经4℃ 2 h、37℃ 2 h处理与不经高温处理在第2天的发芽率无显著差异; 经4℃ 2 h–室温1 h–70℃ 2 h、37℃ 2 h–室温1 h–70℃ 2 h和70℃ 2 h处理较不经高温处理在第2天的发芽率显著降低, 但对照J572的发芽率显著高于油菜转基因株系, 且经过一段时间低温训练后再进行70℃高温处理较直接进行70℃高温处理的发芽率稍高(图5) (正常发芽的种子: 双子叶圆粒种子幼根达种子直径长)。
2.4.2 高温胁迫前后油菜阳性株系的表型观察
选取4个T1代novel-miR311 (N311)株系转基因油菜和对照J572进行热胁迫试验, 图5-a所有钵子中左边为油菜转基因阳性苗, 右边为J572。由于转基因油菜种子数量的原因, 43℃ 5 h处理只有2个重复, 44℃ 5 h处理和45℃ 5 h处理有4个重复。
处理前转基因植株与对照J572植株生长势并无差别(图6-a), 经43℃ 5 h处理温室再培养7 d后转基因植株较J572明显矮小; 经44℃ 5 h处理, 所有转基因植株全部死亡, 而在N311-6和N311-63的钵子中对应的J572分别存活2株和1株; 经45℃ 5 h处理, 所有油菜全部死亡。qPCR结果显示, 无论是热胁迫前还是热胁迫后, 油菜阳性苗体内novel-miR311的表达量较J572显著上调, 其靶基因显著下调, 而44℃处理后所有株系中novel-miR311的表达量较处理前略微下降, 而靶基因上升(图6-b)
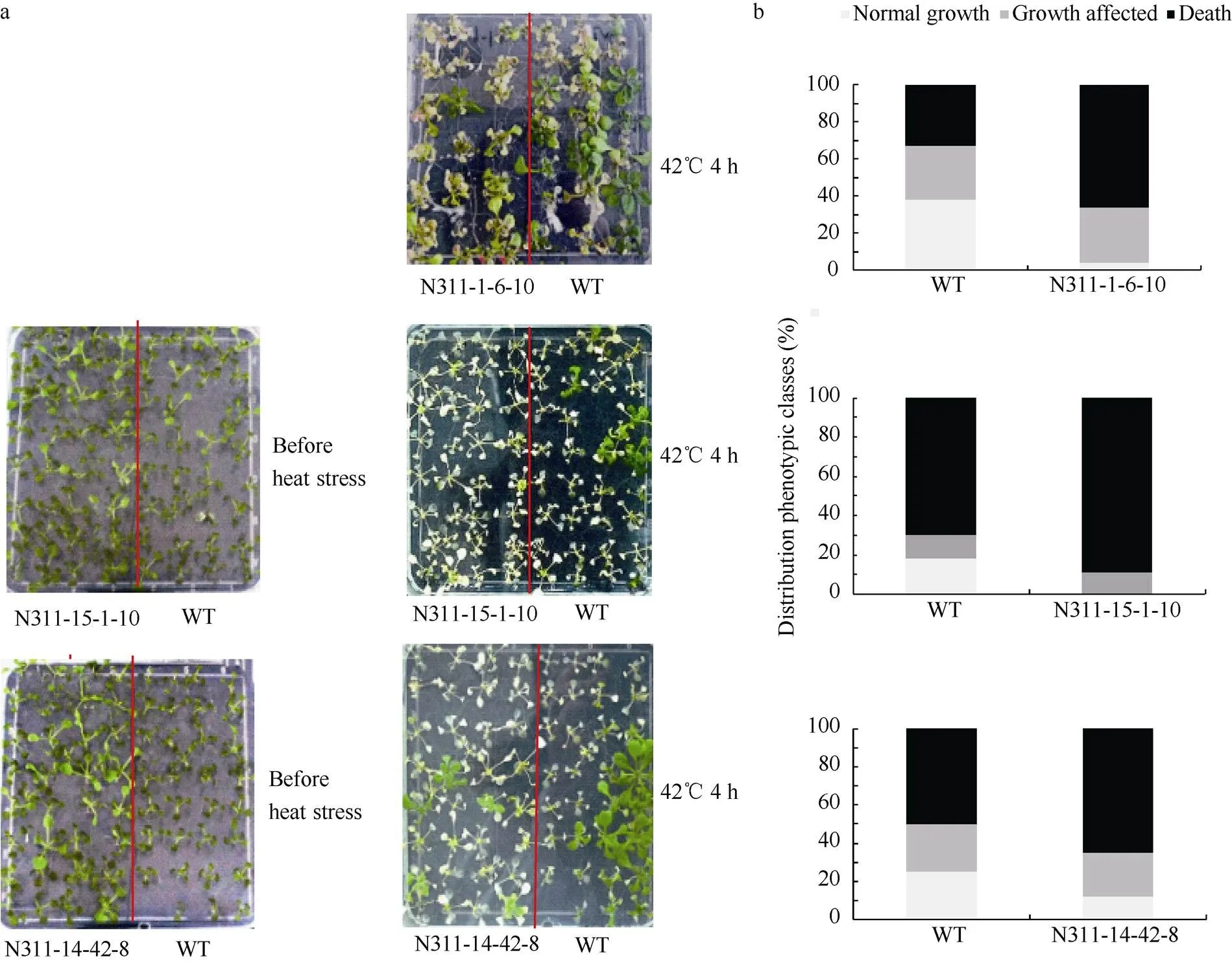
图4 野生型和阳性拟南芥在1/2MS上的高温胁迫实验
a: 表型分析; b: 统计学分析。a: phenotypic analysis; b: statistical analysis.

(图5)
a: 不同温度处理前后对比图; b: 2 d发芽率统计图。
a: comparison chart before and after treatment at different temperatures; b: germination rate chart for two days.
3 讨论
3.1 Bna-novel-miR311及其靶基因
novel-miR311是利用高通量测序在油菜茎尖中发现的新miRNA, 降解组测序预测其靶基因为热激蛋白家族。序列比对结果发现, novel-miR311存在于油菜而不存在于拟南芥中, 且novel-miR311的10个靶基因与其在拟南芥中同源基因相似度非常高, 特别是在靶序列处相似度更高, 故而保证novel-miR311在拟南芥中切割其靶基因的可能。5¢-RACE技术验证油菜中2个靶基因和()被novel-miR311切割, 因此构建novel-miR 311超表达载体, 转化拟南芥和油菜。
3.2 Bna-novel-miR311在响应拟南芥高温胁迫途径中的作用
qPCR分析发现, 拟南芥阳性苗中novel-miR311表达量均显著高于野生型, 而其靶基因显著低于野生型, 说明转基因拟南芥体内novel-miR311表达量水平上升, 且在体内对其靶基因切割。值得一提的是, 野生型拟南芥中几乎检测不到novel-miR311, 符合novel-miR311前体序列在拟南芥基因组中比对不上的结果。
novel-miR311的靶基因为热激蛋白家族基因, 而HSP70蛋白作为分子伴侣在植物遭受逆境胁迫时协助产生的变性蛋白质再折叠, 防止变性蛋白质聚集, 并溶解或降解蛋白质聚体[31-32]。热激因子(heat shock factor, HSF)与热胁迫产生的变性蛋白竞争结合HSP70, 变性蛋白更易结合HSP70, 使得钝化态HSF单体解离, 解离的HSF单体形成活化态HSF三聚体, 再次结合到基因上游促进其大量产生[33-34]。
本研究利用拟南芥进行高温、干旱和盐胁迫的试验发现, 只有高温胁迫后出现较明显的转novel-miR311阳性苗存活率显著低于野生型的表型。同时有研究表明, 拟南芥中过量表达基因提高其耐热性[35-36], 而此结果与本研究中的拟南芥热胁迫试验结果正好对应。说明当转基因拟南芥遭受热胁迫时, 由于novel-miR311对基因的切割, 从而影响其翻译的蛋白修饰损伤蛋白的功能, 进一步导致拟南芥阳性苗热胁迫后死亡率升高。因此novel-miR311通过影响拟南芥中HSP70的作用途径, 使其不能大量产生HSP70蛋白, 从而影响因高温产生变性蛋白的修复, 进而造成转基因拟南芥耐热性降低(图7)。
3.3 Bna-novel-miR311在响应油菜高温胁迫途径中的作用
研究表明油菜受热胁迫时诱导HSP70大量产生[37], 烟草中超表达油菜基因提高其耐热性[38]。本研究发现热胁迫后, 转基因油菜的生长势和存活率显著低于J572, qPCR结果显示, 转基因油菜中novel-miR311表达量显著高于J572, 而基因的表达量整体上热胁迫后高于胁迫前, 但无论胁迫前还是胁迫后其阳性苗中基因的表达量都显著低于对照J572, 说明热胁迫后油菜中基因的表达量上升, 但因油菜阳性苗相对J572体内上升的novel-miR311对其靶基因真实切割, 导致热胁迫后基因大量产生, 结合转基因油菜种子高温处理后的2 d发芽率显著低于对照试验结果, 说明novel-miR311也可影响油菜热胁迫后HSP70的大量产生而影响HSP70的作用途径。该结果完善了高温胁迫下植物体内HSP70的作用途径, 也为油菜抗高温研究提供了新思路。
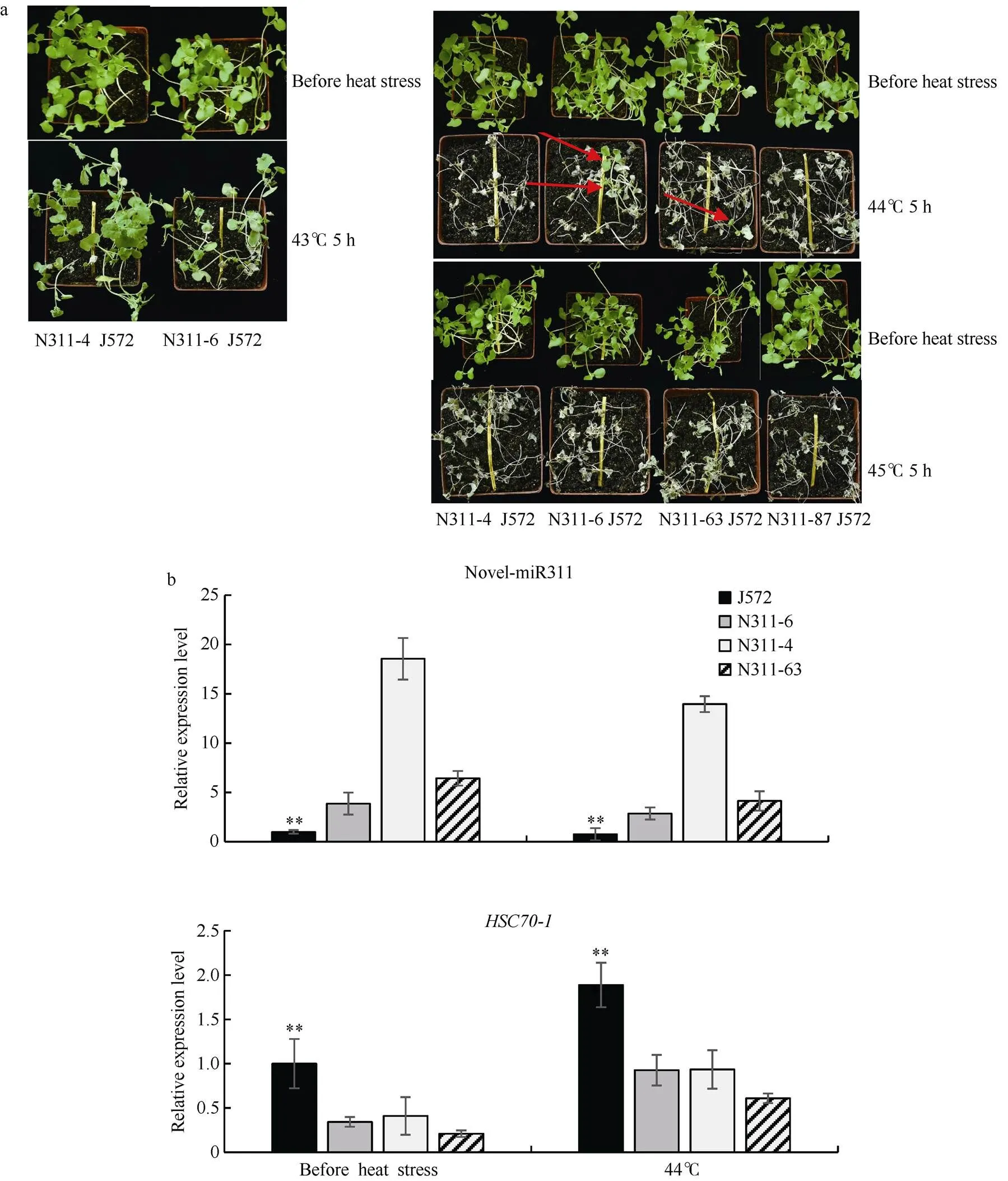
图6 甘蓝型油菜阳性苗与J572在土壤中的高温胁迫表型及表达分析
a:热胁迫前后阳性苗与J572的对比图, 图中红色箭头指存活的油菜。b:热胁迫前后novel-miR311和的表达量。每次试验3次生物学重复。**表示< 0.01。
a: comparison of positive seedlings and J572 before and after heat stress, the red arrow in figures refers to the surviving rapeseed. b: expression of novel-miR311 andbefore and after heat stress. Data are shown as mean ± SD of three biological replicates. **< 0.01.
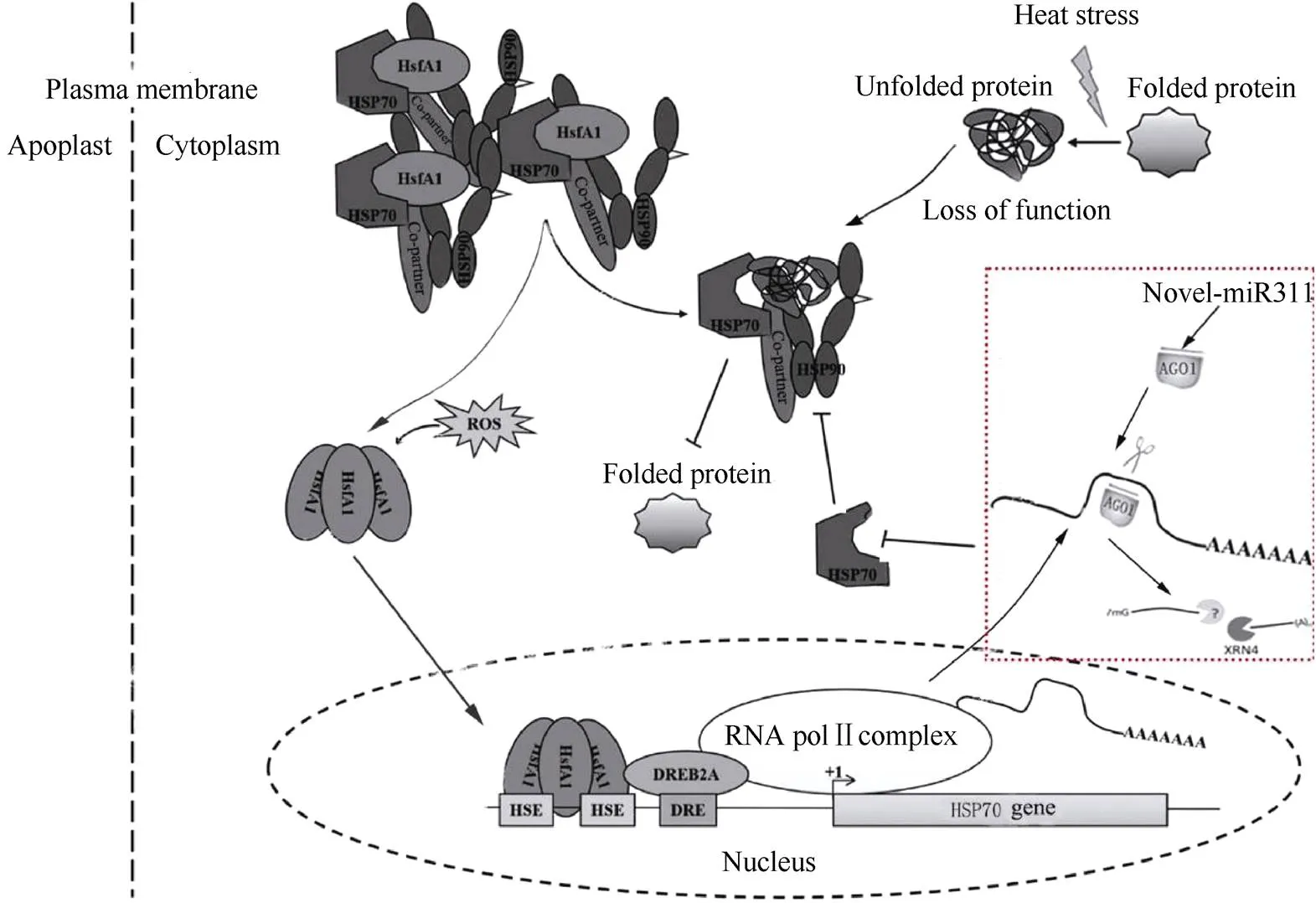
图7 HSP70作用途径
根据Jacob等[33]并略作修改, 虚框中为引入本文结果。
According to Jacob et al.[33]with slight modification, the results in the dashed box are for the introduction of this article.
本研究中转基因油菜和拟南芥热胁迫后的表型都不是非常明显, 可能是处理的条件需再探究; 高温胁迫时的幼苗大小也是影响最后结果的原因之一; 高温胁迫时植物大量产生的HSP70家族蛋白不仅有HSC70-1, 还有其他类型, 其他类型的HSP70蛋白也行使修饰损伤蛋白的功能。
4 结论
本研究鉴定到油菜novel-miR311, 其在拟南芥与油菜中真实切割。novel-miR311在拟南芥和油菜高温胁迫中因切割影响其翻译的蛋白行使修饰损伤蛋白的功能, 从而导致高温胁迫后拟南芥和油菜阳性苗耐热性降低。
[1] Sung D Y, Vierling E, Guy C L. Comprehensive expression profile analysis of thegene family., 2001, 126: 789–800.
[2] Usman M G, Rafii M Y, Martini M Y, Yusuff O A, Ismail M R, Miah G. Molecular analysis of Hsp70 mechanisms in plants and their function in response to stress., 2017, 33: 26–39.
[3] Flaherty K M, Wilbanks S M, DeLuca-Flaherty C, McKay D B. Structural basis of the 70-kilodalton heat shock cognate protein ATP hydrolytic activity. II. Structure of the active site with ADP or ATP bound to wild type and mutant ATPase fragment., 1994, 269: 12899–12907.
[4] Meimaridou E, Gooljar S B, Chapple J P. From hatching to dispatching: the multiple cellular roles of the Hsp70 molecular chaperone machinery., 2008, 42: 1–9.
[5] 孔凡英, 邓永胜, 孟庆伟. 叶绿体J蛋白研究进展. 植物生理学报, 2011, 47: 235–243. Kong F Y, Deng Y S, Meng Q W. Research progress of chloroplast J protein., 2011, 47: 235–243 (in Chinese with English abstract).
[6] Murphy M E. The HSP70 family and cancer., 2013, 34: 1181–1188.
[7] 陈丽, 鲁海琴, 李日慧, 傅廷栋, 沈金雄. 油菜miRNA研究现状与展望. 中国油料作物学报, 2018, 40: 664–673.Chen L, Lu H Q, Li R H, Fu T D, Shen J X.Research progress and prospect of miRNA in., 2018, 40: 664–673 (in Chinese with English abstract).
[8] Reinhart B J, Weinstein E G, Rhoades M W, Bartel B, Bartel D P. MicroRNAs in plants., 2002, 16: 1616–1626
[9] Huang J, Li Z, Zhao D. Deregulation of themiR160 target genecauses growth and developmental defects with an alteration of auxin signaling in rice., 2016, 6: 29938.
[10] Waters B M, McInturf S A, Stein R J. Rosette iron deficiency transcript and microRNA profiling reveals links between copper and iron homeostasis in., 2012, 63: 5903–5918.
[11] Zhang H, Zhao X, Li J, Cai H, Deng X W, Li L. MicroRNA408 is critical for thegene network that mediates the coordinated response to light and copper., 2014, 26: 4933–4953.
[12] Srivastava S, Srivastava A K, Suprasanna P, D’Souza S F. Identification and profiling of arsenic stress-induced microRNAs in, 2013, 64: 303–315.
[13] Meng J G, Zhang X D, Tan S K, Zhao K X, Yang Z M. Genome-wide identification of Cd-responsive NRAMP transporter genes and analyzing expression of NRAMP1 mediated by miR167 in., 2017, 30: 1–15.
[14] Sunkar R, Kapoor A, Zhu J K. Posttranscriptional induction of two Cu/Zn superoxide dismutase genes inis mediated by downregulation of miR398 and important for oxidative stress tolerance., 2006, 18: 2415–2415.
[15] Chen L, Chen L, Zhang X, Liu T, Niu S, Wen J, Yi B, Ma C, Tu J, Fu T, Shen J. Identification of miRNAs that regulate silique development in., 2018, 269: 106–117.
[16] Kumar R R, Pathak H, Sharma S K, Kala Y K, Nirjal M K, Singh G P, Goswami S, Rai R D.Novel and conserved heat-responsive microRNAs in wheat (L.)., 2015, 15: 323–348.
[17] Pan C, Ye L, Zheng Y, Wang Y, Yang D, Liu X, Chen L, Zhang Y, Fei Z, Lu G. Identification and expression profiling of microRNAs involved in the stigma exsertion under high- temperature stress in tomato., 2017, 18: 843.
[18] Zhang M, An P, Li H, Wang X, Zhou J, Dong P, Zhao Y, Wang Q, Li C. The miRNA-mediated post-transcriptional regulation of maize in response to high temperature.2019, 20: 1754.
[19] Zhou R, Wang Q, Jiang F, Cao X, Sun M, Liu M, Wu Z. Identification of miRNAs and their targets in wild tomato at moderately and acutely elevated temperatures by high-throughput sequencing and degradome analysis., 2016, 6: 33777.
[20] Shi X, Jiang F, Wen J, Wu Z. Overexpression of solanum habrochaites microRNA319d (sha-miR319d) confers chilling and heat stress tolerance in tomato ()., 2019, 19: 214.
[21] Ding Y, Ma Y, Liu N, Xu J, Hu Q, Li Y, Wu Y, Xie S, Zhu L, Min L, Zhang X. MicroRNAs involved in auxin signalling modulate male sterility under high-temperature stress in cotton ()., 2017, 91: 977–994.
[22] Stief A, Altmann S, Hoffmann K, Pant B D, Scheible W R, Bäurle I.miR156 regulates tolerance to recurring environmental stress throughtranscription factors., 2014, 26: 1792–1807.
[23] Matthews C, Arshad M, Hannoufa A. Alfalfa response to heat stress is modulated by microRNA156., 2019, 165: 830–842
[24] 焦聪聪, 黄吉祥, 汪义龙, 张晓玉, 熊化鑫, 倪西源, 赵坚义. 利用非条件和条件QTL解析油菜产量相关性状的遗传关系.作物学报, 2015, 41: 1481–1489. Jiao C C, Huang J X, Wang Y L, Zhang X Y, Xiong H X, Ni X Y, Zhao J Y.Genetic analysis of yield-associated traits by unconditional and conditional QTL in., 2015, 41: 1481–1489 (in Chinese with English abstract).
[25] Staff T P O. Correction: a genome-wide perspective of miRNAome in response to high temperature, salinity and drought stresses in(Czern) L., 2015, 10: e92456.
[26] Yu X, Wang H, Lu Y, de Ruiter M, Cariaso M, Prins M, van Tunen A, He Y. Identification of conserved and novel microRNAs that are responsive to heat stress in., 2012, 63: 1025–1038.
[27] 陈丽. 甘蓝型油菜株型及角果长度相关miRNA和靶基因的挖掘. 华中农业大学博士学位论文, 湖北武汉, 2018. Chen L.The Study of miRNA and Targets Regulate Plant Architecture and Silique Length inL. PhD Dissertation of Huazhong Agricultural University, Wuhan, Hubei, China, 2018 (in Chinese with English abstract).
[28] Varkonyi-Gasic E, Wu R, Wood M, Walton E F, Hellens R P. Protocol: a highly sensitive RT-PCR method for detection and quantification of microRNAs., 2007, 3: 12.
[29] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCTmethod., 2001, 25: 402–408.
[30] Leng L, Liang Q, Jiang J, Zhang C, Hao Y, Wang X, Su W. A subclass of HSP70s regulate development and abiotic stress responses in., 2017, 130: 349–363.
[31] Wang W, Vinocur B, Shoseyov O, Altman A. Role of plant heat-shock proteins and molecular chaperones in the abiotic stress response., 2004, 9: 244–252.
[32] 胡秀丽, 李艳辉, 杨海荣, 刘全军, 李潮海. HSP70可提高干旱高温复合胁迫诱导的玉米叶片抗氧化防护能力. 作物学报, 2010, 36: 636–644. Hu X L, Li Y H, Yang H R, Liu Q J, Li C H. Heat shock protein 70 may improve the ability of antioxidant defense induced by the combination of drought and heat in maize leaves., 2010, 36: 636–644 (in Chinese with English abstract).
[33] Jacob P, Hirt H, Bendahmane A. The heat shock protein/ chaperone network and multiple stress resistance., 2017, 15: 405–414.
[34] Scharf K D, Berberich T, Ebersberger I, Nover L. The plant heat stress transcription factor (Hsf) family: structure, function and evolution., 2012, 1819: 104–119.
[35] Sung D Y, Guy C L. Physiological and molecular assessment of altered expression ofin. evidence for pleiotropic consequences., 2003, 132: 979–987.
[36] Cazalé A C, Clément M, Chiarenza S, Roncato M A, Pochon N, Creff A, Marin E, Leonhardt N, Noël L D. Altered expression of cytosolic/nuclearmolecular chaperone affects development and abiotic stress tolerance in., 2009, 60: 2653–2664.
[37] Young L W, Wilen R W, Bonham-Smith P C. High temperature stress ofduring flowering reduces micro- and megagametophyte fertility, induces fruit abortion, and disrupts seed production., 2004, 55: 485–495.
[38] Wang X, Yan B, Shi M, Zhou W, Zekria D, Wang H, Kai G. Overexpression of ain tobacco confers enhanced tolerance to heat stress., 2016, 253: 637–645.
附表1 novel-miR311的前体和成熟体序列
Supplementary table 1 novel-miR311 precursor sequence and mature sequence
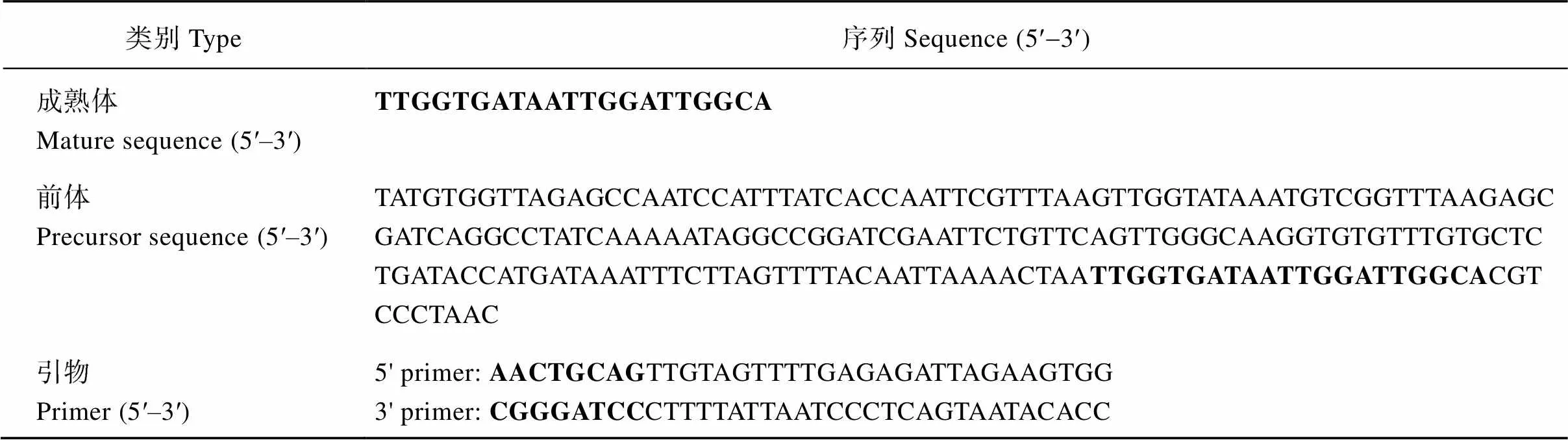
类别Type序列Sequence (5¢-3¢) 成熟体Mature sequence (5′–3′)TTGGTGATAATTGGATTGGCA 前体Precursor sequence (5′–3′)TATGTGGTTAGAGCCAATCCATTTATCACCAATTCGTTTAAGTTGGTATAAATGTCGGTTTAAGAGCGATCAGGCCTATCAAAAATAGGCCGGATCGAATTCTGTTCAGTTGGGCAAGGTGTGTTTGTGCTCTGATACCATGATAAATTTCTTAGTTTTACAATTAAAACTAATTGGTGATAATTGGATTGGCACGTCCCTAAC 引物Primer (5′–3′)5' primer: AACTGCAGTTGTAGTTTTGAGAGATTAGAAGTGG3' primer: CGGGATCCCTTTTATTAATCCCTCAGTAATACACC
附图1 novel-miR311茎环结构
Supplementary Fig. 1 novel-miR311stem-loop structure
Mechanism research of Bna-novel-miR311-module regulating heat stress response inL.
LU Hai-Qin1, CHEN Li1,2, CHEN Lei1, ZHANG Ying-Chuan1, WEN Jing1, YI Bin1, TU Jing-Xing1, FU Ting-Dong1, and SHEN Jin-Xiong1,*
1National Key Laboratory of Crop Genetic Improvement / National Engineering Research Center of Rapeseed, Huazhong Agriculatural University, Wuhan 430070, Hubei, China,2School of Advanced Agriculture and Bioengineering, Yangtze Normal University, Chongqing 408100, China
HSP70 (heat shock protein 70) participates in the response to heat stress, and can enhance plant heat tolerance, but there have been no reports of miRNA regulatingin rapeseed. In this study, a new miRNA, named novel-miR311, was identified in the shoot tip ofby high-throughput technology. novel-miR311 was present inbut not in, and 5¢-RACE technology confirmed that its two target genes, belonged to heat stress homologous protein gene(family), and could be cleavaged in. An overexpression vector of novel-miR311 was constructed and transformed intoand, and the expression ofin transgenic positive seedlings was decreased significantly. High temperature stress experiments showed that the growth potential and survival rates ofandpositive seedlings were lower than those of their corresponding controls. The qPCR results showed that the expression ofgene in rapeseed increased after heat stress than before stress. In conclusion, the results suggest that Bna- novel-miR311 could reduce the heat resistance ofandby mediating cleavaged of.
;; novel-miR311;; high temperature stress
10.3724/SP.J.1006.2020.04014
本研究由国家自然科学基金项目(31571698)资助。
This study was supported by the National Natural Science Foundation of China (31571698).
沈金雄, E-mail: jxshen@mail.hzau.edu.cn, Tel: 027-87281507
E-mail: 857929189@qq.com
2020-01-16;
2020-06-02;
2020-06-22.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20200622.1119.004.html

