小麦类胡萝卜素合成途径关键基因Lcye功能分析
翟胜男 郭 军 刘 成 李豪圣 宋健民 刘爱峰 曹新有 程敦公 李法计 何中虎 夏先春,* 刘建军,*
小麦类胡萝卜素合成途径关键基因功能分析
翟胜男1郭 军1刘 成1李豪圣1宋健民1刘爱峰1曹新有1程敦公1李法计1何中虎2夏先春2,*刘建军1,*
1山东省农业科学院作物研究所, 山东济南 250100;2中国农业科学院作物科学研究所, 北京 100081
小麦籽粒黄色素是面粉及面制品黄度形成的主要原因, 其主要成分是类胡萝卜素。ε-番茄红素环化酶(LCYE)是小麦类胡萝卜素生物合成途径的关键酶, 前人对其研究多集中于QTL定位、基因克隆和分子标记开发, 而基因功能和遗传调控机制尚不明确。本研究利用TILLING技术筛选EMS诱变群体, 对功能及遗传调控机制进行研究, 以期深入认识小麦籽粒黄色素含量形成的分子机制。在2491份M2代EMS诱变群体中共检测到21个基因的点突变, 包含6个错义突变, 2个同义突变和13个内含子突变,基因在该诱变群体中的突变频率为1/266.1 kb。PARSENP软件预测分析显示, M090815 (C2202T)和M091648 (G3284A)两个错义突变可能严重影响蛋白质功能。MEME分析结果表明, M090815和M092230 (G2195A)突变位点位于基因保守结构域内。6个错义突变植株与野生型杂交构建的F2代群体中, M090815突变位点显著降低籽粒黄色素含量, 证实该位点对LCYE功能具有重要影响。qRT-PCR (quantitative real-time PCR)分析也显示, M090815突变位点显著降低基因表达水平, 且和基因表达降低趋势相似, 而在花后14~28 d表现出补偿效应。本研究不仅验证基因功能, 也为面粉及其制品颜色性状改良提供了理论依据和种质资源。
EMS; TILLING; 面粉颜色; 黄色素含量; 遗传育种
面粉色泽是评价小麦粉品质的重要感官指标和市场指标。黄色素是小麦籽粒中最主要的天然色素, 是面粉及其制品黄度形成的主要原因。籽粒黄色素含量与面粉、面团黄度以及面包、面条颜色显著相关, 相关系数分别高达0.8~0.9和0.69~0.76[1-4]。中式面制品, 如面条、馒头、包子、饺子等对面粉的白度要求比较高。
类胡萝卜素是构成黄色素的主要组分。类胡萝卜素, 尤其是β-胡萝卜素, 具有抗氧化、抗癌、维生素A原、预防眼睛老年性黄斑病变、延缓衰老、提高免疫力等重要生理保健功能。人类和动物不能自身合成类胡萝卜素, 因此必须从外界摄取[5-6]。近年来, 随着人们营养和保健意识的增强, 提高小麦籽粒类胡萝卜素含量、培育亮黄色的面粉和面制品小麦品种, 逐渐成为新的育种目标。
植物类胡萝卜素生物合成涉及一个复杂的基因调控网络[6-7]。番茄红素环化是类胡萝卜素合成途径的重要分支点。植物体内普遍存在ε-番茄红素环化酶(lycopene epsilon cyclase, LCYE)和β-番茄红素环化酶(lycopene beta cyclase, LCYB)两种番茄红素环化酶。Howitt等[8]克隆了普通小麦基因, 发现其与3B染色体上黄色素含量QTL位点共分离, 证实基因是影响籽粒黄色素含量的关键基因。董长海[9]克隆了普通小麦3B和3D染色体上的基因全长, 并针对B基因组序列差异开发了显性标记。Crawford和Francki[10]克隆了基因, 并根据序列差异开发了功能标记。综上所述, 目前对小麦基因研究局限于QTL定位、基因克隆和分子标记开发, 其功能和遗传调控机制尚不明确, 严重影响和制约了小麦面粉及其制品颜色性状遗传改良的育种进程。因此, 加强基因功能及其遗传调控机制研究, 有助于进一步了解小麦籽粒黄色素含量形成的分子机制, 为培育符合市场需求的小麦新品种奠定理论基础。
定向诱导基因组局部突变技术(targeting induced local lesions in genomes, TILLING)是一种将诱发产生高频率点突变的化学诱变方法与PCR筛选和高通量检测方法有效结合, 快速高效检测目标区域点突变, 通过对其表型鉴定分析, 获得基因功能的反向遗传学研究方法[11-12]。与转基因和分子标记辅助选择等分子育种技术相比, TILLING技术还具有诱变育种稳定快、仅改变少数目标性状、无需进行繁琐耗时的转基因及杂交、回交等优点, 是一种高效定向的分子育种技术[13-14]。随着测序技术及作物基因组学的迅速发展, TILLING技术将在小麦基因功能分析、遗传调控及重要农艺、品质性状遗传改良中发挥重要作用[15-17]。
本研究应用TILLING技术筛选甲基磺酸乙酯(ethyl methane sulfonate, EMS)诱变群体, 根据小麦基因序列设计特异引物, 通过非变性聚丙烯酰胺凝胶电泳技术检测突变位点, 获得不同等位基因变异的突变植株, 对不同等位基因的遗传群体与表型进行分析, 鉴定各突变位点对LCYE功能的影响, 揭示小麦类胡萝卜素合成途径关键基因的功能和遗传调控机制, 为面制品颜色性状遗传改良提供理论基础和种质资源。
1 材料与方法
1.1 EMS诱变群体构建
EMS诱变群体构建参照Slade等[18]方法。首先筛选一批纯合稳定、大小一致、籽粒饱满的济麦20和济麦22小麦种子, 利用1.2%浓度的EMS进行诱变处理, 产生一系列的点突变; 将处理后的种子温室种植获得突变群体M1代; M1代种子大田种植获得2491份M2代植株(1251份济麦20, 1240份济麦22)。
1.2 应用TILLING技术筛选EMS突变体库
EMS突变库筛选参照Till等[19]方法, 具体步骤如下: (1) 突变体DNA池构建: 应用CTAB法[20]分别提取每个M2突变体植株的基因组DNA, 将其存放于96孔板中。利用NanoDrop-2000超微量分光光度仪(thermo scientific)测定DNA的浓度和质量。按8个样品一组将DNA进行等量混合, 构建8倍DNA混合池, 4℃保存备用。(2)特异性引物设计: 基于小麦同源基因序列差异, 设计A、B和D基因组特异性引物。利用中国春缺体-四体材料及PCR产物测序方法, 进行引物基因组特异性验证; 应用CODDLE (codons optimized to discover deleterious lesions, http://www.proweb.org/coddle/)软件分析扩增区域是否对基因功能起重要作用。最终4对特异性引物, 用于突变体筛选(表1)。(3) PCR扩增与异源双链生成: 以DNA混合池为模板进行PCR扩增, 反应体系: DNA 50 ng, PreMix 7.5 μL, 10 μmol L‒1上、下游引物各1 μL, ddH2O补足至15 μL; 反应程序: 首先95℃变性5 min; 然后95℃变性30 s, 退火温度从66℃开始, 每个循环降低0.3℃, 退火45 s, 72℃延伸1.5 min, 重复35个循环; 72℃延伸10 min; 然后99℃ 10 min, 85℃ 1 min, 退火温度从85℃开始, 每个循环降低0.5℃, 退火时间30 s, 共99个循环; 最后16℃保温备用。如果DNA混合池样本目标片段中含有突变位点, 扩增产物经过反复变性、复性将形成野生型和突变体扩增片段的异源双链(即含有错配碱基)。(4) CEL I酶切: 用特异性识别并切割错配碱基的核酸内切酶CEL I剪切异源双链核酸分子。酶切反应体系: 10×消化缓冲液2 µL, CEL I 1 µL, 异源双链DNA 15 µL, ddH2O补足至20 μL。45℃反应20 min, 随后加入EDTA (0.25 mol L–1) 5 µL终止酶切反应。(5) 非变性聚丙烯酰胺凝胶电泳检测: 利用非变性聚丙烯酰胺凝胶电泳技术检测CEL I酶切片段, 筛选获得含有突变位点的阳性DNA混合池。对阳性DNA混合池中的每个样本DNA逐一与野生型DNA进行等量混合, 重复上述步骤, 筛选获得阳性突变体单株。(6) 突变样本克隆测序: 对突变个体PCR产物进行克隆测序, 鉴定突变类型和位置。

表1 利用TILLING技术筛选Lcye突变体的引物信息
1.3 突变位点对蛋白功能影响预测
利用PARSESNP (project aligned related sequen ces and evaluate SNPs, http://www.proweb.org/pars esnp/)软件分析突变体植株DNA序列的突变类型, 预测突变位点对LCYE功能是否造成影响。当PSSM值大于10和SIFT (sorting intolerant from tolerant)值小于0.05的氨基酸改变被认为可能对蛋白质功能造成重要影响[21-22]。
1.4 突变位点功能分析
为了减小其他突变背景影响, 将含有错义突变位点的纯合M3植株与野生型植株进行杂交, 构建F2代群体, 用于分析突变位点对基因表达水平及蛋白质功能的影响。F2群体于2014—2015年度种植于北京, 行长2 m, 行距25 cm, 每行20株, 每个F2群体种20行, 田间管理采用常规方法。
利用克隆测序的方法, 鉴定F2群体中每个株系基因型(纯合突变型、杂合突变型和野生型)。每种基因型各选取10个生长发育进程一致的生物学重复, 记录开花期, 分别采集花后7、14、21和28 d籽粒, 立即置于液氮中, −80℃保存, 用于RNA提取和基因表达水平分析。单株收获, 成熟籽粒−20℃保存, 用于黄色素含量测定。
利用实时定量PCR (quantitative real-time PCR, qRT-PCR)技术, 测定F2群体中纯合突变型、杂合突变型和野生型植株籽粒不同发育时期(花后7、14、21和28 d)基因及其各同源基因表达量, 分析突变位点对基因表达水平的影响。具体步骤为: 应用RNAprep Pure植物总RNA提取试剂盒(TIANGEN Biotech, 中国北京)分别提取花后7、14、21和28 d籽粒总RNA, 纯合突变型、杂合突变型和野生型植株各3个生物学重复; 利用PrimeScript RT Reagent试剂盒(TaKaRa Bio Inc., Otsu, Japan)将其反转录成cDNA, 置于–20℃保存备用; 基于小麦同源基因cDNA序列间的保守性和差异性, 设计基因的保守性引物和A、B、D基因组特异性引物(表2), 对其进行溶解曲线分析和qRT-PCR产物克隆测序, 验证引物保守性和特异性, 普通小麦基因(AB181991)作为内参基因; 反应体系: LightCycler FastStart DNA Master SYBR Green (Roche Applied Sciences, USA) 10 µL, 上下游引物0.5 µmol L‒1, cDNA 50 ng, ddH2O补充至20 μL。反应程序: 95℃ 10 min; 95℃ 15 s, 60℃ 20 s和72℃ 20 s, 共40个循环; 应用公式2‒ΔΔCT计算目标基因相对表达量[23]。首先, 利用同一样本中基因转录水平来校正目标基因相对表达水平; 其次将野生型植株花后28 d籽粒目标基因相对表达量设为1, 计算不同基因型植株的籽粒不同发育时期目标基因的相对表达量。每个样本3次技术重复, 基因相对表达量用平均值±标准误差(standard error, SE)表示。
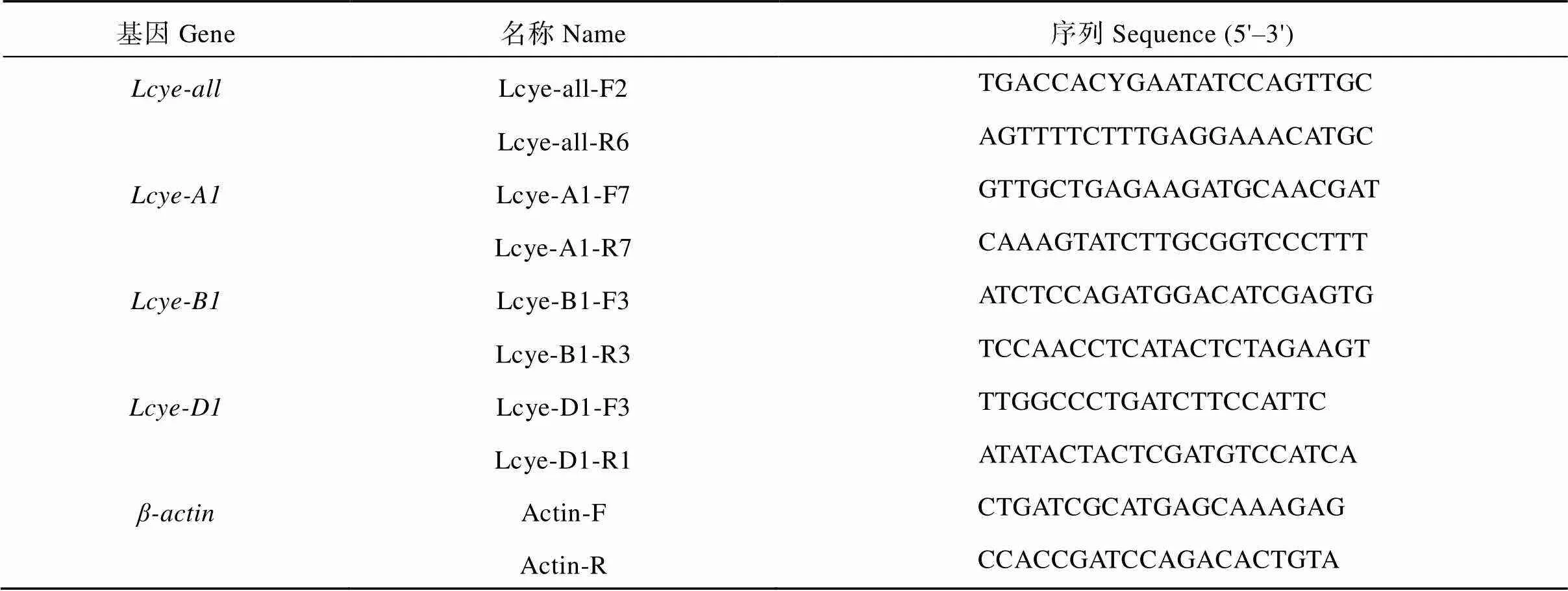
表2 Lcye基因的qRT-PCR引物信息
测定F2群体中纯合突变型、杂合突变型与野生型植株籽粒黄色素含量, 分析突变位点对LCYE蛋白功能的影响。每种基因型测定5个单株, 平均值作为该基因型的黄色素含量。籽粒黄色素含量的测定参照AACC方法14-50, 稍作改动。称取1 g全麦粉, 用水饱和正丁醇溶液(5∶1)振荡提取1 h; 2823´离心10 min。应用分光光度计测定上清液在436.5 nm处吸光值, 计算黄色素含量。每个样本3次技术重复, 黄色素含量用平均值±SE表示。
1.5 LCYE功能结构域预测
利用NCBI (national center for biotechnology information, http://www.ncbi.nlm.nih.gov/)数据库, 获得目前已知的27个物种基因的cDNA序列(附表1), 利用MEME Suite 5.1.0 (http://meme-suite. org/)预测LCYE功能结构域, 分析各突变位点在结构域中的分布情况。
1.6 统计分析
应用Student’s检验对F2群体中纯合突变型、杂合突变型和野生型植株籽粒基因表达差异和黄色素含量进行显著性分析。基因在EMS诱变群体中的突变密度=点突变数/检测总碱基数。
2 结果与分析
2.1 EMS突变体库筛选
应用TILLING技术, 在2491份M2代EMS诱变群体中共检测到21个基因的突变植株(表3)。采用非变性聚丙烯酰胺凝胶电泳技术分离CEL I酶切产物, 扩增片段150 bp内的错配超出检测范围, 将无法被检测到, 因此推测基因在该EMS诱变群体中的突变密度为1/266.1 kb。
突变体克隆测序和序列分析显示, 核苷酸从C到T的突变频率为57.1%, G到A的突变频率为38.1%, 还检测到1个T到C的特异突变位点(表3)。根据突变位置分类, 8个位于外显子区, 13个分布于内含子区(图1)。外显子区域的点突变又分为6个错义突变和2个同义突变(表3)。
2.2 突变位点对蛋白质功能影响预测
PARSESNP软件分析结果显示, 错义突变体M090815 (C2202T)和M091648 (G3284A)的PSSM值分别为26.9和27.7, SIFT值均为0, 推测这些突变位点可能对LCYE蛋白功能产生严重影响(表4)。
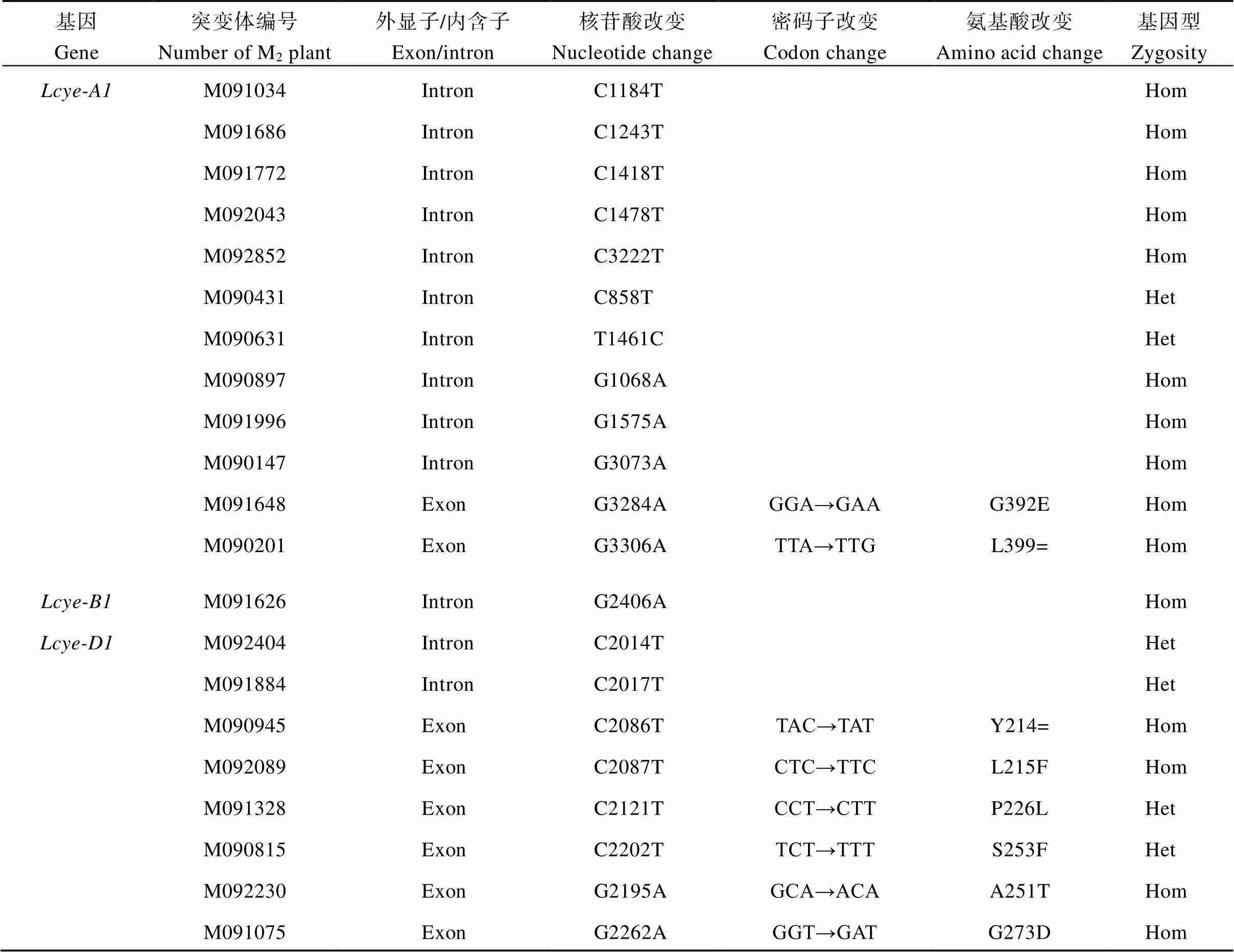
表3 利用TILLING技术筛选获得Lcye突变体信息
Hom: 纯合突变型; Het: 杂合突变型。Hom: homozygous mutants; Het: heterozygous mutants.
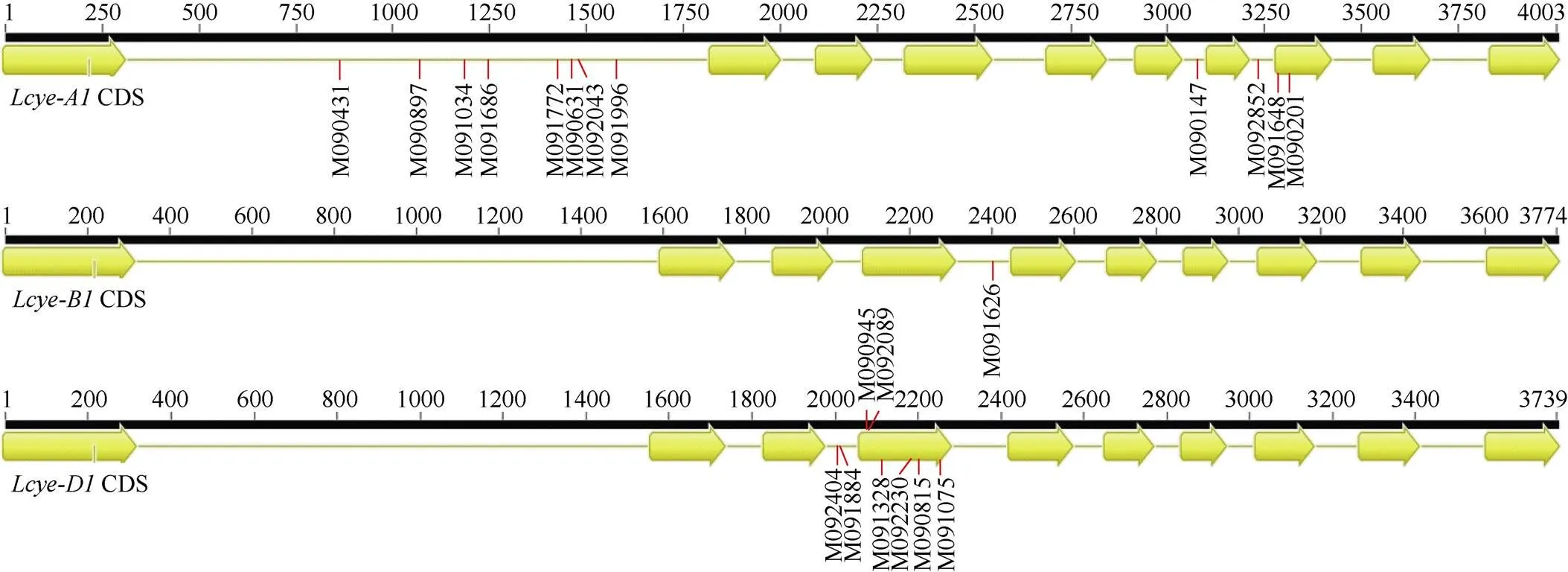
图1 Lcye突变位点分布图
黄色箭头代表外显子; 连线代表内含子。
Exons are represented by yellow arrows and introns by connecting lines.

表4 突变位点对蛋白功能影响严重度预测
2.3 突变体Lcye基因表达和黄色素含量分析
将6个纯合错义突变体与野生型植株杂交, 构建F2代群体, 分析突变位点对基因表达水平和籽粒黄色素含量的影响。结果表明, 6个F2群体中, 仅M090815 (C2202T)突变位点显著降低了基因表达和黄色素含量(图2和图3), 表明该突变位点对LCYE蛋白功能产生重要影响。
突变体M090815构建的F2群体中, 不同基因型植株籽粒及其同源基因表达水平如图2所示。花后7~21 d, 纯合突变型植株籽粒基因总表达量降低至野生型的59.0%~83.0%, 杂合型降低至71.5%~91.1%, 花后28 d各基因型表达差异不显著。除了纯合突变型在花后28 d表达量显著高于野生型外, 花后各时期和基因表达显示相似的下降趋势, 纯合突变型植株表达量降低至野生型的70.0%~78.7%和55.5%~92.0%,杂合型降低至83.1%~90.0%和75.2%~90.0%。在花后7 d, 各基因型表达量差异不显著,花后14~28 d, 表现出补偿效应, 纯合突变型比野生型表达量高33.4%~70.0%, 杂合型高0.7%~ 48.1%。相应地, 在突变体M090815构建的F2群体中, 纯合突变型植株成熟籽粒黄色素含量显著低于杂合突变型和野生型植株(图3, 1.63 vs. 1.90和2.02 μg g‒1)。
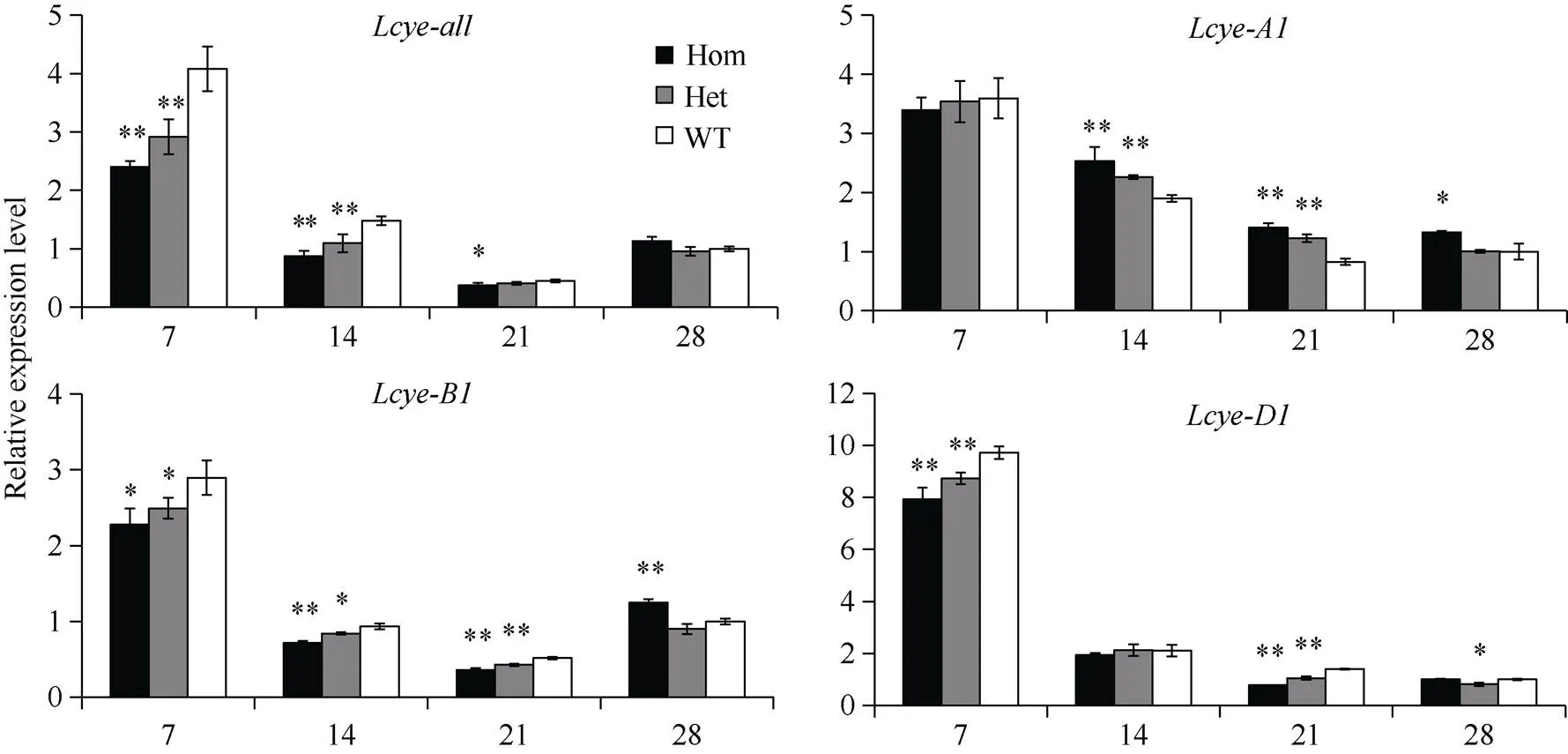
图2 突变体M090815的F2群体中不同基因型植株籽粒Lcye及其同源基因的相对表达量
*和**分别代表0.05和0.01显著水平的差异。Hom: 纯合突变型; Het: 杂合突变型; WT: 野生型。
*< 0.05, **< 0.01. Hom: homozygous mutants; Het: heterozygous mutants; WT: wild-type genotypes.
图3 突变体M090815的F2群体中不同基因型植株籽粒黄色素含量
Fig. 3 Yellow pigment content of different genotypes in F2populations derived from homozygous M090815 mutant crossed with wild-type plant
*代表0.05显著水平的差异。Hom: 纯合突变型; Het: 杂合突变型; WT: 野生型。
*< 0.05. Hom: homozygous mutants; Het: heterozygous mutants; WT: wild-type genotypes.
2.4 LCYE功能结构域预测
基于拟南芥()、水稻()、大麦()等27个物种已知的基因cDNA序列(附表1), 利用MEME Suite 5.1.0预测LCYE功能结构域, 共检测到3个结构域(图4)。6个错义突变中, M090815 (C2202T)和M092230 (G2195A)突变位点恰好位于结构域1内, 且M090815突变位点在27个物种中非常保守, M092230突变位点存在G、A和U三种碱基变异。
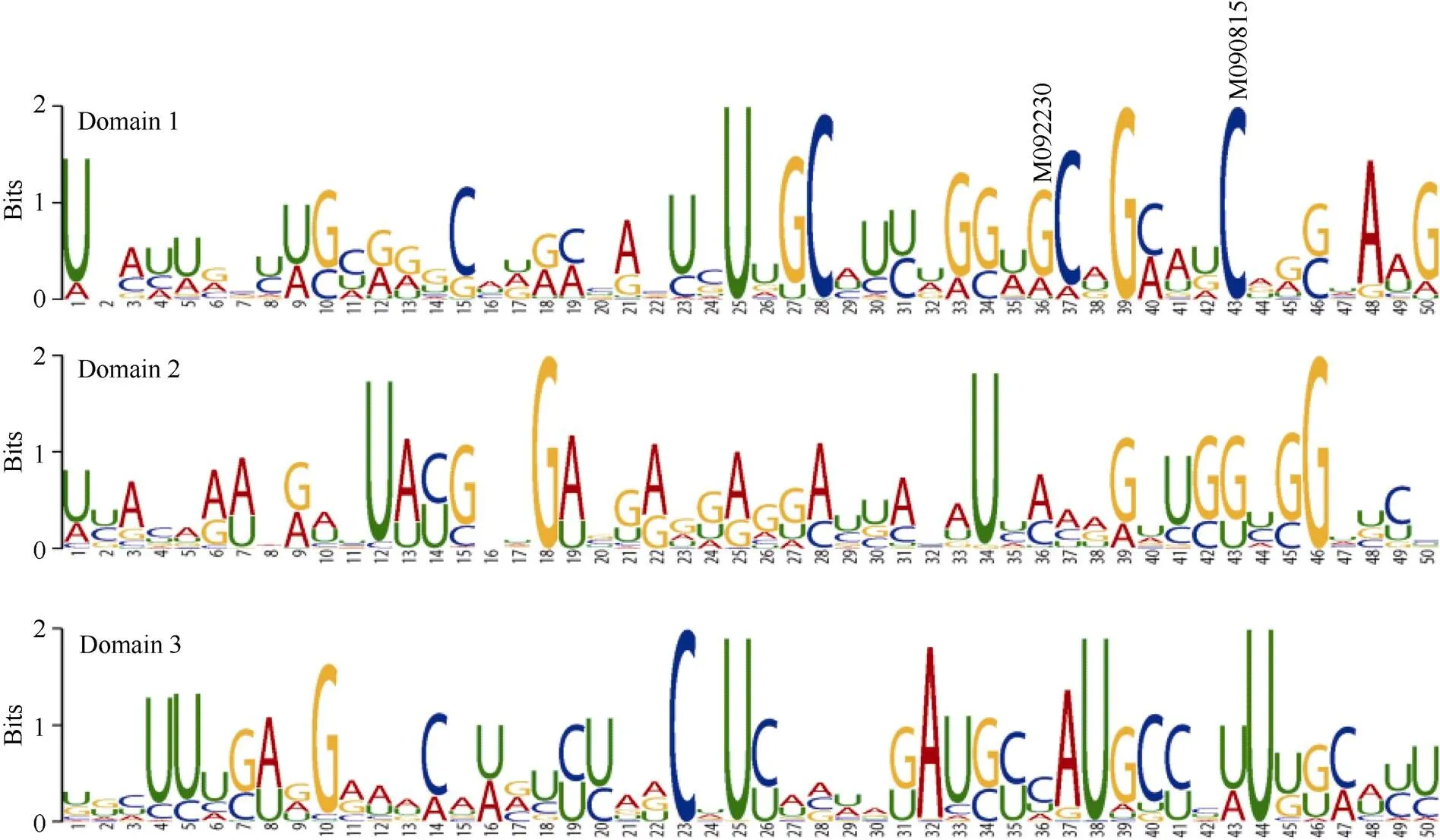
图4 Lcye功能结构域预测
3 讨论
3.1 LCYE调控小麦籽粒类胡萝卜素合成
小麦籽粒类胡萝卜素影响面制品营养品质和表观色泽。番茄红素环化是类胡萝卜素合成途径中一个重要的分节点, 番茄红素在LCYB催化下, 经β-β途径生成β-胡萝卜素、玉米黄质、花药黄质和堇菜黄质等叶黄素类物质; 在LCYE和LCYB共同催化下,经β-ε途径生成α-胡萝卜素和叶黄体素。类胡萝卜素含量和组成在小麦籽粒发育过程中是动态变化的, 具有复杂的遗传调控网络[8]。β-β途径在籽粒发育早期占有较高表达水平, 随着籽粒生长发育表达量和所占比例逐渐下降, 成熟籽粒几乎检测不到玉米黄质、环氧玉米黄质和堇菜黄质等类胡萝卜素。相反, β-ε途径在整个籽粒发育过程中稳定表达, 叶黄体素成为构成成熟籽粒类胡萝卜素的主要成分[8]。
通过调节LCYB和LCYE的相对活性和相对含量可以决定番茄红素转化为α-胡萝卜素和β-胡萝卜素的比例。在番茄突变体中,转录水平提高, 果实内δ-胡萝卜素含量大量增多; 而在番茄突变体中,过表达, 果实中累积大量的β-胡萝卜素[24]。对比两种突变体的差异进一步证实番茄果实中类胡萝卜素的积累主要是相关基因在转录水平上差异表达的结果[25]。
Richaud等[26]应用TILLING技术, 筛选硬粒小麦突变体, W437*()突变位点显著增加突变体叶片中β-胡萝卜素和类胡萝卜素的含量, 但对籽粒中类胡萝卜素含量无显著影响。本研究利用TILLING技术筛选普通小麦EMS突变体库, 获得基因一系列等位变异, 研究其对基因表达和籽粒黄色素含量的影响, 为基因功能研究和面制品颜色性状改良奠定理论基础和提供重要种质资源。
3.2 Lcye突变体筛选
TILLING技术有效结合了高频率点突变与现代分析检测技术, 仅需要较小的突变群体便可快速有效地筛选到一系列目标基因点突变, 逐渐成为植物功能基因组学、作物遗传育种以及自然资源遗传多样性评估等研究的重要手段[27-28]。目前, 该技术已广泛应用于水稻[29]、玉米[30]、小麦[31-32]、大麦[33]、高粱[34]等20多种作物。研究表明小麦基因突变频率远远高于拟南芥、水稻和玉米等植物, TILLING技术在小麦等麦类作物中的应用潜力更为巨大、前景更为光明。
对于小麦等基因组复杂的多倍体物种, 基因多拷贝是限制TILLING技术高效应用的一个瓶颈。设计特异性引物至关重要, 否则会影响检测效率。小麦基因A、B和D同源基因间序列相似性非常高(89.1%~97.0%), 设计特异性引物非常困难。结合CODDLE程序给出的EMS诱导植株产生有害突变的可能范围, 最终筛选到4对引物用于突变体检测(表1)。
酶切产物的检测方法有多种, 一般采用高效液相色谱技术、聚丙烯酰胺凝胶电泳、琼脂糖凝胶电泳以及双色红外荧光检测技术[35-38]。本研究采用非变性聚丙烯酰胺凝胶电泳检测技术, 既不使用荧光标记引物, 又不使用昂贵的变性凝胶电泳成像系统, 有效地简化了实验流程, 降低了实验成本, 在一定程度上扩大TILLING的应用范围和工作效率。共筛选到21个突变位点, 推测在EMS诱变群体中的突变频率为(1/266.1 kb), 远低于Uauy等[37]应用非变性聚丙烯酰胺凝胶技术检测到的六倍体小麦突变频率(1/38 kb)。这可能是由于基因目标区域G/C含量不同或者非变性聚丙烯酰胺凝胶电泳检测技术对8样本DNA混池的检测灵敏度较低所致。
3.3 影响LCYE功能的重要调控位点
基于拟南芥、水稻、大麦等27个物种的cDNA序列, 利用MEME预测LCYE功能结构域, 结果显示M090815 (C2202T)和M092230 (G2195A)突变位点恰好位于结构域1内(图4)。M092230 (G2195A)突变位点在自然界物种进化中存在G、A和U三种碱基变异, 因此推测G到A核苷酸突变对LCYE功能未产生影响。而M090815 (C2202T)突变位点在27个物种中高度保守, 推测该位点对LCYE功能具有重要影响。PARSESNP软件预测显示M090815 (C2202T)和M091648 (G3284A)突变位点可能对蛋白功能产生严重影响(表4), 进一步表明M090815 (C2202T)突变位点对LCYE蛋白功能的重要性。M090815构建的F2群体中, 与野生型植株相比, 纯合突变型植株籽粒黄色素含量显著下降(图3), 证实M090815 (C2202T)突变位点对LCYE功能具有重要影响。然而在M091648构建的F2群体中纯合突变型与野生型植株相比籽粒黄色素含量差异并不显著。这种不一致性可能是由于PARSESN软件是基于序列同源性及氨基酸物理特性进行突变位点对蛋白功能影响严重度的预测, 而有些位点可能并不参与蛋白功能调控[21-22]。
对M090815构建的F2群体进行及其同源基因表达水平分析显示, 与野生型植株相比, 纯合突变型植株籽粒基因总表达量显著降低(图2)。籽粒发育各时期, 除在纯合突变型植株中表达水平在花后28 d高于野生型外,和基因表达水平均呈下降趋势。而在花后7 d, 各基因型植株表达差异不显著, 花后14~28 d, 表现出补偿效应。推测和基因表达受协同调控, 而表达调控机制可能与之不同。序列分析发现,与和的序列相似性分别为89.1%和89.2%, 而和基因序列相似性高达97.0%, 为上述推测提供间接支持。鉴于上述结果只通过一个F2群体获得, 因此仍需进一步研究。
3.4 分子育种
种质资源缺乏成为小麦面粉及其制品颜色改良的“瓶颈”, 严重影响我国小麦品种面制品颜色性状的遗传改良。EMS诱变可以创造大量的等位变异, 且在后代稳定遗传, 由于不涉及转基因操作, 获得的优异突变体可以直接用于育种实践[39-40]。在我国, 面制品以蒸煮为主, 细腻洁白的面粉备受消费者青睐。本研究采用TILLING技术筛选获得的显著降低籽粒黄色素含量的M090815突变体, 该突变体农艺性状与野生型济麦20无显著差异, 可作为面粉颜色遗传改良的重要种质资源。此外, 济麦20为高产优质面包、面条兼用型强筋小麦; 济麦22为超高产稳产广适多抗小麦品种, 两个均为大面积推广种植的优良品种, 综合性状良好。以上述两个品种作诱变基础材料创制的优异突变体, 更适宜于用作杂交亲本, 以期快速培育出高产优质小麦新品种。
竞争性等位基因特异性PCR (Kompetitive Allele Specific PCR, KASP)是基于引物末端碱基的特异性匹配对SNP进行双等位基因分型技术, 具有高通量、准确性高、稳定性好和检测成本低等优点, 是目前广泛使用的SNP分型方法[41-42]。因此, 在后续工作中针对M090815突变体基因C2202T的SNP变异位点开发KSAP标记, 以期为利用M090815突变体对面制品颜色性状进行高效、可靠的分子标记辅助育种提供技术支撑。
4 结论
本研究以济麦20和济麦22的EMS诱变群体为材料, 利用TILLING技术筛选小麦类胡萝卜素合成关键基因的突变体, 共获得21个基因的点突变。生物信息学分析、基因表达水平和黄色素含量测定均显示, M090815 (C2202T)突变位点对LCYE蛋白功能具有重要影响。M090815突变位点显著降低基因表达水平, 且和基因表达降低趋势相似, 而在花后14~28 d表现出补偿效应。本研究获得的突变体不仅为开展基因功能研究提供了良好的试验材料, 也为面制品颜色性状遗传改良提供了丰富的种质资源。
[1] Mares D J, Campbell A W. Mapping components of flour and noodle colour in Australian wheat., 2001, 52: 1297–1309.
[2] Adom K K, Sorrells M E, Liu R H.Phytochemicalprofilesandantioxidantactivityofwheatvarieties. J AgricFood Chem, 2003, 51: 7825–7834.
[3] Fratianni A, Irano M, Panfili G, Acquistucci R. Estimation of color of durum wheat. Comparison of WSB, HPLC, and reflectance colorimeter measurements. J AgricFood Chem, 2005, 53: 2373–2378.
[4] Cong L, Wang C, Li Z Q, Chen L, Yang G X, Wang Y S, He G Y. cDNA cloning and expression analysis of wheat (L.) phytoene and ζ-carotene desaturase genes., 2010, 37: 3351–3361.
[5] 李文爽, 夏先春, 何中虎. 普通小麦类胡萝卜素组分的超高效液相色谱分离方法. 作物学报, 2016, 42: 706–713. Li W S, Xia X C, He Z H. Establishment of Ultra performance liquid chromatography (UPLC) protocol for analyzing carotenoids in common wheat., 2016, 42: 706–713 (in Chinese with English abstract).
[6] Cazzonelli C I, Pogson B J. Source to sink: regulation of carotenoid biosynthesis in plants., 2010, 15: 266–274.
[7] Zhu C F, Bai C, Sanahuja G, Yuan D W, Farré G, Naqvi S, Shi L X, Capell T, Christou P. The regulation of carotenoid pigmentation in flowers., 2010, 504: 132–141.
[8] Howitt C A, Cavanagh C R, Bowerman A F, Cazzonelli C, Rampling L, Mimica J L, Pogson B J. Alternative splicing, activation of cryptic exons and amino acid substitutions in carotenoid biosynthetic genes are associated with lutein accumulation in wheat endosperm., 2009, 9: 363–376.
[9] 董长海. 普通小麦籽粒黄色素含量相关基因的克隆与功能标记开发. 河北农业大学硕士学位论文, 河北保定, 2011. pp 32–33. Dong C H. Cloning of Genes Associated with Grain Yellow Pigment Content in Common Wheat and Development of Functional Markers. MS Thesis of Agricultural University of Hebei, Baoding, Hebei, China, 2011. pp 32–33 (in Chinese with English abstract).
[10] Crawford A C, Francki M G. Lycopene-e-cyclase () is functionally associated with quantitative trait loci for flour b* colour on chromosome 3A in wheat (L.)., 2013, 31: 737–741.
[11] Till B J, Clbert T, Tompa R, Enns L C, Codomo C A, Johnson J E, Reynolds S H, Henikoff J G, Greene E A, Steine M N, Comai L, Henkoff S. High-throughput TILLING for functional genomics. In: Grotewold E ed. Plant Functional Genomics. Totowa N J, USA: Humana Press, 2003. pp 205–220.
[12] 闫智慧, 郭会君, 徐荣旗, 刘录祥. TILLING技术的发展及其在不同植物中的应用. 核农学报, 2014, 28: 224–233. Yan Z H, Guo H J, Xu R Q, Liu L X. Development of TILLING technology and its application in plants., 2014, 28: 224–233 (in Chinese with English abstract).
[13] 侯彩玲, 陈龙, 刘晓萌, 赵锦慧, 卢龙斗. TILLING技术在作物品质改良中的应用. 种子, 2008, 27(11): 77–80. Hou C L, Chen L, Liu X M, Zhao J H, Lu L D. Application of TILLING technology on the improvement of crop quality., 2008, 27(11): 77–80 (in Chinese).
[14] 韩宁, 唐丹, 刘文, 闫丽, 胡晓君. Tilling技术及其在小麦中的应用研究进展. 麦类作物学报, 2013, 33: 1054–1057. Han N, Tang D, Liu W, Yan L, Hu X J. Development of targeting induced local lesions in genomes and its application in wheat (L.)., 2013, 33: 1054–1057 (in Chinese with English abstract).
[15] 陈锋, 徐艳花, 董中东, 许海霞, 程西永, 詹克慧, 崔党群. TILLING 技术的形成和发展及其在麦类作物中的应用. 麦类作物学报, 2010, 30: 178–182. Chen F, Xu Y H, Dong Z D, Xu H X, Cheng X Y, Zhan K H, Cui D Q. Development of targeting induced local lesion in genomes and its application incrops., 2010, 30: 178–182 (in Chinese with English abstract).
[16] 潘娜, 郭会君, 赵世荣, 王广金, 刘录祥. TILLING技术在作物突变研究中的应用现状与前景. 植物遗传资源学报, 2011, 12: 581–587. Pan N, Guo H J, Zhao S R, Wang G J, Liu L X. Current status and perspectives of TILLING technique for crop mutagenesis research., 2011, 12: 581–587 (in Chinese with English abstract).
[17] Zhai S N, Li G Y, Sun Y W, Song J M, Li J H, Song G Q, Li Y L, Ling H Q, He Z H, Xia X C. Genetic analysis of phytoene synthase 1 () gene function and regulation in common wheat., 2016, 16: 228.
[18] Slade A J, Fuerstenberg S I, Loeffler D, Steine M N, Facciontti D. A reverse genetic, nontransgenic approach to wheat crop improvement by TILLING., 2005, 23: 75–81.
[19] Till B J, Zerr T, Comai L, Henikoff S. A protocol for TILLING and Ecotilling in plants and animals., 2006, 1: 2465–2477.
[20] Doyle J J, Doyle J L. A rapid DNA isolation procedure from small quantities of fresh leaf tissues., 1987, 19: 11–15.
[21] Ng P C, Henikoff S. SIFT: predicting amino acid changes that affect protein function., 2003, 31: 3812–3814.
[22] Taylor N E, Greene E A. PARSESNP: a tool for the analysis of nucleotide polymorphisms., 2003, 31: 3808–3811.
[23] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCTmethod., 2001, 25: 402–408.
[24] Hornero-Mendez D, de Guevara R G L, Minguez-Mosquera M I. Carotenoid biosynthesis changes in five red pepper (L.) cultivars during ripening. Cultivar selection for breeding., 2000, 48: 3857–3864.
[25] Ronen G, Carmel-Goren L, Zamir D, Hirschberg J. An alternative pathway to beta-carotene formation in plant chromoplasts discovered by map-based cloning ofandcolor mutations in tomato., 2000, 97: 11102–11107.
[26] Richaud D, Stange C, Gadaleta A, Colasuonno P, Parada R, Schwember A R. Identification of Lycopene epsilon cyclase () gene mutants to potentially increase β-carotene content in durum wheat (L. ssp.) through TILLING., 2018, 13: e0208948.
[27] Gilchrist E J, Haughn G W. TILLING without a plough: a new method with applications for reverse genetics., 2005, 8: 211–215.
[28] Till B J, Datta S, Jankowicz-Cieslak J. TILLING: the Next Generation. In: Varshney R, Pandey M, Chitikineni A, eds. Plant Genetics and Molecular Biology. Advances in Biochemical Engineering/Biotechnology, Vol. 164. Springer, Cham, 2018. pp 139–160. https://doi.org/10.1007/10_2017_54.
[29] Till B J, Cooper J, Tai T H, Colowit P, Greene E A, Henikoff S, Comai L. Discovery of chemically induced mutations in rice by TILLING., 2007, 7: 19.
[30] Till B J, Reynolds S H, Weil C, Springer N, Burtner C, Young K, Bowers E, Codomo C A, Enns L C, Odden A R, Greene E A, Comai L, Henikoff S. Discovery of induced point mutations in maize genes by TILLING., 2004, 4: 12.
[31] Acevedo-Garcia J, Spencer D, Thieron H, Reinstädler A, Hammond-Kosack K, Phillips A L, Panstruga R.-based powdery mildew resistance in hexaploid bread wheat generated by a non-transgenic TILLING approach., 2017, 15: 367–378.
[32] Kim H, Yoon M R, Chun A, Tai T H. Identification of novel mutations in the rice starch branching enzyme I gene via TILLING by sequencing., 2018, 214: 12.
[33] Gottwald S, Bauer P, Komatsuda T, Lundqvist U, Stein N. TILLING in the two-rowed barley cultivar ‘Barke’ reveals preferred sites of functional diversity in the gene., 2009, 2: 258.
[34] Nida H, Blum S, Zielinski D, Srivastava D A, Elbaum R, Xin Z, Erlich Y, Fridman E, Shental N. Highly efficient de novo mutant identification in aTILLING population using the ComSeq approach., 2016, 86: 349–359.
[35] Colbert T, Till B J, Tompa R, Reynolds S, Steine M N, Yeung A T, McCallum C M, Comai L, Henikoff S. High-throughout screening for induced point mutations., 2001, 126: 480.
[36] Dong C, Dalton-Morgan J, Vincent K, Sharp P. A modified TILLING method for wheat breeding., 2009, 2: 39–47.
[37] Uauy C, Paraiso F, Colasuonno P, Tran R K, Tsai H, Berardi S, Comai L, Dubcovsky J. A modified TILLING approach to detect induced mutations in tetraploid and hexaploid wheat., 2009, 9: 115–128.
[38] Colasuonno P, Incerti O, Lozito M L, Simeone R, Gadaleta A, Blanco A. DHPLC technology for high-throughput detection of mutations in a durum wheat TILLING population., 2016, 17: 43.
[39] Slade A J, McGuire C, Loeffler D, Mullenberg J, Skinner W, Fazio G, Holm A, Brandt K M, Steine M N, Goodstal J F, Knauf V C. Development of high amylose wheat through TILLING., 2012, 12: 69–85.
[40] 何中虎, 夏先春, 陈新民, 庄巧生. 中国小麦育种进展与展望. 作物学报, 2011, 37: 202–215. He Z H, Xia X C, Chen X M, Zhuang Q S. Progress of wheat breeding in China and the future perspective., 2011, 37: 202–215 (in Chinese with English abstract).
[41] Semagn K, Babu R, Hearne S, Olsen M. Single nucleotide polymorphism genotyping using Kompetitive Allele Specific PCR (KASP): overview of the technology and its application in crop improvement., 2014, 33: 1–14.
[42] Shannon G J, Nguyen H T. Development of SNP genotyping assays for seed composition traits in soybean., 2017, 2017: 6572969.
附表1 27个物种基因cDNA序列信息
Supplementary table 1 Information of cDNA sequences of Lcye genes in 27 plant species
GenBank: https://www.ncbi.nlm.nih.gov/genbank/.
Functional analysis ofgene involved in the carotenoid synthesis in common wheat
ZHAI Sheng-Nan1, GUO Jun1, LIU Cheng1, LI Hao-Sheng1, SONG Jian-Min1, LIU Ai-Feng1, CAO Xin-You1,CHENG Dun-Gong1, LI Fa-Ji1, HE Zhong-Hu2, XIA Xian-Chun2,*, and LIU Jian-Jun1,*
1Crop Research Institute, Shandong Academy of Agricultural Sciences, Jinan 250100, Shandong, China;2Institute of Crop Sciences, Chinese Academy of Agricultural Sciences, Beijing 100081, China
Yellow pigment in wheat grains, mostly composed of carotenoids, is a main factor for the yellowness of flour and its end-used products. Lycopene epsilon cyclase (LCYE) is a key enzyme for the carotenoid biosynthesis pathway in wheat. Previous studies ofgene mainly focused on QTL mapping, gene cloning, and molecular marker development, but its function and genetic regulatory mechanisms remained unclear. In the present study, in order to further understanding the molecular mechanism of yellow pigment formation in wheat grains, the function and genetic regulation ofwere studied by TILLING to screen the EMS-mutagenised population. A total of 21mutations including six missense mutations, two synonymous mutations and 13 intron mutations were detected consisted from 2491 M2EMS-mutagenised population. The mutation frequency ofin the population was 1/266.1 kb. Two missense mutations (M090815 and M091648) were predicted to have severe effects on LCYE protein function based on PARSENP software. MEME analysis showed that the mutation sites of M090815 and M092230 were located on the conserved domain ofgene. In F2populations crossing by six missense mutants and the wild type, C2202T mutation in M090815 significantly reduced yellow pigment content in grains, indicating the mutation played an important effect on LCYE function. The quantitative real-time PCR (qRT-PCR) results also showed that the expression level ofgene were significantly reduced, and the decrease trend ofandexpression level was similar during different seed developmental stages, while the expression level ofexhibited a compensation effect at 14–28 days post anthesis. This study identifiedgene function, and provided germplasms and a theoretical basis for the improvement of flour color traits and end-used products.
EMS; TILLING; flour color; yellow pigment content; genetics and breeding
10.3724/SP.J.1006.2020.01013
本研究由国家自然科学基金项目(31701420), 山东省农业科学院农业科技创新工程(CXGC2018E01), 中国科协青年人才托举工程(2017QNRC001)和山东省农业良种工程项目(2019LGC001)资助。
This study was supported by the National Natural Science Foundation of China (31701420), the Agricultural Scientific and Technological Innovation Project of Shandong Academy of Agricultural Sciences (CXGC2018E01), the Young Elite Scientists Sponsorship Program by CAST (2017QNRC001), and the Agricultural Variety Improvement Project of Shandong Province (2019LGC001).
夏先春, E-mail: xiaxianchun@caas.cn, Tel: 010-82108610; 刘建军, E-mail: ljjsaas@163.com, Tel: 0531-66659561
E-mail: zsn19870322@163.com, Tel: 0531-66659561
2020-02-18;
2020-06-02;
2020-06-12.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20200612.1151.004.html

