白菜型冬油菜温敏不育系PK3-12S育性转换的差异蛋白质组学分析
米文博 方 园 刘自刚 徐春梅 刘高阳 邹 娅 徐明霞 郑国强 曹小东 方新玲
白菜型冬油菜温敏不育系PK3-12S育性转换的差异蛋白质组学分析
米文博 方 园 刘自刚*徐春梅 刘高阳 邹 娅 徐明霞 郑国强 曹小东 方新玲
甘肃省干旱生境作物生物学重点实验室 / 甘肃省作物遗传改良与种质创新重点实验室 / 甘肃省油菜工程与技术研究中心 / 甘肃农业大学农学院, 甘肃兰州 730070
为揭示温敏不育系PK3-12S育性转换机制, 本研究以白菜型冬油菜温敏不育系PK3-12花药为材料, 采用2-DE和LC-MS/MS质谱鉴定等差异蛋白组学方法, 分离鉴定了PK3-12在不育/可育条件下花药差异表达蛋白质, 并对差异表达蛋白进行了生物信息学分析; 进而采用RT-PCR检测了PK3-12在不育/可育条件下花蕾发育进程中差异蛋白编码基因表达量变化。结果表明, 高温不育条件下, PK3-12花药形态瘪小, 药室有少量败育花粉, 育性转换受1对隐性基因控制, 表达变化量在2倍以上差异蛋白质点31个, 其中增量表达蛋白质点6个, 减量表达蛋白质点11个, 表达完全抑制蛋白点12个, 不育花药特异表达蛋白点2个。质谱鉴定出15个差异蛋白质, 参与信号转导通路、二羧基乙醛酸代谢、糖酵解代谢、次生合成代谢、氨基酸生物合成、分支酸生物合成、碳代谢途径等细胞过程。Rubisco亚基连接蛋白编码基因开放读码框(open reading frame, ORF)长度为1095 bp, 编码364个氨基酸; 与可育花蕾相比, 发育进程中不育花蕾基因、膜联蛋白基因()、BetVI过敏原家族基因()表达明显下调, 表明上述基因可能参与了温敏不育系PK3-12S育性的转换。
白菜型冬油菜; 温敏不育; 差异蛋白组学; 基因表达
油菜是我国四大油料作物之一, 是继水稻、小麦、玉米、大豆之后的第五大农作物。近年来, 我国油菜播种面积及产量均居世界前列[1-3], 但国产食用油脂仅占国内消费市场的35%~40%, 中国食用植物油供应长期处于严重短缺状态。
中国北方寒旱区冬季严寒漫长, 一般抗寒作物因难以在该区安全越冬, 土地在冬季大量闲置[4]。冬油菜具有喜冷凉的生物学特性, 如能利用北方冬闲田进行冬油菜种植, 冬油菜出苗后叶片可很快完全覆盖地表, 能有效降低地表土壤风蚀, 同时冬油菜种植能高效利用北方秋末早春光热水等自然资源, 发展复种, 缓解我国使用油脂短缺问题[5]。目前中国北方寒旱区种植的冬油菜品种均为杂合异质群体品种, 栽培群体整齐度差、品种退化快、种性保持困难、产量进一步提高难度大等, 是目前该区冬油菜种植所面临的突出问题[6]。
温(光)敏生态型雄性不育/可育两用系, 具有育种程序简化、亲本组配自由、易出强优势组合、杂交种生产成本低等优点[7]。杂种优势利用是提高作物产量和增强抗逆性的重要途径, 雄性不育是杂种优势利用的一种有效遗传工具[8]。蛋白质是基因表达的终产物和基因功能的执行者[9], 蛋白质在特定组织或发育的某一阶段中表达分析是了解生物学过程的关键, 对了解雄性不育花药败育发生的原因及其生理生化代谢机制具有重要作用[10]。采用双向电泳(two-dimensional electrophoresis, 2-DE)技术分离差异蛋白, 对差异蛋白进行质谱鉴定, 生物信息学方法对差异蛋白进行功能富集与分类, 筛选与不育表型关联的关键蛋白及编码基因, 是植物生态型雄性不育/可育两用系育性转换机制分析的常规技术。Zhang等[8]采用2-DE技术从甘蓝型油菜温敏不育系SP2S花药中分离出28个差异表达蛋白, 与氨基酸代谢、光合作用、蛋白质合成和降解、脂质代谢、细胞骨架、RNA修饰、氧化还原酶和防御反应等有关。Xiao等[11]从水稻温敏不育系ZHU-1S可育/不育花药中分离出50个差异蛋白点, 质谱鉴定出20个蛋白质与不育发生相关。Song等[12]比较了2个水稻温敏不育系ZHU-1S和ZHUN S育性转化关键期花药蛋白组差异, 共分离鉴定出80个差异蛋白质, 参与了16种细胞代谢途径。
目前国内学者已在暖温带、亚热带冬油菜种植群体中, 分离培育出多个甘蓝型油菜温敏不育两用系[13-16], 在甘蓝型油菜杂种优势利用基础研究和两系杂交种生产等方面发挥了重要作用。然而这些温敏不育系材料适宜冬季温度温和的中国南方地区种植, 属春性/半冬性不抗寒材料。中国北方寒旱区冬季严寒漫长、极端低温低, 在北方冬油菜区种植上述温敏不育系材料均不能越冬, 难以应用于该区冬油菜生产, 选育强抗寒冬油菜温敏不育系及其育性转换机制等方面的研究, 对促进北方寒旱区冬油菜生产具有重要意义。本课题组在强抗寒白菜型冬油菜群体中, 筛选培育出强抗寒温敏雄性不育系PK3-12S, 通过对温敏不育系花器官形态特征、育性转换温度及遗传学和差异蛋白组学分析, 揭示温敏不育系PK3-12S育性转换机制, 为白菜型冬油菜杂种优势利用奠定基础。
1 材料与方法
1.1 试验材料
强抗寒白菜型冬油菜温敏不育系PK3-12S, 是由甘肃农业大学油菜育种课题组筛选的自然突变体。2015年8月13日盆栽, 每盆留苗4株, 于人工气候箱培养, 设置光强50~76 μmol m-2s-1, 相对湿度45%, 温度昼20℃/夜15℃。四叶期至五叶期4℃春化处理28 d, 至开花前7 d时将盆栽植株分成2份, 1份进行高温27℃/22℃处理, 另1份仍置于昼20℃/夜15℃温度下, 每份3盆。开花进行育性鉴定后, 取不同大小花蕾混合[幼蕾(幼蕾期)∶大蕾(花萼开裂期)∶花(花期) = 1∶1∶1]后提取总蛋白质。试验进行3次重复。
在育性遗传分析中使用的亲本材料QX6-2、QX21-2、LX2-3, 及温敏不育系PK3-12S均由甘肃农业大学油菜育种课题组提供, 盆栽苗培养4~5片真叶进行春化处理, 花期去雄杂交获得F1种子, F1自交获得F2, F2花期进行育性鉴定与统计。
1.2 方法
1.2.1 白菜型冬油菜PK3-12S花粉形态观察及育性鉴定 开花当日每株取5个花药, 用解剖针将花药切断将花粉粒挤出, 用I2-KI染色, 根据染色结果将花粉粒分为3种类型。(1)典败: 花粉粒发育不正常, 呈不规则形状, I2-KI染色不着色; (2)圆败: 花粉粒圆形, I2-KI染色呈浅黄色; (3)正常花粉粒: 花粉粒圆形, I2-KI染色均匀且为红褐色。
1.2.2 白菜型冬油菜PK3-12S遗传分析 以温敏不育系PK3-12S为母本, 白菜型冬油菜品系QX6-2、QX21-2、LX2-3为父本, 花期去雄杂交组配组合, F1盆栽低温培养, 花前7 d置于高温生境, 花期鉴定育性, 并套袋自交和回交。每个组合的F2和BC1, 及F1盆栽种植100株以上, 于花期进行育性鉴定。
1.2.3 白菜型冬油菜PK3-12S花蕾总蛋白提取及2D电泳分离与质谱鉴定 采用TCA-丙酮沉淀法提取PK3-12S可育及不育花蕾总蛋白[17], Bradford法[18]测定蛋白质浓度; 双向电泳第一向等点聚焦(IEF)使用17 cm的IPG胶条, 按照GE Healthcare双向电泳操作手册进行, 上样量为900mg; 第二向采用12%丙烯酰胺凝胶的SDS-PAGE, 经考马斯亮蓝染色、脱色后通过Powerlook 2100XL扫描采集图像, 用PDQuest 8.0分析软件对凝胶图谱标准化处理, 确定差异表达蛋白点; 试验重复3次。回收差异表达蛋白点[19], 进行MALDI-TOF-TOF MS质谱鉴定。利用Uniprot Knowledgebase (http://www.uniprot.org/)、NCBI (http://www.ncbi.nlm.nih.gov/)和Gene Ontolo gy Database (GO)的进行注释。利用在线分析工具KEGG (Kyoto Encyclopedia of Genes and Genomes) Automatic Annotation Server (简称KAAS) (http:// www.genome.jp/tools/kaas/)提交蛋白质序列, 采用BBH (bi-directional best hit)方法比对相似性, 找到最相似的蛋白质, 确定检索蛋白质的KO (KEGGORTHOLOG)分类, 并获得参与的代谢通路。
1.2.4 白菜型冬油菜基因克隆 按照天根试剂说明书提取总RNA, 电泳检测后按PrimeScript RT reagent Kit with gDNA Eraser试剂盒(TaKaRa公司, 中国大连)说明书进行反转录, 得到单链cDNA, 测定其浓度后, 置-20℃冰箱保存备用。根据GenBank数据库中已报道的白菜型油菜基因的核苷酸序列, 利用Primer Premier 5.0软件设计引物,-F: 5'-ATGTCACCACAAACAGA GACT-3',-R: 5'-CTACTCTTGGCCATCTAATTT- 3'按照十字花科首位序列上设计, 可扩增出编码区全序列。以白菜型冬油菜叶片反转录cDNA为模板, 利用引物进行RT-PCR扩增, 扩增程序为94℃ 5 min; 94℃ 30 s, 57℃ 30 s, 72℃ 78 s, 循环35次; 72℃ 10 min; 4°C保存。反应结束后1%琼脂糖凝胶电泳检测, 利用天根生化科技(北京)有限公司的普通琼脂糖凝胶DNA纯化回收试剂盒回收目的条带。将回收产物与pMD-19T载体连接, 转化大肠杆菌DH5a感受态细胞, 过夜培养, 蓝白斑筛选, 挑白斑进行菌液培养。PCR检测菌落后, 随机挑选3个阳性克隆送华大基因公司测序。
1.2.5 白菜型冬油菜温敏不育系PK3-12S差异表达基因定量分析 分别提取可育和不育期的幼蕾(减数分裂期)、中蕾期(单核花粉期)、大蕾期花蕾(二核花粉期)总RNA, 反转录cDNA, 以cDNA为模板, 进行差异表达基因的定量分析。根据大白菜基因编码区序列设计PK3-12S差异表达基因定量检测引物见表1, 以浓度一致的cDNA (MR处理及对照)为模板,(Act-F: 5'-TGTGCCAATCTACGAGGGT TT-3'; Act-R: 5'-TTTCCCGCTCTGCTGTTGT-3')为内参, 进行荧光定量和半定量PCR。半定量RT-PCR (Analytikjena PCR仪)采用同机分管扩增内参基因和目的基因, 电泳检测, PCR扩增参考SYBR Premix ExII (TliRNaseH Plus)试剂盒(TaKaRa公司, 中国大连)的荧光定量PCR, 采用两步法, 扩增程序为94℃ 2 min; 95℃ 5 s, 60℃ 35 s, 40个循环; 95℃ 15 s, 60℃ 1 min, 95℃ 15 s。96孔上样板目的基因与内参基因对应各3次重复。采用2−ΔΔCt方法计算, 即ΔCT(目的基因)=CT(目的基因) – CT(内参基因); ΔΔCT(目的基因) = 处理组(ΔCT目的基因) – 对照组(ΔCT目的基因), 相对表达量(relative quantification) = 2−ΔΔCt (目的基因)。
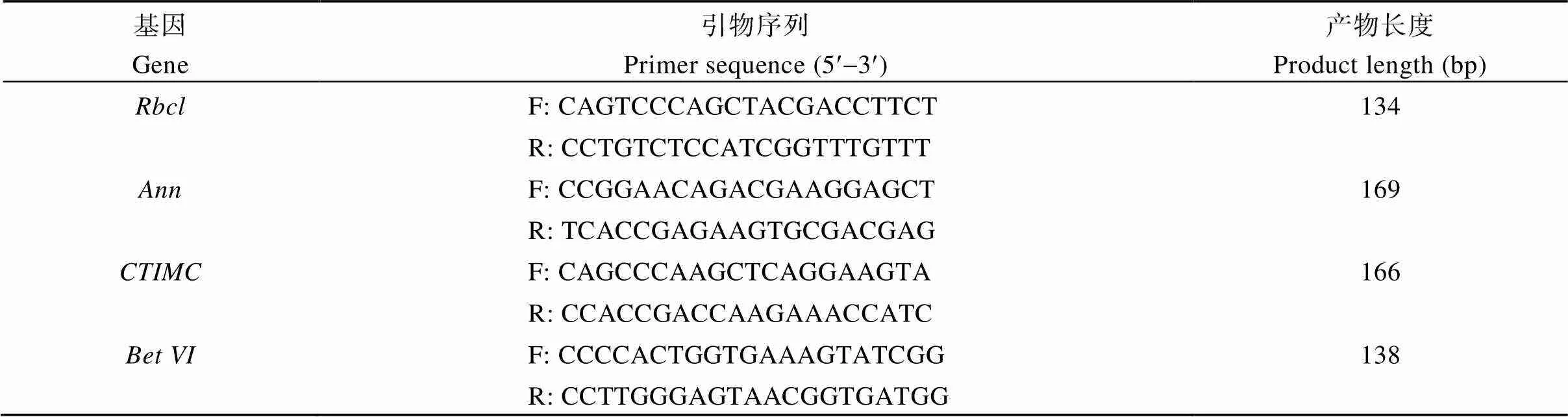
表1 差异表达基因定量引物
2 结果与分析
2.1 温敏不育系PK3-12S花器形态特征
低温生境下, PK3-12S雄蕊表现正常可育, 花瓣平展, 开花流畅, 花药发育正常, 色泽浅黄, 花粉数量多, 花粉粒椭圆形, 染色后呈红褐色(图1-A); 在高温生境中花呈不育形态, 花瓣正常, 与可育时期相似, 但雄蕊退化缩短, 花药干瘪, 无花粉; 柱头发育正常, 雌蕊略弯曲(图1-B)。此外, 白菜型冬油菜生态型PK3-12S不育时期的花丝长和花药长分别比可育时期缩短了32.14%、28.27%, 而花瓣大小无明显变化。
2.2 强抗寒油菜温敏不育系PK3-12S的遗传特性
2014年在秦川(兰州新区初花期温度<25℃)试点对PK3-12S自交及3个组合的F1、F2、BC1进行了育性鉴定, 3个组合F1均全可育, F2育性发生分离, 经卡方分析, 可育/不育株数比符合3∶1分离比例; 3个组合BC1群体可育/不育分离比符合1∶1; 表明PK3-12S的育性受1对隐性基因控制(表2)。

图1 白菜型冬油菜热敏感不育系PK3-12S可育(A)和不育(B)花形态的比较
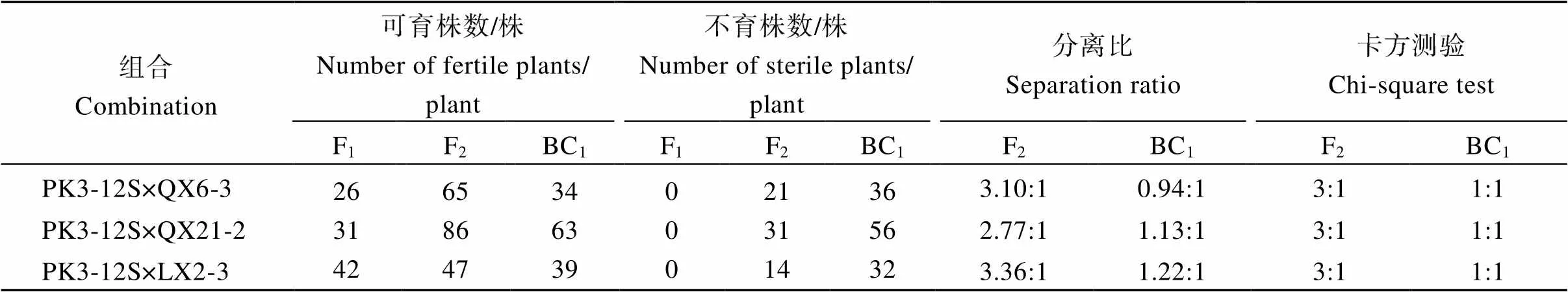
表2 PK3-12S组合后代育性表现
2.3 白菜型冬油菜PK3-12S花蕾蛋白质图谱及差异表达蛋白质分析
提取白菜型冬油菜温敏不育系PK3-12S低温下(20℃/15℃)的可育花药和高温下(27℃/20℃)的不育花蕾总蛋白质, 用pH 4~7、17 cm的IPG胶条, 对总蛋白质进行分离, 经考马斯亮蓝G-250染色后, 得到分辨率较好的2-DE图谱(图2)。采用PDQuest8.0.1软件对2个处理的图谱进行斑点检测, 对所有检测出的蛋白质斑点的总浓度进行均一化处理, 在等电点为4.0~7.0, 分子质量为9.0~100.0 kD的可育花药2-DE图谱上, 可分别鉴定出平均296个蛋白点, 不育花药2-DE图谱上可鉴定出278个清晰的蛋白质点, 2个处理的蛋白质点图谱匹配率为89.0%。经凝胶比对分析发现, 温敏不育系PK3-12S低温可育花药和高温不育花药, 表达量2倍以上差异蛋白质点共有31个, 其中增量表达蛋白质点6个, 减量表达蛋白质点11个, 在不育花药中完全抑制表达蛋白点12个, 不育花药特异表达蛋白点2个。
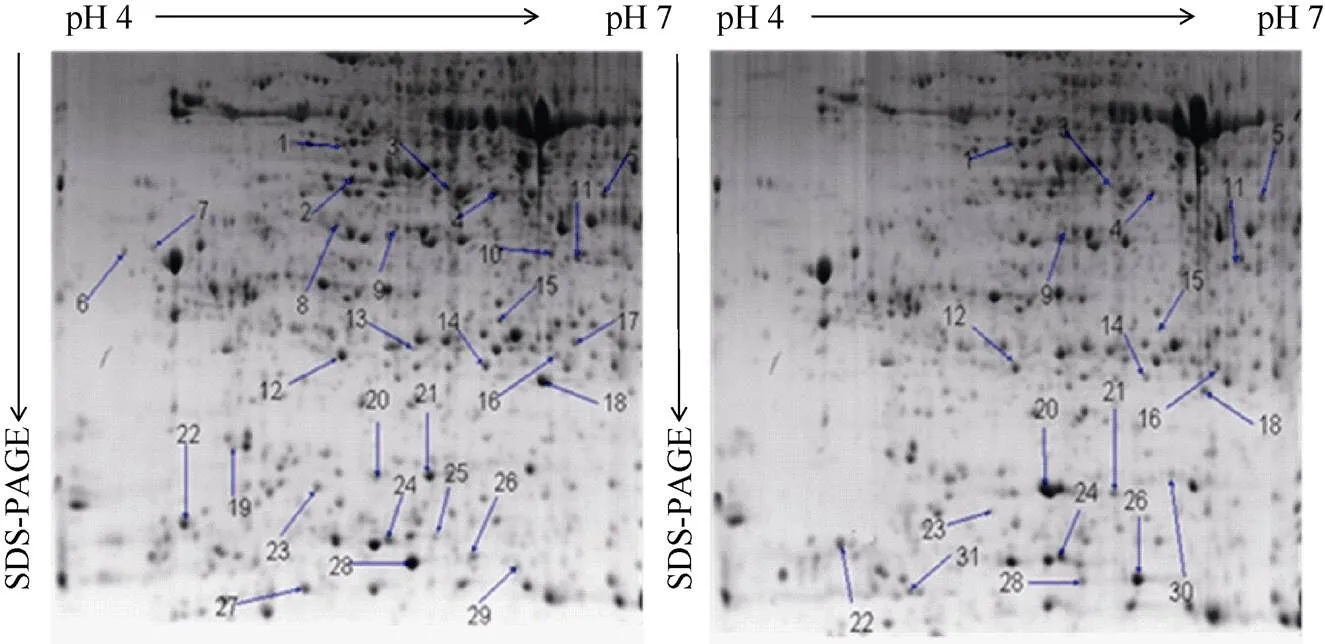
图2 白菜型冬油菜生态不育系PK3-12可育时期(左)及其不育时期(右)花器全蛋白双向电泳图谱
2.4 差异表达蛋白质斑点的质谱鉴定与分析
将重复性好的31个差异表达蛋白质点进行MALDI-TOF-TOF MS质谱分析, 15个点鉴定出蛋白质(表3), 16个点未能鉴定出有意义的结果。在质谱数据分析的基础上, 用MASCOT搜索NCBInr绿色植物数据库。
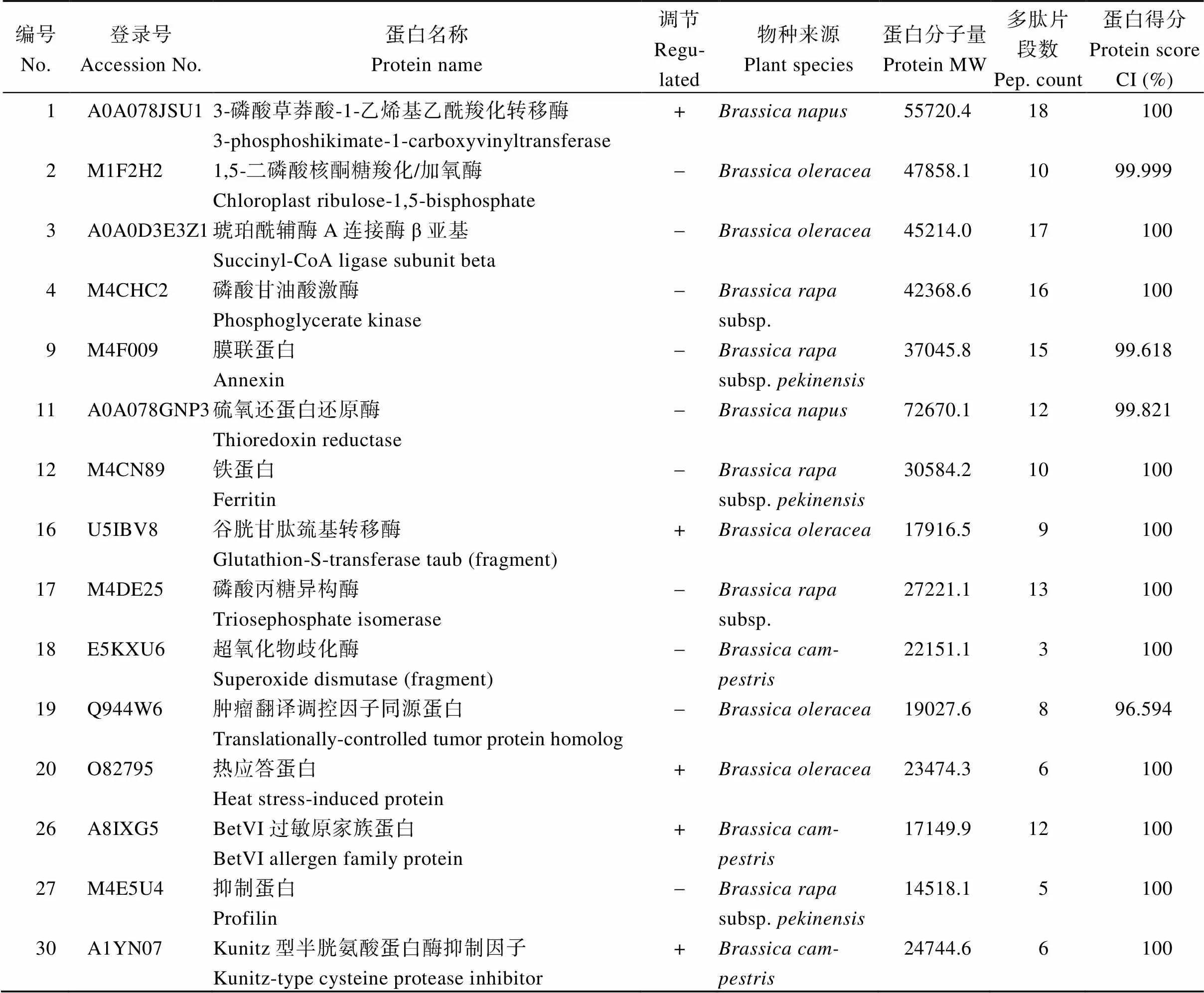
表3 PK3-12S可育时期与不育时期花器差异表达蛋白点质谱鉴定结果
+: 上调表达;-: 下调表达。+: up regulated;-: down regulated.
2.5 差异蛋白的GO功能富集分析
对白菜型冬油菜温敏不育花药和可育花药差异表达蛋白进行GO和KEGG功能注释, 15个差异蛋白质在三大类群(生物学过程BP、细胞组分CC和分子功能MF)下进行进一步分类。差异蛋白主要参与冷应答响应(response to cold)、锌离子应答(response to zinc ion)、细胞分裂素应答(response to cytokinin)、花粉管生长调控(regulation of pollen tube growth)、细胞死亡调控(regulation of cell death)、蛋白酶活性负调控(negative regulation of peptidase activity)、芳香族氨基酸生物合成(aromatic amino family biosynthetic process)、分支酸生物合成(chorismate biosynthetic process)、花器发育(flower development)、叶发育(leaf development), 每个过程占1.5%; 磷酸甘油酸激酶活性调节(phosphoglycerate kinase activity)、超氧化物自由基清除(removal of superoxide radicals)每个过程占3.0%; 创伤应答(response to wounding)、铁离子转运与胞内离子稳态(iron ion transport and homeostasis)每个过程占4.5%; 生物刺激防御反应(defense response to biotic stimulus)占6.0%。
差异蛋白主要为细胞器组分(organelle component)、膜组分(membrane component), 每个过程占9.0%; 大分子复合物组分(macromolecular complex)、质外体组分extracellular region, 每个过程占6.0%; 胞质组分(symplast component), 细胞连接成分(cell junction), 各占3.0%。差异蛋白具有Ca2+结合活性(calcium-binding protein)、Fe2+结合与铁氧化酶活性(iron binding and ferroxidase activity)、ATP结合活性(ATP binding), 分别占4.5%; 半胱氨酸型肽链内切酶活性(cysteine-type endopeptidase inhibitor activity), 占3.0%; Mg2+-琥珀酰CoA连接酶活性(magnesium ion binding succinate-CoA ligase)、二硫铁氧还酶活性(thioredoxin-disulfide reductase activity)、蛋白特异结合结构域(protein domain specific binding)、转移酶活性(transferase activity)、磷酸丙糖异构酶活性(triose-phosphate isomerase activity)、超氧化物歧化酶活性(superoxide dismutase activity)、肽内切酶活性(endopeptidase inhibitor activity)、软脂酸结合活性(cetin binding), 每个过程占1.5% (图3)。
经KEGG注释15个差异蛋白主要参与信号转导通路(signaling pathway)、二羧基乙醛酸代谢(glyoxylate and dicarboxylate metabolism)、糖酵解代谢(glycolysis gluconeogenesis)、次生合成代谢(biosynthesis of secondary metabolites)、氨基酸生物合成(biontheses of amino acids)、分支酸生物合成(chorismate biosynthesis)、碳代谢途径(carbon metabolism)等(图4)。
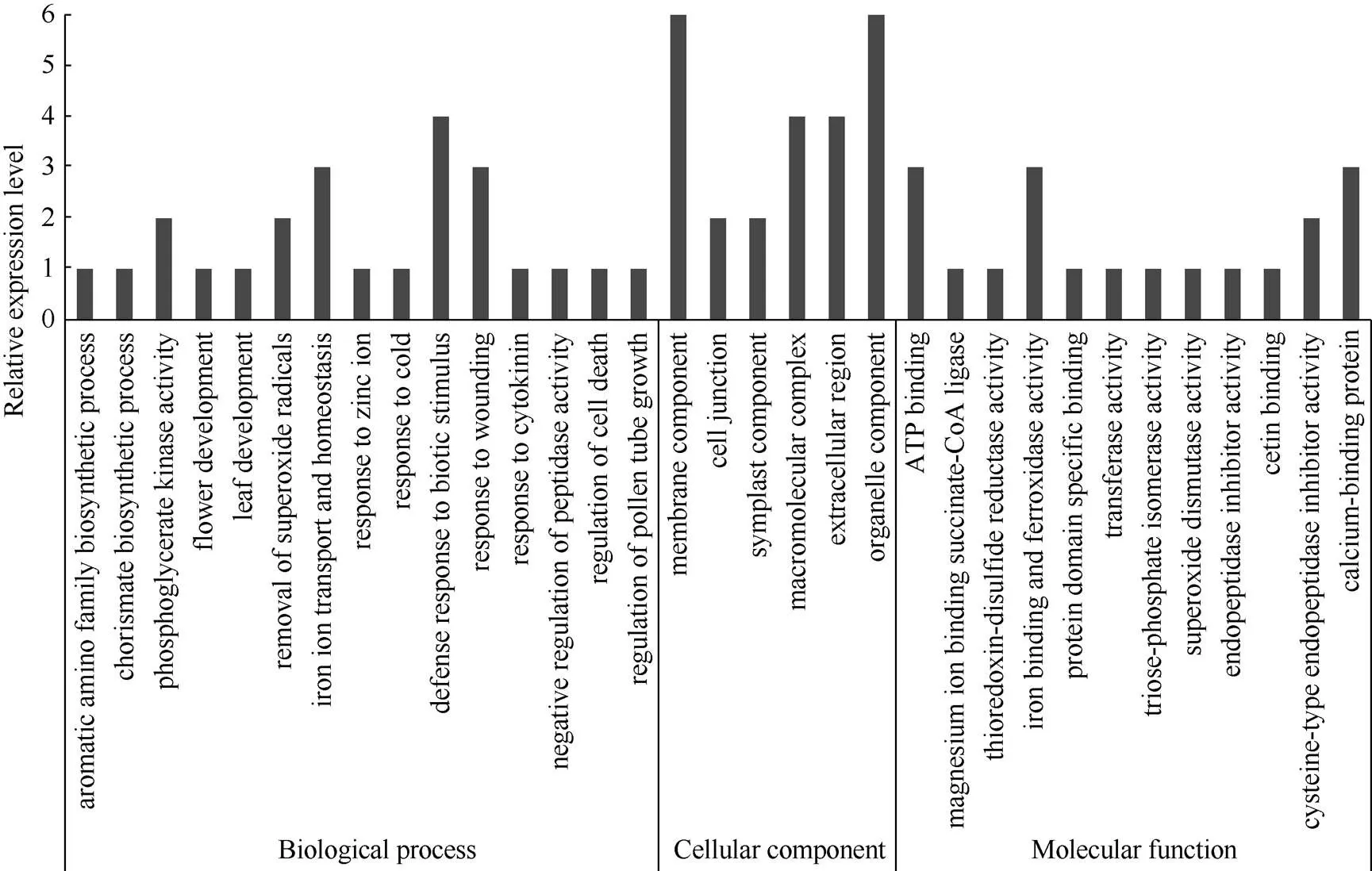
图3 差异蛋白GO功能分析
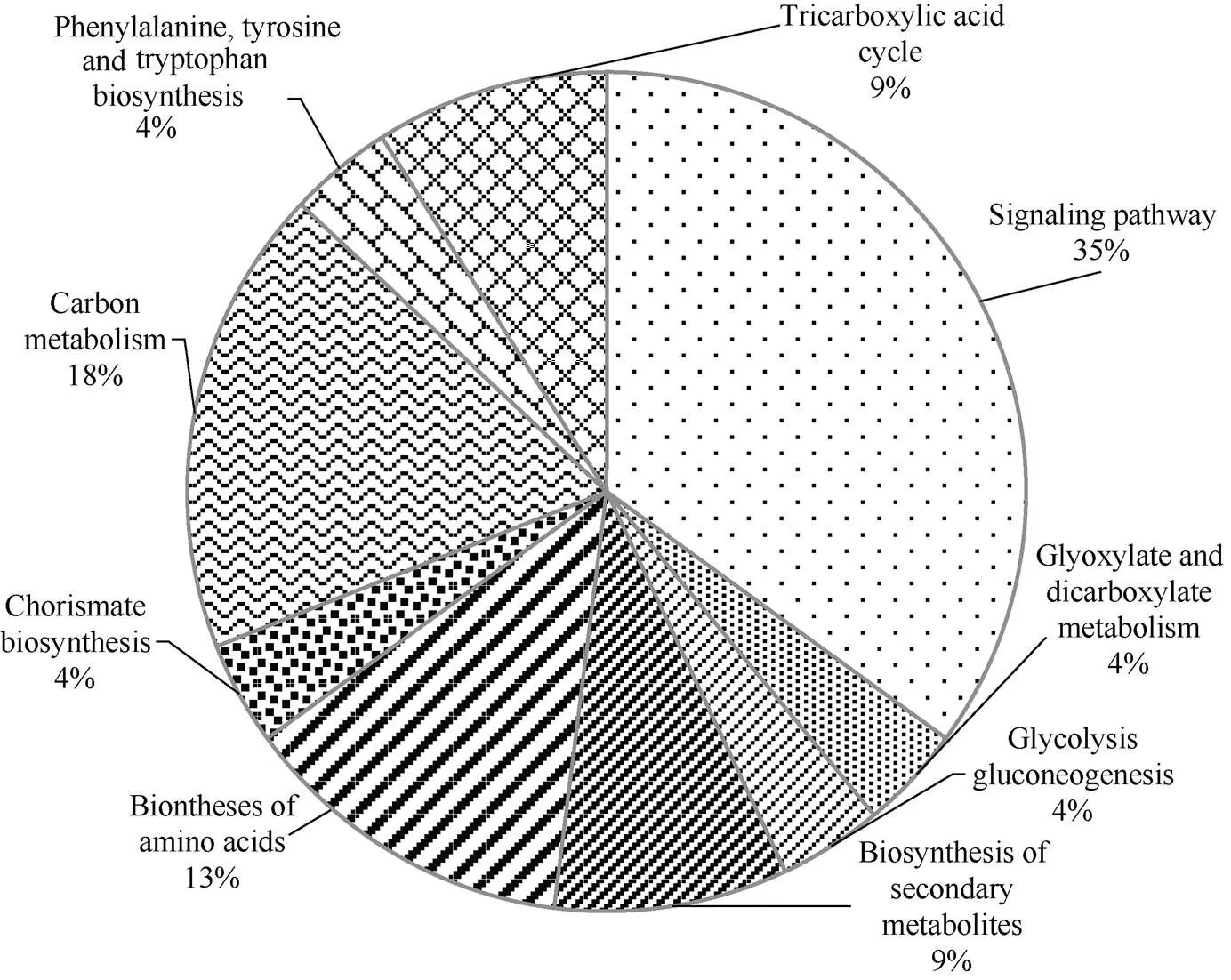
图4 差异表达蛋白KEGG分类图
2.6 差异蛋白编码基因表达定量分析
通过双向电泳分析获得的PK3-12S可育花蕾和败育花蕾的差异蛋白点, 以及GO、KEGG功能分析, 选取了其中与植物雄性不育发生相关的差异表达蛋白编码的基因4个, 即基因, 采用定量RT-PCR进一步验证其表达量与花药育性变化的协同性。结果显示, 相对于可育花蕾而言, PK3-12S不育花蕾基因、基因在花蕾发育各时期均明显下调表达,基因下调幅度57.8%~84.0%,基因下调幅度在1.43~1.67倍间。比可育花蕾相比, 同一发育期不育花蕾的基因在发育期间均下调表达, 表达量下降幅度为24.2%~62.1% (图5)。
3 讨论
3.1 BrrbcL基因表达与温敏不育系PK3-12S育性转换
核酮糖-1,5-二磷酸羧化酶/加氧酶(ribulose-1, 5-isphosphate carboxylase/oxygenase, Rubisco)是绿色植物光合代谢关键限速酶, Rubisco全蛋白由8个大亚基(rbcL)和8个小亚基(rbcS)组成, 酶活性结构域位于大亚基, 小亚基对酶活性起到调节作用, 相对而言, 大亚基基因序列同源性很高, 而小亚基基因存在很大序列多态性[20]。小亚基由核基因编码, 大亚基则由质体基因编码, 并由叶绿体核糖体负责翻译合成, 其蛋白质结构中含有的L的羧基末端α/β桶状区域, 与另一个L的氨基末端区域构成活性中心[21]。许多研究结果显示, 植物雄性不育发生与花蕾Rubisco含量变化相关, 水稻[22]、大豆[23]等作物雄性不育花药中均检测到Rubisco或其大亚基含量的下降。同时, 活性氧代谢紊乱也可导致Rubisco氧化修饰、酶活性丧失和降解[24]。
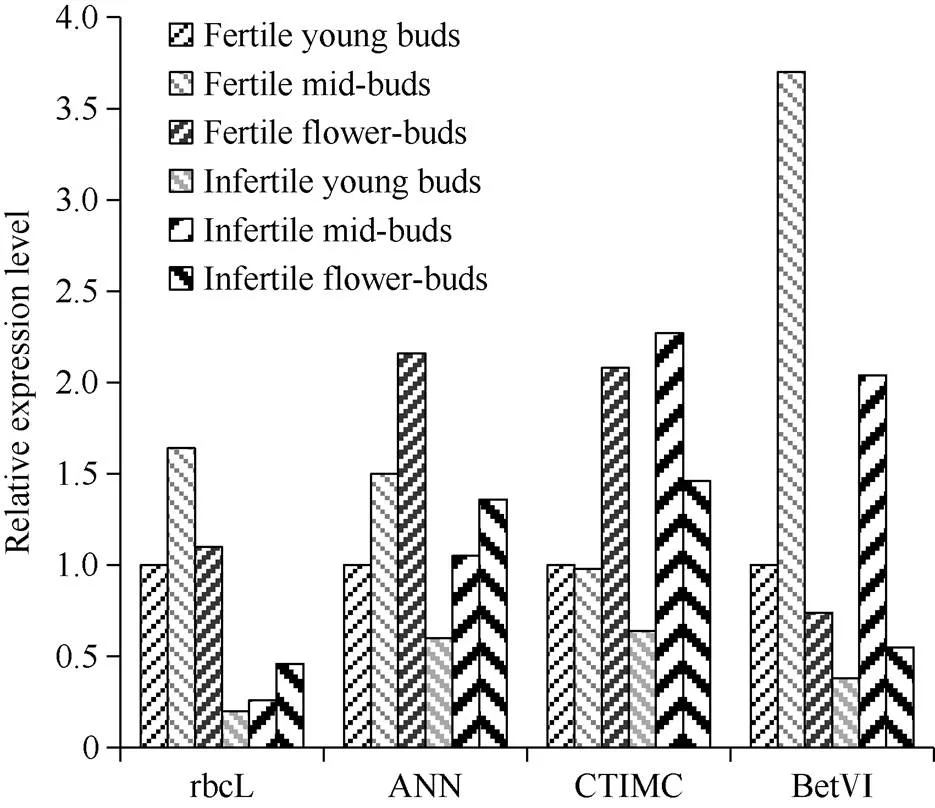
图5 PK3-12S花器发育过程中差异蛋白编码基因的相对表达量
rbcL: 1,5-二磷酸核酮糖羧化酶; ANN: 膜联蛋白; CTIMC: 磷酸丙糖异构酶; BetVI: BetVI过敏原家族蛋白。
rbcL: ribulose-1,5-bisphosphate carboxylase; ANN: annexin; CTIMC: triosephosphate isomerase; BetVI: BetVI allergen family protein.
本研究荧光定量PCR分析结果表明, 与可育花蕾相比, PK3-12S不育花蕾中Rubisco (spot2)大亚基编码基因基因显著下调表达, rbcL是光合关键酶Rubisco的组件分子, rbcL亚基分子数量不足阻抑了Rubisco蛋白组装。差异蛋白组学分析结果表明,不育花蕾超氧化物歧化酶(superoxide dismutase, SOD)含量下降, 生物体清除超氧阴离子自由基能力减弱, 有强烈氧化能力的活性氧O2-在胞内积累, 受到氧自由基氧化攻击的Rubisco发生修饰降解, 使其在胞内含量进一步降低。Rubisco作为光合作用的关键酶, 其含量不足限制了不育花蕾光合固碳能力, 光合产物是植物其他代谢途径的能量基础, 不育花蕾光合固碳能力的下降, 影响了花粉母细胞及小孢子正常发育, 最终可能导致不育系PK3-12S的雄性败育。
3.2 丙糖代谢与温敏不育系PK3-12S雄配子体败育
糖酵解代谢是糖代谢的基础途径, 磷酸甘油酸激酶[25]和磷酸丙糖异构酶[26]是该代谢途径的关键酶,其中磷酸丙糖异构催化酶丙糖磷酸异构体在二羟丙酮磷酸和D型甘油醛-3-磷酸之间转换[27]; 磷酸甘油酸激酶不可逆催化1,3-二磷酸甘油酸去磷酸化生产3-磷酸甘油酸[28], 2个酶在有效能量生成方面是必不可少的酶类, 其中之一缺失即可引起细胞能量代谢紊乱, 而能量代谢平衡对于小孢子正常发育至关重要。本研究中PK3-12S不育花蕾磷酸甘油酸激酶(spot 4)和磷酸丙糖异构酶(spot 17)表达量均明显下调,在小孢子发育阶段, 糖酵解途径2个关键酶表达异常下调, 阻抑了丙酮酸的生成和三羧酸途径能量输出; 同时, 糖酵解和丙糖彻底氧化代谢过程中, 多种性质活跃的中间物的生成也受到影响, 造成物质合成和能量代谢的紊乱, 引起小孢子正常发育提前终止, 对雄性不育可能产生一定的影响。
3.3 膜联蛋白与温敏不育系PK3-12S雄配子败育
膜联蛋白是一类水溶性的同源多功能蛋白, 在Ca2+依赖下可与内膜和质膜结合或形成跨膜结构, 也可以与肌动蛋白结合, 参与微丝等细胞骨架结构形成[29]。膜联蛋白在分子功能上具有过氧化物酶、核酸水解酶活性和离子通道作用, 参与植物响应干旱、盐碱、温度等环境胁迫, 在植物极性延伸结构如根、花粉管等的伸长等发面发挥重要作用[30], 还参与植物胞内过氧化物伤害防御、胞内离子稳态平衡、细胞骨架形成等。植物花粉母细胞减数分裂及小孢子发育过程中, 正常水平的活性氧等自由基产生与清除平衡, 良好胞内生理状态的维持等是形成正常可育配子的基础; 正常的减数分裂和小孢子发育过程中, 微管微丝等细胞骨架组分的组装与去组装动态, 特别是纺锤丝的牵引作用与染色体运动, 核均等分裂与配子体育性等起到关键作用, 而微管微丝是分裂细胞纺锤状结构的重要成分[31]。本研究结果显示, 在高温不育条件下, 白菜型冬油菜PK3-12S花药中膜联蛋白(spot 9)表达显著下调, 表明PK3-12S花药中微管微丝等细胞骨架成分正确装配能力降低, 对花粉母细胞减数分裂和雄配子体发育产生不利影响, 参与花粉败育的形成过程。
3.4 活性氧代谢紊乱与PK3-12S雄配子败育
植物体内负责清除氧自由基的酶系主要包括超氧化物歧化酶(SOD)、过氧化物酶(POD)等, 伴随植物呼吸作用的进行, 其体内也不断地产生对植物细胞有危害作用的活性氧等自由基, 在正常情况下, 植物体内活性氧等自由基的产生和清除处于动态平衡状态。在温度变化等引起的胞内活性氧代谢紊乱情况下, 内活性氧等自由基积累, 机体受到各种伤害, 导致雄性败育[32]。对水稻[33]、小麦[34]、油菜[16]等不育系花蕾发育的研究结果认为, 不育系中保护酶活性下降, 致使活性氧水平升高, 膜脂过氧化作用增强而使细胞受损, 引起小孢子生长发育出现异常, 从而导致雄性不育的发生。本研究结果显示, 在高温条件下, 白菜型温敏不育系PK3-12S花药育性转化过程中, 不育花蕾超氧化物歧化酶(spot 18)和具有过氧化物酶活性的膜联蛋白(spot 9)表达显著下调, 表明在败育条件下PK3-12S花药胞内清除活性氧等自由基能力减弱, 胞内活性氧等自由基含量增加, 过量的氧自由基对膜系统具有强烈氧化攻击作用, 引起胞内膜系统氧化损伤, 参与了PK3-12S雄配子体发育异常产生过程。
3.5 热激蛋白与PK3-12S雄配子败育
热激蛋白属分子伴侣蛋白, 广泛存在于高等植物胞质、内质网、叶绿体和线粒体中, 协助新生肽链折叠形成正确高级结构, 并在蛋白定向转运、恢复或清除胞内变性蛋白、稳定分子功能、维持细胞间稳态等方面均发挥重要作用[35]。当植物体热激蛋白功能被阻抑, 植物水分内吸-耗散失衡, 粗面内质网腔内新生肽正确折叠效率降低, 内质网蛋白加工和错误结构蛋白清除能力减弱, 错误折叠蛋白的胞内积累, 引起雄配子体发育异常[36]。本研究结果显示, 在高温条件下, 白菜型温敏不育系PK3-12S花药活性育过程中, 不育花蕾热激蛋白(spot 20)表达显著上调。热激蛋白是一类诱导表达蛋白, 在花蕾败育过程中, 胞内内质网腔中错误折叠蛋白积累, 诱导表达了热激蛋白的表达, 这类伴侣分子在细胞中的富集, 提高了新生肽正确加工和已变性肽的清除能力, 清除内质网错误折叠蛋白, 以缓解 “内质网胁迫”。然而在高温下, PK3-12S小孢子内上调表达的热激蛋白, 仍不能完全解除错误折叠蛋白引起的“内质网胁迫”, 可能会引起PK3-12S小孢子败育的发生。
4 结论
PK3-12的不育花药在高温下形态较小, 花药室内有少量败育花粉。与可育花药相比,、和基因所编码的蛋白在不育花药发育过程中的表达显著下调, 表明这些蛋白可能参与了温敏不育系PK3-12S的育性转化。
[1] 殷艳, 王汉中. 我国油菜生产现状及发展趋势.农业展望, 2011, 7(1): 43–45. Yin Y, Wang H Z. Present situation and development trend of rape production in China., 2011, 7(1): 43–45 (in Chinese).
[2] 刘成, 黄杰, 冷博峰, 冯中朝, 李俊鹏. 我国油菜产业现状, 发展困境及建议. 中国农业大学学报, 2017, 22(12): 203–210. Liu C, Huang J, Leng B F, Feng Z C, Li J P. Current situation, development difficulties and suggestions of Chinese rape industry., 2017, 22(12): 203–210 (in Chinese with English abstract).
[3] 刘成, 冯中朝, 肖唐华, 马晓敏, 周广生, 黄凤洪, 李加纳, 王汉中. 我国油菜产业发展现状、潜力及对策. 中国油料作物学报, 2019, 41: 485–489. Liu C, Feng Z C, Xiao T H, Ma X M, Zhou G S, Huang F H, Li J N, Wang H Z. Development, potential and adaptation of Chinese rapeseed industry., 2019, 41: 485–489 (in Chinese with English abstract).
[4] Zeng X C, Xu Y Z, Jiang J J, Zhang F Q, Ma L,Wu D W, Wang Y P, Sun W C.Identification of cold stress responsive microRNAs in two winter turnip rape (L.) by high throughput sequencing., 2018, 18: 52.
[5] 王学芳, 孙万仓, 李孝泽, 武军艳, 马维国, 康艳丽, 曾潮武, 蒲媛媛, 叶剑, 刘红霞, 曾军, 张亚红. 河西走廊种植冬油菜的环境效应. 作物学报, 2008, 34: 2210–2217. Wang X F, Sun W C, Li X Z, Wu J Y, Ma W G, Kang Y L, Zeng C W, Pu Y Y, Ye J, Liu H X, Zeng J, Zhang Y H. The environment effect of planting winter rape in Hexi Corridor., 2008, 34: 2210–2217 (in Chinese with English abstract).
[6] Liu Z G, Sun W C, Zhao Y N, Li X C, Fang Y, Wu J Y, Zeng X C, Yang N N, Wang Y, He L. Effects of low nocturnal temperature on photosynthetic characteristics and chloroplast ultrastructure of winter rapeseed., 2016, 63: 451–460.
[7] Chen X, Hu J, Zhang H, Ding Y. DNA methylation changes in photoperiod-thermo-sensitive male sterile rice PA64S under two different conditions., 2014, 537: 143–148.
[8] Zhang J W, Liu Z Q, Liu X Q, Dong J G, Pang H X, Yu C Y. Proteomic alteration of a thermo-sensitive male sterility SP2S in rapeseed () in response to mild temperature stress., 2016, 135: 191–199.
[9] Ji J L, Yang L M, Fang Z Y, Zhuang M, Zhang Y Y, Lyu H H, Liu Y M, Li Z S. Complementary transcriptome and proteome profiling in cabbage buds of a recessive male sterile mutant provides new insights into male reproductive development., 2018, 179: 80–91.
[10] Liu H Z, Zhang G S, Wang J S, Li J J, Song Y L, Qiao L, Niu N, Wang J W, Ma S C, Li L L. Chemical hybridizing agent SQ-1-induced male sterility inL.: a comparative analysis of the anther proteome., 2018, 18: 7.
[11] Xiao X J, Yang Y Z, Yang Y J, Lin J Z, Tang D Y, Liu X M. Comparative analysis of young panicle proteome in thermo- sensitive genic male-sterile rice Zhu-1S under sterile and fertile conditions., 2009, 31: 157–161.
[12] Song L R, Liu Z Q, Tong J H, Xiao L T, Ma H, Zhang H Q. Comparative proteomics analysis reveals the mechanism of fertility alternation of thermo-sensitive genic male sterile rice lines under low temperature inducement., 2015, 15: 1884–1905.
[13] Yu C Y, Xu X F, Ge J, Guo X F, Dong J G, Dong Z S. Premature breakdown of tapetum associated with reverse thermo-sensitive genic male-sterile line Huiyou 50S in rapeseed ()., 2016, 38: 54.
[14] Zeng X H, Li W P, Wu Y H, Liu F, Luo J L, Cao Y L, Zhu L, Li Y J, Li J, You Q B, Wu G. Fine mapping of a dominant thermo-sensitive genic male sterility gene () in rapeseed () with AFLP- and-derived PCR markers., 2014, 127: 1733–1740.
[15] Liu X Q, Yu C Y, Dong J G, Xu A X, Hu S W. De novo transcriptome reconstruction of a thermo-sensitive male sterility mutant in rapeseed (; Brassicaceae)., 2017, 5: 1700077. doi: 10.3732/apps.1700077.
[16] 徐献锋, 胡玉梅, 于澄宇, 葛娟, 郭英芬, 董军刚, 胡胜武. 甘蓝型油菜反型温敏核不育Huiyou 50S的生理特征及遗传分析. 华北农学报, 2014, 29(3): 147–152. Xu X F, Hu Y M, Yu C Y, Ge J, Guo Y F, Dong J G, Hu S W. Physiological characterization and genetic analysis of reverse thermo-sensitive genic male-sterile line Huiyou 50S in., 2014, 29(3): 147–152 (in Chinese with English abstract).
[17] Majeran W, Zybailov B, Ytterberg A J, Dunsmore J, Sun Q, van Wijk K J. Consequences of C4differentiation for chloroplast membrane proteomes in maize mesophyll and bundle sheath cells., 2008, 7: 1609–1638.
[18] Bradford M M. A rapid method for the quantification of microgram quantities of protein utilizing the principle of protein. Dye binding., 1976, 72: 248–254.
[19] Katayama H, Nagasu T, Oda Y. Improvement of in-gel digestion protocol for peptide mass fingerprinting by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry., 2001, 15: 1416–1421.
[20] Majeran W, Zybailov B, Ytterberg A J, Dunsmore J, Sun Q, van Wijk K J. Consequences of C4differentiation for chloroplast membrane proteomes in maize mesophyll and bundle sheath cells., 2008, 7: 1609–1638.
[21] Guo L L, Sui Z H, Zhang S, Ren Y Y, Liu Y. Comparison of potential diatom “barcode” genes (18S and ITS rDNA, COI,) and their effectiveness in discriminating and determining species taxonomy in bacillariophyta., 2015, 65: 1369–1380.
[22] Cuong P V, Cuong H V. Heterosis for photosynthesis and dry matter accumulation in F1hybrid rice (L.) produced from thermo-sensitive male sterile line under drought stress at heading stage., 2014, 59: 221–228.
[23] Huber S C, Wilson R F, Burton J W.Studies on genetic male-sterile soybeans: II. Effect of nodulation on photosynthesis and carbon partitioning in leaves., 1983, 73: 713–717.
[24] Van Cuong P, Thi Thu Hang D, Thi Hang T, Araki T, Yoshimura A, Mochizuki T. Photosynthesis and panicle growth responses to drought stress in F1hybrid rice (L.) from a cross between thermo-sensitive genic male sterile (TGMS) line 103S and upland rice IR17525., 2014, 59: 271–277.
[25] Rosa-Téllez S, Anoman A D, Flores-Tornero M, Toujani W, Alseekh S, Fernie A R, Nebauer S G, Muñoz-Bertomeu J, Segura J, Ros R. Phosphoglycerate kinases are co-regulated to adjust metabolism and to optimize growth., 2018, 176: 1182–1198.
[26] Ito H, Iwabuchi M, Ogawa K. The sugar-metabolic enzymes aldolase and triose-phosphate isomerase are targets of glutathionylation in: detection using biotinylated glutathione., 2003, 144: 655–660.
[27] Chen M J, Thelen J J. The plastid isoform of triose phosphate isomerase is required for the post germinative transition from heterotrophic to autotrophic growth in., 2010, 22: 77–90.
[28] Hu C Q, Sturtevant J M, Thermodynamic study of yeast phosphoglycerate kinase., 1987, 26: 178–182.
[29] Lin Y, Miyagi A, Scheuring S. The annexin V transmembrane channel., 2018, 114: 491.
[30] Dai S J, Chen T T, Chong K, Xue Y B, Liu S Q, Wang T. Proteomics identification of differentially expressed proteins associated with pollen germination and tube growth reveals characteristics of germinatedpollen., 2007, 6: 207–230.
[31] Monastyrskaya K. Functional association between regulatory RNAs and the annexins., 2018, 19: 591.
[32] Halac I N D, Harte C. Genetics and development of morphological and physiological characters of male sterility in Oenothera., 1995, 187: 22–30.
[33] Dai X J, Kang G P, Wang Z X, Luan J, Wang Z, Liang M Z, Chen L B. Cytoplasmic effects on the agronomic and physiological traits of dual-purpose genic male sterile substitution lines of rice., 2017, 57: 3016–3026.
[34] 李莉, 王书平, 张改生, 王亮明, 宋瑜龙, 张龙雨, 牛娜, 马守才. 小麦生理型和遗传型雄性不育系及其保持系小花完整叶绿体蛋白质组分比较研究. 作物学报, 2011, 37: 1134–1143. Li L, Wang S P, Zhang G S, Wang L M, Song Y L, Zhang L Y, Niu N, Ma S C. Comparison of chloroplast proteomes extracted from florets of physiological and genic male sterile lines and their maintainer line in wheat., 2011, 37: 1134–1143 (in Chinese with English abstract).
[35] Mayer M P, Bukau B. Hsp70 chaperones: cellular functions and molecular mechanism., 2005, 62: 678–684
[36] Usman M G, Rafii M Y, Martini M Y. Molecular analysis of Hsp70 mechanisms in plants and their function in response to stress., 2017, 33: 26–39.
Differential proteomics analysis of fertility transformation of the winter rape thermo-sensitive sterile line PK3-12S (L.)
MI Wen-Bo, FANG Yuan, LIU Zi-Gang*, XU Chun-Mei, LIU Gao-Yang, ZOU Ya, XU Ming-Xia, ZHENG Guo-Qiang, CAO Xiao-Dong, and FANG Xin-Ling
Gansu Provincial Key Laboratory of Arid Land Crop Sciences / Key Laboratory of Crop Genetics Improvement and Germplasm Enhancement of Gansu Province / Gansu Research Center of Rapeseed Engineering and Technology / College of Agronomy, Gansu Agricultural University, Lanzhou 730070, Gansu, China
To reveal the fertility switching mechanism of temperature-sensitive sterility line PK3-12S (L.), the differentially expressed proteins were isolated and identified using anthers of PK3-12S in sterile/fertile conditions by 2-DE and LC-MS/MS mass spectrometry. The expression level variations of differentially expressed genes were examined by RT-PCR in PK3-12 flower buds during sterility/fertile development. The result showed that the sterile anther size of PK3-12 was small with a little abortive pollen in the anther room under high temperature. The trait of fertility transformation was controlled by a pair of recessive alleles. There were 31 differentially expressed proteins with more than two times of the expression level, including six protein spots with increasing expression, 11 protein spots with reduced expression, 12 protein spots with complete inhibition, and two protein spots with induced expressed. Fifteen differentially expressed proteins involved in the cellular processes such as signal transduction pathways, glyoxylate and dicarboxylate metabolism, glycolysis gluconeogenesis, biosynthesis of secondary metabolites, biontheses of amino acids, chorismate biosynthesis, and carbon metabolism pathways were identified by mass spectrometry. Thegene, encoding a Rubisco subunit-binding accessory protein, had an open reading frame (ORF) in length of 1095 bp encoded 364 amino acids. Compared with fertile anthers, the expression level ofgene, annexin gene () and BetVI allergen family gene () was significantly down-regulated during sterile anthers development, which indicated that these genes maybe participate in the fertility transformation of the thermo-sensitive sterile line PK3-12S.
winter turnip rape (L.); thermo-sensitive sterile line; proteomics; gene expression
10.3724/SP.J.1006.2020.04015
本研究由国家自然科学基金项目(31660404), 国家重点基础研究发展计划项目(2018YFD0100502-2), 甘肃省高校科研成果转化培育项目(2018D-13), 国家现代农业产业技术体系建设专项(CARS-13)和甘肃省科技重大专项项目(17ZD2NA016-4)资助。
This study was supported by the National Natural Science Foundation of China (31660404), the National Key Basic Research Development Program (2018YFD0100502-2), the Gansu University Scientific Research Achievement Transformation and Cultivation Project (2018D-13), the National Modern Agricultural Industry Technology System Construction Project (CARS-13), and the Gansu Science and Technology Major Special Project (17ZD2NA016-4).
刘自刚, E-mail: lzgworking@163.com
E-mail: 1291402843@qq.com
2020-01-17;
2020-04-15;
2020-05-14.
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20200513.1814.004.html

