电化学试题的解题思路分析
芦红霞


摘 要:电化学是中学化学学科中的重要内容,也是高考考查的重点.试题涉及有电极判断、电极反应式书写、离子的移动等相关问题,通过高考真题的分析来提炼处理这类问题的方法.
关键词:氧化还原反应;电子转移;电极判断;离子移动;高中化学
电化学试题的解题思路一般可以分成这样四个步骤来进行:1.先弄清楚是电池反应还是电解反应;2.根据信息说明或反应中物质价态变化确定正、负极或阴、阳极;3.根据物质的特点确定反应的微粒;4.根据反应所处的环境正确写出电極反应式以及判断离子的移动方向.下面就结合具体的高考试题来分析.
一、考查电极反应式书写
例1 (2018年江苏-20节选)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸.写出电解时阳极的电极反应式:.
分析 稀硝酸吸收NOx后有HNO3和HNO2两种物质,想通过电解的方法来得到较浓的硝酸.从这句表达来看该过程属于电解反应,目的是使混合溶液中的亚硝酸转化成硝酸,让氮元素价态升高,氮元素价态升高的过程就是氮原子失去电子的过程,所以应该在电解池的阳极反应.在这个过程中涉及的问题还有:(1)NO-2转化成NO-3的变化中,缺少的氧原子可以用什么微粒来补充?(2)电极式也是离子方程式,微粒以什么样的形式保留呢?由于亚硝酸属于弱酸,应当以分子形式存在;缺少的氧原子在溶液中一般以水或者OH-补充,考虑该溶液为酸性,用水比较合理.最终写出的阳极的电极反应式为:
二、考查电极判断
电化学反应中,电极的确定和电子的得失是联系在一起的,电子的得失在物质价态变化上显现出来.如果电极名称没有标明,就可以通过微粒中元素价态变化来确定反应的电极.
分析 根据提供的电池总反应可以看出,钠在反应中化合价升高,失电子,应该在负极反应,则正极反应物应为CO2,那正极的反应式为3CO2+4e-2CO2-3+C.从提供的图示也可以判断:左边电极上发生反应的物质为钠,右边为CO2.其中钠为非常活泼的金属,易失电子,很显然钠为负极反应物.负极失去电子后该区域区带正电荷,正极区得到电子后带负电荷,那电解液中的离子会相应移动维持电荷平衡.所以放电时ClO-4向负极移动.充电时,阴极得到电子,钠离子被还原,发生的反应为是Na++e-Na,此时电极名称为阴极,解题时要注意区分电池反应和电解反应的电极名称.
三、考查离子的移动方向
在电化学反应中,离子的移动来维持电荷的平衡.一般来说有两种情况:浓度大的离子会向离子浓度小的区域扩散、离子向带相反电荷的方向移动.
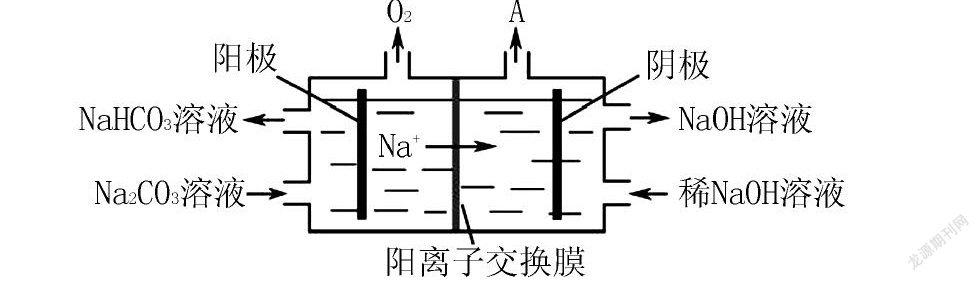
例3 (2017年江苏-16节选)电解Na2CO3溶液的原理如图所示.
阳极的电极反应式为,阴极产生的物质A的化学式为.
分析 该题装置为电解反应,左池是阳极区,右池为阴极区.阳极失去电子,发生氧化反应.阴极得到电子,发生还原反应.那发生反应的离子分别是什么呢?在阳极区产生氧气,原来氧元素存在于CO2-3或H2O中,都是以-2价存在,考虑最后CO2-3转化成HCO-3,所以应该是水发生反应产生氧气.即2H2O-4e-4H++O2,产生的H+立即与CO2-3反应生成HCO-3,所以总反应应该写成4CO2-3+2H2O-4e-4HCO-3+O2,由于CO2-3转化成HCO-3,所带负电荷减少,为了维持电荷平衡,钠离子由阳极区通过阳离子交换膜转移到阴极区.再看阴极区的反应,稀的NaOH转变成浓的NaOH溶液,钠离子由阳极区转移过来的,OH-则由阴极区产生,从存在的微粒来看,只有水参加反应得到,所以阴极区是水得到电子,发生还原反应:2H2O+2e-H2+2OH-,则A为氢气.
四、根据实际情况分析反应物质
在电化学反应中,除了一些常见的微粒发生反应外,也会看到一些不是很常见的物质,比如活泼的金属离子、非金属离子或单质参见反应.这种情况的出现需要根据实际情况进行分析,判断出具体反应的物质,再依据电化学中电子转移的理论来分析即可.
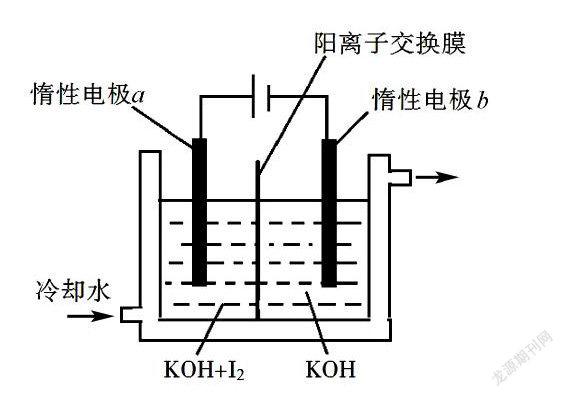
例4 (2018全国卷Ⅲ-27节选) KIO3可采用“电解法”制备,装置如图所示.
写出电解时阴极的电极反应式.
电解过程中通过阳离子交换膜的离子主要为,其迁移方向是.
分析 该电解装置的目的是制取KIO3,从提供的原料来看,KIO3在阳极区产生.阴极区的物质是KOH溶液,能得到电子的只有水中的氢,电极反应为:2H2O+2e-H2+2OH-,那阳极的反应呢?参加反应的物质是KOH与I2,且从价态分析碘元素由单质的0价转化成IO-3中的+5价,失电子,结合碱性溶液的氛围,电极反应式可以写:I2-10e-+12OH-2IO-3+6H2O.反应中消耗的OH-比生成的IO-3多,负电荷减少,正电荷增加,多余的K+则由a室通过阳离子交换膜进入b室.该题考查时虽然没有要求写出阳极的电极反应式,但从离子移动的方向来看,还是需要能分析清楚阳极的反应情况.虽然平时的教学中有关I2的内容较少,但依据该题中情境的实际情况来分析就可以得到答案.
(2018年全国卷Ⅱ-26节选),以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
电解硫酸锌溶液制备单质锌时,阴极的电极反应式为_______;
分析:该工业流程最终目的为了制取锌单质.将原料闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)经过一系列反应后去除其中的杂质,并转化为ZnSO4溶液.如果电解ZnSO4稀溶液,也许发生反应的物质仍然是水,但题中要求得到锌单质,发生反应的物质必定是Zn2+.也许在平时的学习中一般认为,在水溶液中活泼金属的离子不容易参加反应,如果采用锌作电极,并通过增加锌离子的浓度来增强氧化能力,反应是完全可以发生的.这其实也是氢在锌电极上具有超电势所致.该方案最后可以选择电解饱和硫酸锌溶液,则锌离子发生反应就很正常.这种情况就需要考虑实际问题,不能墨守成规,认为水溶液中一定反应的是H+或者OH-.
电化学的基础是氧化还原反应,在处理电化学问题时要抓住本质(电子转移的情况)和现象(微粒中元素化合价的变化)这两个方面分析,同时注意结合具体的反应情况就可以完美的解决问题.虽然需要回答的问题只是一到两个方面,但在分析时应该把握住整个装置.
参考文献:
[1]中华人民共和国教育部.普通高中化学课程标准(2017年版)[M].北京:人民教育出版社,2018.
[2]李宗来,李小娟.例谈电解原理在高考题中的应用[J].化学教学,2019(5):37-39.
[3]曹锡章,张婉蕙,杜尧国.无机化学[M].北京:高等教育出版社,2002.
[责任编辑:季春阳]

