分类例析电离平衡常数的求解技巧与方法
2020-09-10 08:34:08安徽朱景松
高中数理化 2020年14期
◇ 安徽 朱景松
电离平衡常数是弱电解质电离和盐类水解之间的桥梁,但电离平衡常数的求解是很多学生学习的难点,解题过程中往往无从下手,主要原因在于没有深刻理解电离平衡常数与电离和水解之间的内在联系.笔者对常考形式中所涉及的计算方法进行了总结,供大家参考和借鉴.
1 借助图象交叉点进行求解
首先列出电离平衡常数表达式,明确需要哪些微粒的相关量,再借助图象找出两种微粒的交点,带入电离平衡常数表达式得电离常数即为交叉点处的c(H+).

图1
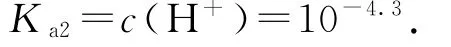
2 借助守恒关系进行求解
根据题中信息利用电荷守恒或物料守恒求得各微粒浓度,再代入电离平衡常数表达式即可求解.
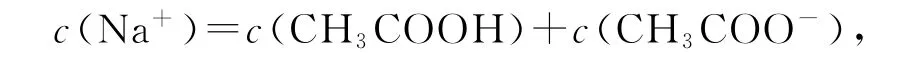
则c(CH3COOH)=c(Cl-).
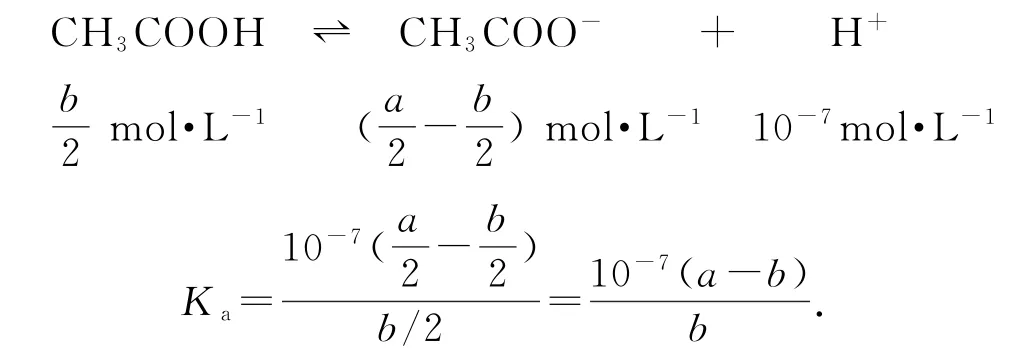
3 借助水解平衡常数和水的离子积常数求解
对于任意弱电解质来讲,其水解平衡常数、水的离子积常数和电离平衡常数均有如下关系:K(电离平衡常数)·Kh=Kw,借助Kh和Kw即可求得K(电离平衡常数).电离平衡常数、对应离子的水解常数Kh以及水的离子积常数Kw的关系是K·Kh=K.
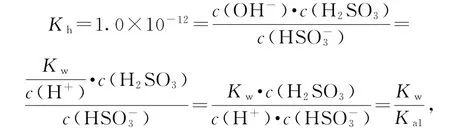
则H2SO3的一级电离常数Ka1=1.0×10-2.
4 借助化学平衡常数和溶解平衡常数求解
首先写出已知反应的化学平衡常数表达式,然后通过添加相关离子构建出需要求解的电离平衡常数和溶解平衡常数,通过已知反应的化学平衡常数和溶解平衡常数即可求得答案.
以上是弱电解质电离平衡常数求解的常见解法,也是常考方式,只要能将以上分析的题型和方法熟练掌握并转化为自己的解题思路,并在日常的学习过程中多加总结即可轻松解答出此类型题目.
猜你喜欢
中学生数理化·自主招生(2022年10期)2022-05-30 10:48:04
中学生数理化·自主招生(2022年10期)2022-05-30 10:48:04
中学生数理化(高中版.高考理化)(2021年10期)2021-12-06 03:26:12
中学生数理化·自主招生(2021年10期)2021-05-30 10:48:04
中学生数理化(高中版.高考理化)(2020年10期)2020-10-27 03:06:58
中学生数理化(高中版.高二数学)(2020年2期)2020-04-21 07:47:48
小学生学习指导(中年级)(2019年3期)2019-04-10 01:58:06
中学教学参考·理科版(2016年3期)2017-05-19 18:38:46
中学生物学(2016年8期)2016-01-18 09:08:18
中华建设科技(2014年6期)2014-08-27 04:16:40

