高正加速度对种植体周围牙槽骨组织成骨细胞功能的影响
种植义齿修复缺失牙可以达到传统修复无法比拟的良好功能和美学效果,以及较高的远期成功率,因此已被口腔医学界公认为缺失牙修复的首选方式,但是目前在我国,种植牙技术仍未被用于军事飞行人员的牙列缺损修复[1-2]。军事飞行人员及航天员在飞行过程中会遇到超重、失重等各种特殊的力学环境,其中以受到高正加速度(+Gz)的作用最多[3]。高正加速度环境会引起人体的一系列生物学效应,包括体质量增加、血液柱流体静压增大及血液转移、器官移位及变形等[4-5]。在种植体骨结合的过程中,成骨细胞是最重要的功能细胞,多种细胞因子都能够刺激成骨细胞的增殖和活性,促进种植体周围骨的生长。骨形成蛋白2(bone morphogenetic protein 2,BMP-2)可以诱导间充质细胞向软骨及成骨样细胞方向转化[6-7];骨桥蛋白(osteopontin,OPN)被认为是成骨细胞在基质形成和成熟阶段的特征性标志物[8-9];而转化生长因子-β1(transforming growth factor-β1,TGF-β1)可调节成骨细胞活性[10]。这3个细胞因子都是能够体现成骨细胞活性与功能的重要标志物。本研究旨在建立动物模型,通过比较BMP-2,OPN和TGF-β1 mRNA在种植体植入后的变化,分析高正加速度环境对于种植术后种植体周围骨组织中成骨细胞的功能的影响。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 新西兰白兔30只,雄性,体质量(2 485±248)g,口内状况良好,购自北京联合利华实验动物养殖中心。
1.1.2 实验试剂 Trizol(Sigma公司,美国);SuperRT cDNA第一链合成试剂盒(康为世纪公司,北京);荧光定量PCR检测试剂盒(ABI公司,美国)。
1.1.3 主要实验设备 纯钛种植体(山东烟台威高医疗器械公司,中国):直径3 mm,长度10 mm,种植体表面经过大颗粒酸蚀喷砂处理,γ射线消毒后单独包装备用。手术器械:牙科探针、拔牙钳、微创挺、止血钳、持针器、可吸收缝线、眼科剪、种植体持钉器。术前手术器械常规高温高压消毒灭菌。其他实验设备:小动物离心机(奥普光电技术公司,长春);Nanodrop-2000分光光度计(Thermo公司,美国);Roche lightcyler 480 PCR仪(Roche公司,瑞士);Veriti 96孔梯度PCR仪(ABI公司,美国)。
1.2 实验方法
1.2.1 动物模型的建立与取材 按随机数字表将30只实验动物随机分为3周对照组(A1)、3周实验组(B1)、5周对照组(A2)、5周实验组(B2)、12周对照组(A3)、12周实验组(B3),每组各5只。实验动物在适应性饲养1周后,在3%戊巴比妥钠腹腔麻醉和1%阿替卡因肾上腺素注射液局部麻醉下,拔除兔子下颌2颗切牙,在每个拔牙窝内即刻种植1颗种植体,植入扭力矩为15 N·cm,术后严密缝合下颌牙龈。术后给动物肌注青霉素40万 U/d,并每天清理口腔,连续3 d,期间密切观察其伤口愈合情况及精神活动状况。术后休息1周,然后实验组动物在小动物离心机上开始加载+Gz。根据飞行员飞行训练以及实战演练的实际情况,并参考国军标GJB4423-2002高性能歼击机飞行员离心机训练方法与评定及国外的训练方案[11],设定了实验动物每次的高正加速度暴露方案,加速度的增长率为1 G/s,加载间隔为1 min,每周暴露3次(周一、周三、周五)(图1)。对照组动物不进行+Gz暴露,常规饲养。A1、B1组在暴露+Gz2周后处死,A2、B2组在暴露+Gz4周后处死,A3、B3组在A3组暴露+Gz4周,然后常规饲养7周后处死。截取含种植体的标本,修整以后以生理盐水反复冲洗,用直径5 mm的环钻将种植体及其周围骨质取出,然后剥离种植体周围的骨质放入液氮中保存备用。每组最后收获10个标本。
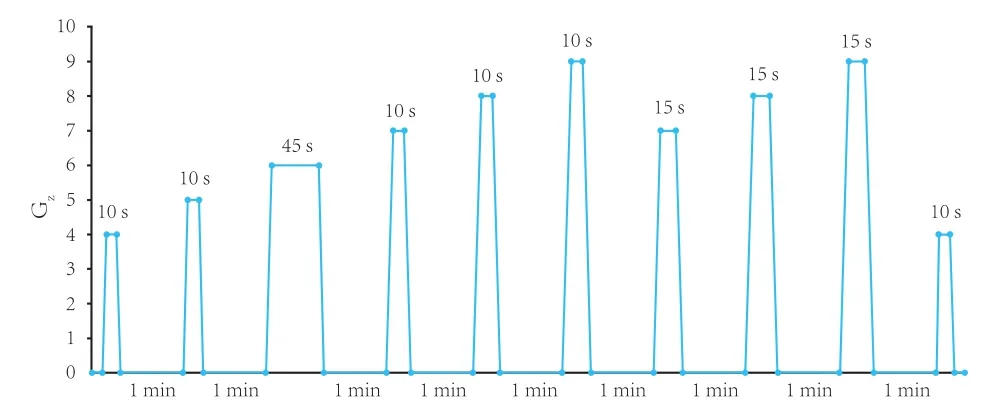
图1 实验组动物离心训练方案
1.2.2 RT-PCR检测 将骨组织标本放入预冷的研钵中,迅速研磨至细粉,按照Trizol试剂盒的操作步骤提取总RNA,经紫外分光光度计检测,A260/A280比值在1.8~2.0之间。取2 µg总RNA按照试剂盒的步骤要求合成cDNA并进行RT-PCR检测,每个cDNA模板都重复加3个孔,并设置以RNase-Free Water替代cDNA模板的阴性对照孔。检测的目的基因BMP-2、OPN、TGF-β1以及内参基因GAPDH的引物序列参照表1,将最后检测到的各标本的Ct值采用2-ΔΔCt法计算各样品的相对表达量。
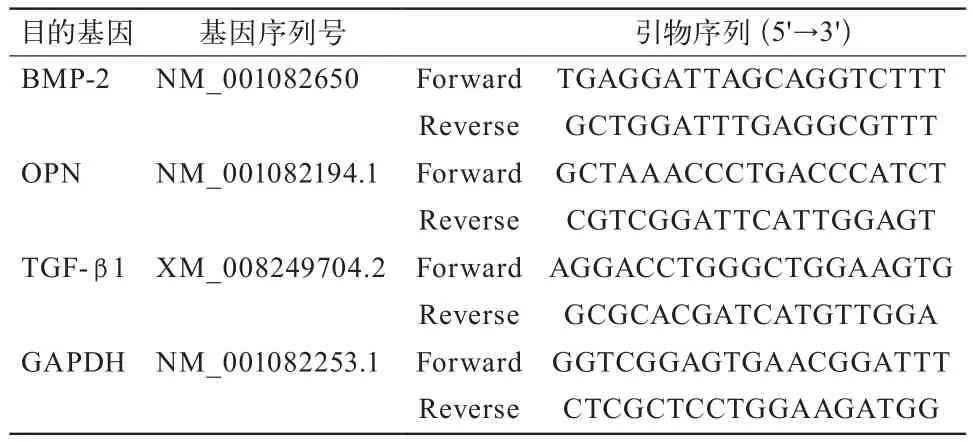
表1 检测基因的PCR引物序列
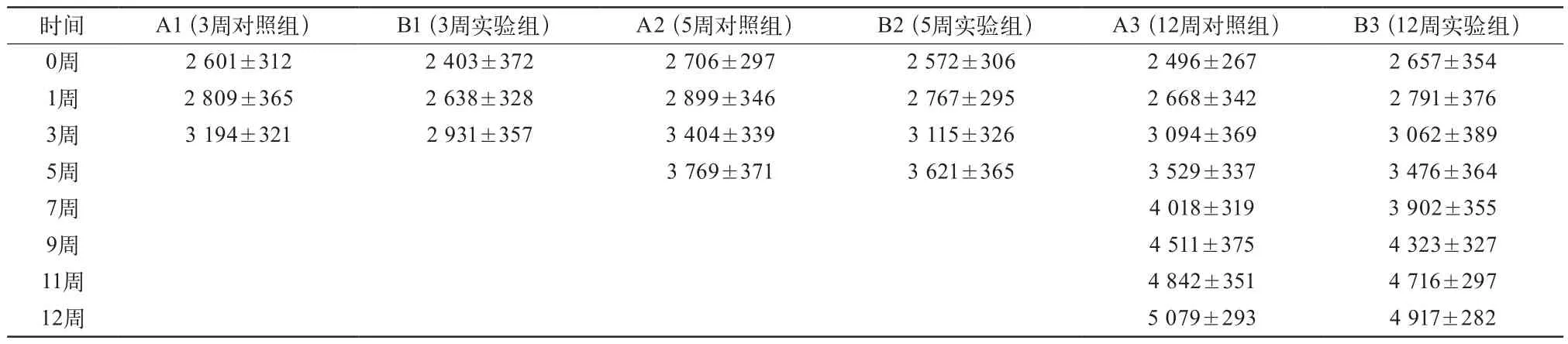
表2 新西兰白兔平均体质量(g)
1.3 统计学处理 应用SPSS 19.0软件对数据进行统计分析,若满足方差齐性,则采用2组独立样本的t检验进行分析,若不齐,则采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 动物的一般情况 30只实验动物均顺利完成了拔牙和即刻种植手术,术后均无死亡,术后第2天动物可自主少量进食。术后术区伤口愈合良好,无红肿流脓等症状。实验组动物能够耐受实验中设计的+Gz环境,在加载+Gz后无明显异常。整个实验过程中实验组动物与对照组动物体质量均稳定增长,2组动物体质量差异无统计学意义(表2)。
2.2 BMP-2,OPN和TGF-β1的mRNA表达情况 实验组和对照组BMP-2,OPN和TGF-β1的mRNA表达均在术后3周时最高,在术后5周和12周时逐渐降低。术后3周,实验组BMP-2、OPN和TGF-β1的mRNA表达低于对照组(P<0.05),分别为对照组的0.55、0.60和0.80倍。术后5周,实验组TGF-β1的mRNA表达仍低于对照组(P<0.05),为对照组的0.77倍。术后12周,2组BMP-2,OPN和TGF-β1的mRNA表达差异无统计学意义(表3)。
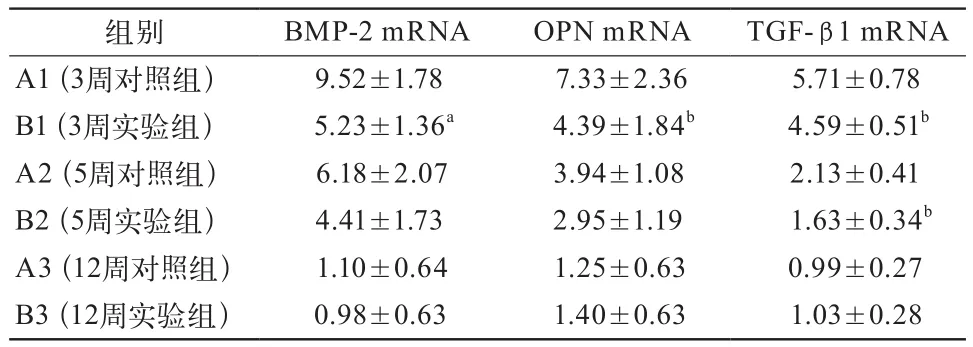
表3 各组种植体周围骨组织中BMP-2、OPN和TGF-β1 mRNA的相对表达量
3 讨论
种植体-骨结合是一个骨形成和骨改建相结合的过程,在这个过程中,成骨细胞是最重要的功能细胞。多种细胞因子能够刺激成骨细胞的增殖和活性,促进种植体周围骨的生长,才能在种植体周围形成稳固的骨结合[12-13]。
骨形成蛋白是骨形成发生最早期的信号分子,也是目前唯一已经确定具有单独诱导间充质细胞向软骨及成骨样细胞方向转化,并能异位成骨的生长因子。BMP-2在骨诱导、骨改建及维持骨的矿物质含量中发挥着重要作用[6-7,14]。许多实验也都证实在种植体周围局部应用人工合成BMP能够促进种植体周围骨形成以及种植体周围骨缺损的修复[15-16]。OPN是一种基质调节蛋白,在骨基质的吸收、矿化及维持骨组织与周围组织的完整性中有着重要作用,与骨改建过程有密切关系,被认为是成骨细胞在基质形成和成熟阶段的特征性标志物[8-9]。TGF-β1可调节成骨细胞活性,促进骨基质形成,抑制骨基质降解等,对骨组织的形成和改建有重要意义[10,17]。
本研究中术后3周时BMP-2,OPN和TGF-β1的mRNA表达在检测的3个时间段中都是最高值,以后BMP-2,OPN和TGF-β1的mRNA表达则逐渐降低,说明术后3周时种植体周围成骨细胞的成骨活性最强,骨形成活动最活跃。术后5周较3周比较,成骨细胞活性略有降低;术后12周时,种植体周围的骨形成已基本完成,成骨细胞功能减弱、退化。Zhang等[18]的研究发现在种植体植入后第8天OPN mRNA的表达达到高峰,曾玉等[19]的研究也发现OPN蛋白的表达在种植术后2周时增加到高峰,1个月时表达逐渐下降,与本研究结果一致。
高正加速度环境在术后3周时能够明显的降低BMP-2,OPN和TGF-β1的mRNA表达,在术后5周时仍能够明显降低TGF-β1的mRNA表达,说明高正加速度能够抑制成骨细胞的分化及成骨作用,减缓骨形成的速度,因此可能会对种植体植入后的骨结合有不利影响。
综上所述,BMP-2,OPN和TGF-β1在种植体周围骨组织中的表达变化与种植体周围骨形成过程一致;高正加速度环境能够降低BMP-2、OPN和TGF-β1的表达,抑制成骨细胞的功能,减缓骨形成,不利于种植体的愈合。

