血清IL-33 在子痫前期患者中的表达及临床意义
王东东
(河南省第二人民医院检验科,河南 郑州450191)
子痫前期是一类影响约2~7%孕妇并威胁母婴生命的常见且复杂疾病[1,2]。目前研究证实该病主要发病机理为缺血再灌注,导致胎盘循环紊乱及滋养层细胞分泌促炎细胞因子,分泌过度的促炎细胞因子造成内皮损伤,进而诱发全身炎症反应,引起高血压和蛋白尿等症状发生[3]。 白介素33(IL-33)是新近发现的IL-1 家族成员之一, 其在机体免疫中可发挥双重效应,即参与Th2 型细胞免疫过程和作为核因子扮演转录调控角色。 新近研究还发现IL-33 还可能涉及Th1 型免疫反应[4]。IL-33 兼具抗炎和促炎的效应在不同疾病中可能存在偏倚,但至今尚不清楚其在子痫前期患者中的表达情况,故本研究通过检测子痫患者外周血IL-33 浓度,并与健康妊娠妇女比较,探讨血清IL-33 与子痫前期的关系及临床意义。 报告如下。
1 材料与方法
1.1 纳入研究对象 随机选取2016 年2 月至2018年4 月于本院产科收治的子痫前期患者68 例,平均29.28±3.49 岁,平均孕周35.61±2.05 周;其中轻度子痫前期患者33 例及重度子痫前期患者35例,所有患者诊断及分类标准参考第七版《妇产科学》[5],具体标准如下:轻度子痫前期:妊娠20 周后出现血压≥140/90 mmHg;尿蛋白≥300 mg/24h 或随机尿蛋白(+);可伴有上腹不适、头痛等症状;重度子痫前期:BP≥160/110 mmHg; 尿蛋白≥2.0g/24h 或随机尿蛋白≥(++);血清肌酐>106μmol/L,血小板<100×109/L;血乳酸脱氢酶(LDH)升高;血清谷丙转氨酶或谷草转氨酶升高; 持续性头痛或其它脑神经或视觉障碍,持续性上腹不适。 同时选取同期30 例既往无合并症及并发症的健康孕妇作为研究对照组,平均27.6±1.91 岁,孕周37.7±1.87。子痫前期患者与健康对照孕妇均为单胎妊娠,并排除既往高血压、甲亢及糖尿病等合并症,子痫前期患者与健康对照组间孕周及平均年龄等一般资料比较差异无统计学意义(P>0.05)。
1.2 标本采集及测定方法 所有纳入研究对象均在入院后分娩前抽取清晨空腹静脉血5ml 于促凝管中,室温静置30min 后,3000rpm 离心5min,分离血清置于-80℃冰箱中备用。 血清IL-33 浓度测定采用酶联免疫吸附试验(ELISA 法),试剂盒购自R&D 公司(美国),所有试验过程及操作步骤严格按照试剂盒说明书执行。
1.3 统计学分析 采用SPSS19.0 统计软件分析数据,所有数据以x±s 表示,两样本比较采用独立样本t 检验,多样本均数比较用单因素方差分析,两组间数据相关性采用Spearman 相关系数分析,P<0.05为差异有统计学意义。
2 结果
2.1 子痫前期患者舒张压及收缩压 子痫前期患者平均收缩压161.91±17.28mmHg, 显著高于对照组117.63±8.93mmHg,P<0.05;其中轻度组低于重度组15.33±13.92mmHg vs 170.94±16.31mmHg,P<0.05。 子痫前期患者平均舒张压108.26±11.47 mmHg,显著高于对照组81.03±6.29mmHg,P<0.05;其中轻度组低于重度组96.68±9.64mmHg vs 11 9.18±11.32mmHg,P<0.05。
2.2 子痫前期患者血清IL-33 表达水平 ELISA 结果表明子痫前期患者外周血血清IL-33 浓度显著下调, 低于健康对照组21.05±9.58 pg/ml vs 31.26±3.11 pg/ml,差异有统计学意义(P<0.05)。 此外,将子痫前期患者分为轻度组和重度组分析血清IL-33 水平发现, 重度组子痫前期患者18.89±8.23 pg/ml 外周血IL-33 浓度显著低于轻度组23.34±5.97 pg/ml,且均低于健康对照组,差异有统计学意义(P<0.05),见表1。
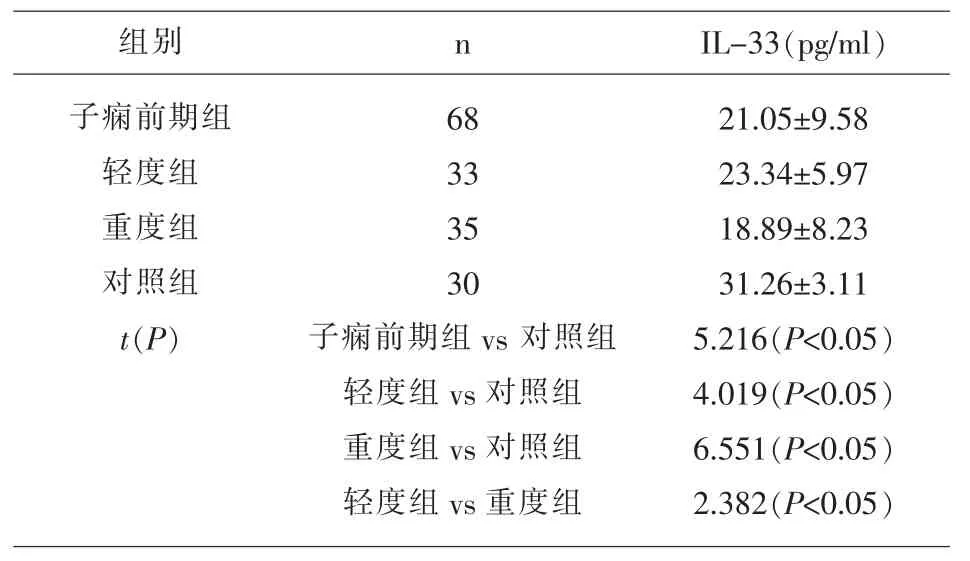
表1 血清IL-33 在子痫前期患者及健康对照组中的表达
2.3 子痫前期患者血清IL-33 水平与舒张压及收缩压间的相关性 子痫前期患者血清IL-33 表达水平与患者收缩压(r=-0.519,P<0.05)及舒张压(r=-0.661,P<0.05)均呈显著负相关。
2.4 受试者诊断曲线(ROC)评价血清IL-33 诊断子痫前期的性能 ROC 曲线显示血清IL-33 诊断子痫前期具有一定的价值, 曲线下面积(AUC)为0.80(95%CI 0.6839~0.9095,P<0.05),当cutoff 值取24.4 pg/ml 时,其敏感性和特异度较好,分别为75.86%和72.41%。 见图1。
3 讨论
子痫前期病因学包括母体和胎儿/胎盘因素,目前已有多种评估子痫前期疾病发展的生物标志物被加以研究[6,7,8]。异常的滋养细胞侵入、免疫平衡紊乱、血管生成、内皮损伤及遗传和环境因素均与子痫前期密切相关[9]。 其中免疫平衡紊乱被认为是子痫前期疾病进展的重要环节,如Th1/Th2 细胞反应[10]。正常妊娠过程机体为保护胎儿促进Th2 细胞增殖而抑制Th1 细胞反应。但子痫前期患者其Th1反应增强,表明Th1/Th2 偏移与子痫前期发生存在关联。IL-33 是一类可促进Th2 细胞反应及2 型细胞因子重要来源的2 型固有淋巴细胞的IL-1 家族新成员。 IL-33 发挥特殊的生物学效应,一方面其可作为警报素形成促炎效应,另一方面其又可在某些疾病背景下通过诱发2 型免疫反应抑制炎症[11]。IL-33 这一特殊双重功能在乙肝、炎症性肠病及动脉粥样硬化等疾病中已获证实[12,13]。 然而IL-33 诱发的2 型细胞反应却又可以加重哮喘。 此外近期研究表明IL-33 可以促进CD4+Foxp3+调节性T细胞增殖,进而发挥免疫抑制功能。 IL-33 在子痫前期发病机理中发挥促炎或抑炎效应,目前尚不清楚。
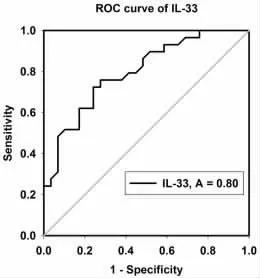
图1 IL-33 诊断子痫前期的ROC 曲线
通过纳入68 例子痫前期患者,ELISA 检测血清IL-33 浓度,并与健康妊娠人群比较,结果发现子痫前期患者外周血血清IL-33 浓度显著下降,低于健康对照组,且差异有统计学意义。 进一步研究将子痫前期患者分为轻度组和重度组分析, 结果血清IL-33 在重度组子痫前期患者血清中显著低于轻度组,且均低于健康对照组,差异有统计学意义。 此外,IL-33 表达水平与患者收缩压及舒张压均呈显著负相关。较低水平的IL-33 与子痫前期相关,且随着疾病进展进一步下调,提示IL-33 在子痫前期患者中可能发挥抑制炎症作用, 而较低的浓度不足以抑制机体持续炎症进而促进子痫前期发生发展。 Granne 等[14]报道IL-33 在非妊娠女性、正常妊娠及子痫前期患者中的表达情况, 但结果发现IL-33 在三组研究对象中并无显著差异。这与本研究发现的结果存在差异, 但Granne 等的研究仅纳入20 例患者,而本研究纳入病例更多。 此外,这一差异也可能是因为血清存储条件、ELISA 试剂盒或其他实验技术不同造成的。 近期,石书明等[15]利用免疫组化和Western blot 技术在子痫前期患者的胎盘组织中也发现IL-33 含量显著低于正常妊娠胎盘组织,这与本研究在子痫前期患者血清中的发现相一致。 此外,ROC 曲线还揭示血清IL-33 对于诊断子痫前期具有一定的价值。
总之,本研究发现血清IL-33 在子痫前期患者中表达显著下调,并随着疾病进展不断降低,且与患者收缩压和舒张压均呈负相关性,提示IL-33 可能参与子痫的发生发展过程。

