HSP 患儿外周血中T 细胞变化、血清GdIgA1、NF-κB的变化及其意义
刘新学,王高锋,时娟
(新蔡县妇幼保健院儿科,河南 驻马店463500)
1 对象与方法
1.1 对象 选取2015 年8 月-2018 年7 月于新蔡县妇幼保健院确诊的HSP 患儿66 例为HSP 组、选取同期进行体检的健康儿童60 例作为对照组。HSP 组,男41 例、女25 例;年龄3~14 岁,平均8.7±2.6 岁;平均体重31.2±3.2kg,依据2010 年欧洲儿科风湿病协会修订的诊断标准: 普通型26 例、腹型28 例、紫癜性肾炎患儿12 例。对照组,男38 例、女22 例;年龄3~14 岁,平均8.5±2.0 岁;平均体重32.0±3.7kg。 两组儿童的年龄、性别、体重比较,差异均无统计学意义(P>0.05)。
1.2 相关标准 诊断标准:HSP 患儿的诊断标准参考2010 年欧洲儿科风湿病协会修订的诊断标准。纳入标准:⑴患者年龄3~14 岁;⑵均为初诊患儿,且入院时处于急性期。 ⑶对照组儿童来源体检中心,体检结果均为健康;⑷本研究经医学伦理委员会同意后实施。 排除标准:⑴恶性肿瘤;⑵其他类型风湿、免疫学疾病;⑶先心病;⑷既往具有糖皮质激素治疗史;⑸合并其他系统的重大疾病。
1.3 方法
1.3.1 ELISA 法测定NF-κB、Gd-IgA1 清晨抽取外周空腹静脉血3ml,静置20min,3000 r/min 离心10min 后保留血清并置于-80℃冰箱中待测。 试剂盒均由美国TSZ 公司提供, 按照试剂盒说明书进行检测。
1.3.2 流式细胞仪检测Tfh、Tfr 细胞水平 在进行治疗前抽取外周静脉血4ml,放入含EDTA 的试管中, 使用密度梯度离心法分离外周血单个核细胞(peripheral blood mononuclear cell, PBMC)。 将PB MC 悬液分装成两个试管, 两管都加入10μl 的CD 4-FITC、CXCR5-APC 和ICOS-PECy5 单克隆抗体(美国eBioscience 公司产品),避光孵育0.5h,再将500μl 的红细胞裂解液加入试管内。 其中1 管PBMC 悬液用PBS 洗涤, 采用流式细胞仪检测Tfh细胞表达情况; 另1 管经PBS 洗涤离心后则加入Foxp3-PE(美国eBioscience 公司产品),避光孵育15 min,采用流式细胞仪检测Tfr 细胞表达情况。
1.4 统计分析 本研究中所有数据的分析均采用SPSS21.0 版本, 年龄、Tfh 细胞、Tfr 细胞、GdIgA1、NF-κB 水平等计量指标采用x±s 表示,数据对比分析应用t 检验或方差分析法,方差分析具有统计学意义的结果采用LSD-t 检验; 采用χ2检验对两组性别进行构成比较;P<0.05 为差异有统计学意义。
2 结果
2.1 二组Tfh 细胞、Tfr 细胞、GdIgA1、NF-κB 水平比较 HSP 组的Tfh 细胞、GdIgA1、NF-κB 水平比较高于对照组(P<0.05),HSP 组的Tfr 细胞低于对照组(P<0.05),见表1。
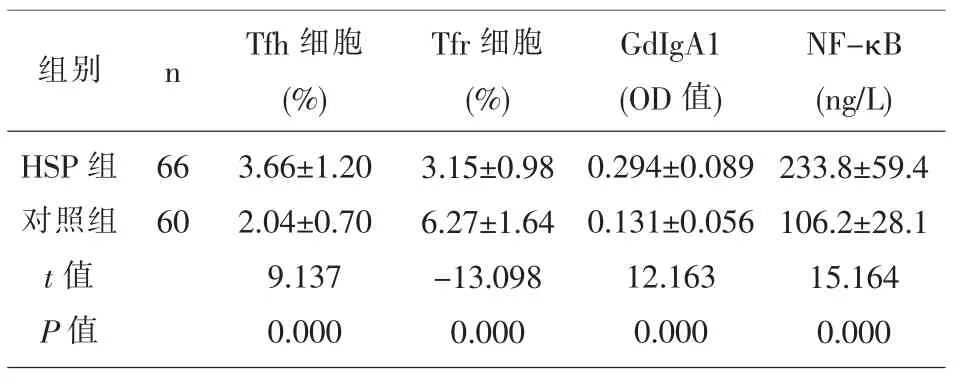
表1 二组Tfh 细胞、Tfr 细胞、GdIgA1、NF-κB 水平比较(x±s)
2.2 急性期与缓解期HSP 组患儿的Tfh 细胞、Tfr细胞、GdIgA1、NF-κB 水平比较 急性期HSP 组患儿Tfh 细胞、GdIgA1、NF-κB 水平比较高于缓解期(P<0.05),急性期HSP 的Tfr 细胞低于缓解期(P<0.05),见表2。
2.3 不同临床分型的HSP 组患儿Tfh 细胞、Tfr 细胞、GdIgA1、NF-κB 水平比较 急性期,紫癜性肾炎患儿Tfh 细胞、GdIgA1、NF-κB 水平比较高于普通型、腹型组(P<0.05),紫癜性肾炎患儿Tfr 细胞低于普通型、腹型组(P<0.05);腹型患儿Tfh 细胞、GdIgA1、NF-κB 水平比较高于普通型(P<0.05),腹型组患儿Tfr 细胞低于普通型(P<0.05)。 见表3。
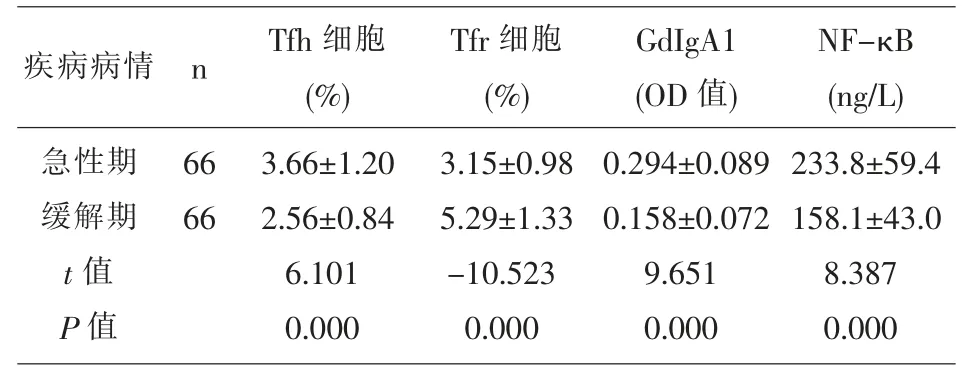
表2 急性期与缓解期HSP 组患儿的Tfh 细胞、Tfr 细胞、GdIgA1、NF-κB 水平比较(x±s)
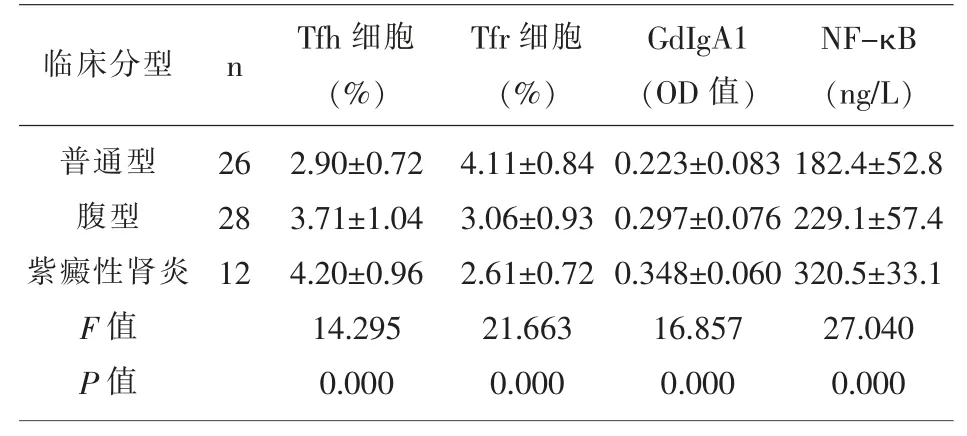
表3 不同临床分型的HSP 组患儿Tfh 细胞、Tfr 细胞、GdIgA1、NF-κB 水平比较(x±s)
3 讨论
HSP 可侵袭全身多个系统,常以皮肤、关节、消化道和肾脏受累为主,重者也可出现心、肺、脑及胰腺等的受累[7],其具体发病机制仍需探讨。
HSP 可看作为由Gd-IgA1 引发的免疫性血管炎, 异常Gd-IgA1 分子导致Gd-IgA1 聚集和形成大分子Gd-IgA1 复合物的倾向增加[8],此种Gd-Ig A1 在肝脏内不能完全代谢而沉积在全身各大系统的中小血管内,激活补体旁路途径,触发炎症介质释放,引起中小血管内皮细胞的损伤。NF-κB 为调控炎症反应的关键因子, 在Gd-IgA1 肾病中表达水平也较高[9]。 但他们之间是否有某种联系共同导致HSP 的发生有待阐明。
Tfh 细胞是CD4+ T 细胞亚群中的一员, 可辅助B 淋巴细胞的分化, 还可使抗体类型发生转换。目前认为自身反应性B 细胞过度活化可能会使Gd-IgA1 抗体过度产生,而这是HSP 的重要发病机理[10,11],但其中B 细胞过度活化的原因尚不完全明确。
本研究将HSP 患者作为观察对象, 检测其外周血中Tfh、Tfr 细胞、血清Gd-IgA1、NF-κB 水平,并根据患儿病情分为急性期、缓解期,急性期时不同临床类型进行亚组分析,揭示HSP 患儿血清中T淋巴细胞、Gd-IgA1、NF-κB 的变化与病情变化的关系。 本研究发现:HSP 组的Tfh 细胞水平比较高于对照组,Tfr 细胞低于对照组;急性期HSP 组患儿Tfh 细胞高于缓解期,急性期HSP 的Tfr 细胞低于缓解期;急性期,紫癜性肾炎患儿Tfh 细胞水平比较高于普通型、腹型组,紫癜性肾炎患儿Tfr 细胞低于普通型、腹型组;腹型患儿Tfh 细胞水平比较高于普通型,腹型组患儿Tfr 细胞低于普通型。 提示Tfh 及Tfr 细胞异常表达可能参与了儿童HSP的发病过程。
本研究结果显示:HSP 组的Gd-IgA1 水平显著高于对照组,IgA1 免疫复合物在小血管壁和消化道和肾脏的沉积中引起炎症和组织损伤,引发对HSP 异常的免疫炎症反应。 Gd-IgA1 的水平与HSP 疾病的活性和严重程度密切相关。Gd-IgA1 可能是发生HSP 的起始因子之一。 本研究发现急性期Gd-IgA1 水平明显高于缓解期,具有不同临床表现的HSP 组中Gd-IgA1 水平不同。 急性期紫癜性肾炎组Gd-IgA1 水平高于普通组和腹部组。 腹部组高于普通组。 提示Gd-IgA1 可反映HSP 急性期活动状态, 高水平的Gd-IgA1 与HSP 脏器严重损伤如消化道粘膜出血坏死、肾脏损伤均密切相关,且Gd-IgA1 水平与肾脏损害的关系更加密切,有助于判断HSP 的预后。
缓解期HSP 患者水平并未将至正常水平,可能是由于患儿早期肾脏损伤尚未痊愈。 有研究表明[12],半乳糖基化缺失的水平决定着自身免疫反应的程度, 而免疫复合物形成的量影响着HSP 的临床表现。 Gd-IgA1 水平变化可预示HSP 的病情发展情况,对评估患者预后意义重大。
NF-κB 活化后可使IL-6、IL-8、TNF-α 等因子产生增加,加重细胞组织损伤程度。NF-κB 在血清及组织内表达具有一致性[13,14]。 本研究通过对HSP患儿不同时期的NF-κB 检测发现,HSP 患者的NF-κB 水平较对照组明显升高,提示NF-κB 可能参与了HSP 的发生,但缓解期尚未降至正常水平,推测NF-κB 参与HSP 的小血管炎症反应,其活化水平与疾病的活动状态有关。 同时,肾损伤引起的HSP 患儿NF-κB 水平的恢复需要一定的时间,这可能与NF-κB 在调节抗炎基因表达和炎症反应中的作用有关。 肾小球病理损伤后细胞凋亡,不同临床类型的HSP 中NF-κB 水平不同。急性期HSP 组患儿NF-κB 水平高于缓解期,急性期,紫癜性肾炎患儿NF-κB 水平高于普通型、 腹型组, 腹型患儿NF-κB 水平高于普通型。这表明NF-κB 和HSP 与器官受累的情况和疾病严重程度有一定的相关性。有研究[15]表明肾脏损害和消化道出血患者血清中NF-κB 水平升高,当肾小球处于炎性状态时NF-κB 水平明显升高,这可能是由于肾小球免疫活性细 胞 大 量 表 达NF-κB,NF-κB 活 化 程 度 越 高,TNF-α、IL-1B、IL-6 等细胞因子产生的越多,炎症反应越剧烈,小血管出血坏死及肾小球炎性损伤更加严重,患者的病情更为严重。
综上所述,HSP 患儿存在典型的免疫失衡、炎性反应,并且与患儿的病情严重程度、临床分型情况有关。

