芒柄花黄素对体外卵巢癌细胞活力、迁移与侵袭的影响*
古彩茹,林梦园,刘 威
(1广州市红十字会医院,暨南大学附属广州红十字会医院妇科,广东广州510220;2深圳市人民医院妇科,深圳518020;3广州市红十字会医院,暨南大学附属广州红十字会医院乳腺科,广东广州510220)
卵巢癌是女性生殖系统常见恶性肿瘤之一,其发病率仅次于宫颈癌,占女性生殖系统恶性肿瘤的第2位[1]。由于卵巢癌起病隐匿,确诊时多处于晚期且伴有转移,而复发、转移是卵巢癌患者死亡的最主要原因。由于缺乏有效的治疗药物,患者一旦出现复发、转移,预后会很差。因此,在天然植物中寻找高效且毒副作用小的抗肿瘤药物是可行的策略之一,也是目前卵巢癌治疗的研究热点。
芒柄花黄素(formononetin,Form)是一种异黄酮类植物雌激素,是豆科植物红三叶草的主要活性成分,也是常用中草药当归、黄芪、葛根等的活性成分之一。研究显示,芒柄花黄素具有保护血管[2]、抗炎[3]、抗焦虑[4]、预防骨质疏松[5]等方面的药理作用。此外,芒柄花黄素还具有较强的抗肿瘤作用[6-7],但具体的作用机制不明。本研究拟用芒柄花黄素作用于卵巢癌细胞进行体外实验,观察其对卵巢癌细胞活力、迁移与侵袭的影响。
材料和方法
1 主要材料与试剂
芒柄花黄素和二甲基亚砜购自Sigma;高糖DMEM 培养液和胎牛血清购自Gibco;人卵巢浆液性囊腺癌SKOV-3 细胞由中科院上海细胞生物研究所提供;实验所用GAPDH、上皮钙黏素(E-cadherin)和基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)I 抗及相应 II 抗均购自 Cell Signaling Technology;Trizol 裂解液、RNA 逆转录试剂盒和 real-time PCR 试剂盒购自TaKaRa;PCR 引物由上海生工公司合成;MTS 试剂盒购自Promega;蛋白裂解液购自碧云天生物技术有限公司;总蛋白测定试剂盒购自Bio-Rad;ECL发光试剂盒购自Thermo Scientific。
2 主要方法
2.1 细胞培养 将SKOV-3 细胞用含10%胎牛血清、1×105U/L 青 霉素和 100 mg/L 链 霉素的 高 糖DMEM 培养液,置于 37℃、5% CO2细胞培养箱中培养。
2.2 MTS 法检测细胞活力 取对数生长期的SKOV-3 细胞,调整细胞浓度为5×106/L,每孔100 µL接种于96 孔板,依据李通等[8]采用的对结直肠癌的芝柄花黄素作用浓度,本研究选用20、50、100µmol/L 芒柄花黄素,每组6 个复孔,进行细胞活力测定实验,作用48 h,对照组加入等体积新鲜培养液,培养48 h 后,每孔加入MTS 20 µL,孵育4 h,用酶标仪检测吸光度(A)值,同时使用SPSS 19.0软件probit回归模型计算半数抑制浓度(half maximal inhibitory con‑centration,IC50)。实验重复3次。
2.3 划痕实验 常规消化、离心收集SKOV-3 细胞并计数,然后按照每孔1×106个接种于6 孔板。在5%CO2、37℃孵箱中培养至90%融合度时,在孔板中划一十字型伤口。实验组加入含50 µmol/L 芒柄花黄素的DMEM 完全培养液,对照组加入不含芒柄花黄素的DMEM 完全培养液,在5%CO2、37℃孵箱中培养48 h 后,观察伤口愈合情况并拍照。实验重复3次。
2.4 Transwell 侵袭实验 用无血清培养液处理处于对数生长期的SKOV-3细胞,使其饥饿12h,经胰酶消化、离心收集细胞并计数,用无血清DMEM 培养液调整细胞密度为1×108/L。实验前将Transwell 小室置于 24 孔板内,用 200 µL 无菌吸头迅速吸取 50 µL Matrigel 至预冷的Transwell 上室中,操作过程中避免气泡形成,将包被好Matrigel 的Transwell 小室移入37℃孵箱中待其凝固。在小室上层加入200µL 的细胞悬液,同时分别加入无血清培养液(对照组)和含50µmol/L 浓度的芒柄花黄素,下室加入500µL 的含10%胎牛血清的DMEM 培养液。放入5% CO2的37℃培养箱中培养48 h。结束培养后,用PBS缓冲液冲洗小室3 次,用棉签轻轻擦去小室上层的细胞,将小室置于700 µL 甲醛中,室温固定15 min,用PBS 缓冲液冲洗小室3 次。用0.2%结晶紫染色30 min,PBS 缓冲液充分清洗并晾干小室。倒置显微镜下拍照,每个小室取5 个不同视野求平均值。实验重复3次。
2.5 RT-qPCR 检测相关基因的表达变化 取对数生长期SKOV-3细胞,培养至70%~80%融合时,加入50µmol/L 的芒柄花黄素干预细胞,对照组加入新鲜培养液,培养48 h 后,提取细胞总RNA,取2µL 逆转录成cDNA。以cDNA 产物为模板,RT-qPCR 检测E-cadherin 和 MMP-9 mRNA 的表达。内参照 GAPDH 的上游引物序列为5'-CAGGGCTGCTTTTAACTCTGGT-3',下游引物序列为5'-GATTTTGGAGGGATCTCGCT-3';E-cadherin 的上游引物序列为 5'-ACCTCTGT‑GATGGAGGTC-3',下游引物序列为5'-CCACATTC‑GTCACTGCTACG-3';MMP-9 的上游引物序列为5'-TCCAGTACCGAGAGAAAGCC-3',下游引物序列为5'-GCAGGATGTCATAGGTCACG-3'。反应条件为:95℃ 3 min;95℃ 15 s,60℃ 30 s,72℃ 30 s,40 个循环;72℃10 min。以ABI PRISM 7500 SDS软件分析,以对照组目的基因mRNA 的均数为1,计算其他各组目的基因mRNA的相对表达量。实验重复3次。
2.6 Western blot 检测相关蛋白的表达变化 通过消化、离心分别收集实验组和对照组SKOV-3 细胞,用冰冷PBS 离心洗2 次,加入预冷的细胞裂解液,冰上裂解30 min 后,使用超声破碎仪处理细胞,每次2 s,连续10 次(每次间隔2 s)。4℃、12 000×g离心 10 min,转移含有细胞总蛋白的上清液到新的EP 管中。取少量上清液通过BCA 方法进行蛋白定量,其余蛋白用SDS 变性。以每孔30 µg 的蛋白含量上样,经10% SDS-PAGE 分离后转移至PVDF 膜上,加入5%脱脂奶粉溶液,室温摇床上孵育2 h,加入GAPDH、E-cadherin 和MMP-9 I 抗(均1∶1 000)4℃孵育过夜,用TBST 缓冲液洗 4 次,每次 5 min,加入 II 抗(1∶5 000)于室温摇床上孵育2 h,再用TBST 缓冲液洗涤3 次,每次5 min。应用ECL 化学发光法显影并拍照。以GAPDH 作内参照。Western blot 条带灰度与内参照条带灰度比值通过Bio-Rad软件进行分析。
3 统计学处理
采用SPSS 19.0 软件进行统计学分析。数据用均数±标准差(mean±SD)表示。组间比较采用单因素方差分析和LSD-t检验。以P<0.05 为差异有统计学意义。
结 果
1 芒柄花黄素对SKOV-3细胞活力的影响
MTS 实验结果显示,与对照组相比,各浓度芒柄花黄素对SKOV-3细胞均有不同程度的抑制作用(P<0.01),随着药物浓度增加,抑制作用越来越显著,呈剂量依赖性(P<0.05 或P<0.01),见图1。用SPSS 软件计算得出芒柄花黄素对SKOV-3 细胞的IC50为47.55 µmol/L,因此,我们选择接近IC50的50 µmol/L为芒柄花黄素的浓度进行后续实验。
2 芒柄花黄素对SKOV-3细胞迁移能力的影响
划痕实验结果显示,50µmol/L 芒柄花黄素处理48 h 后,SKOV-3 细胞迁移能力显著下降(P<0.01),见图2。
3 芒柄花黄素对SKOV-3细胞侵袭能力的影响
Transwell 实验结果显示,与对照组相比,50µmol/L 芒柄花黄素组穿过小室膜的细胞数量显著下降(P<0.01),见图3。
4 芒柄花黄素对SKOV-3 细胞中E-cadherin 和MMP-9 mRNA及蛋白表达水平的影响
RT-qPCR 和Western blot 实验结果显示,与对照组相比,50 µmol/L 芒柄花黄素组中 E-cadherin 的mRNA 及蛋白表达水平显著升高(P<0.01),而MMP-9 的 mRNA 及蛋白表达水平显著下降(P<0.01),见图4。

Figure 1.Effects of different concentrations of formononetin(Form)for 48 h on SKOV-3 cell viability.Mean±SD.n=6.**P<0.01 vs 0 µmol/L;##P<0.01 vs 25 µmol/L;&P<0.05 vs 50µmol/L.图1 不同浓度芒柄花黄素作用48 h 对SKOV-3 细胞活力的影响
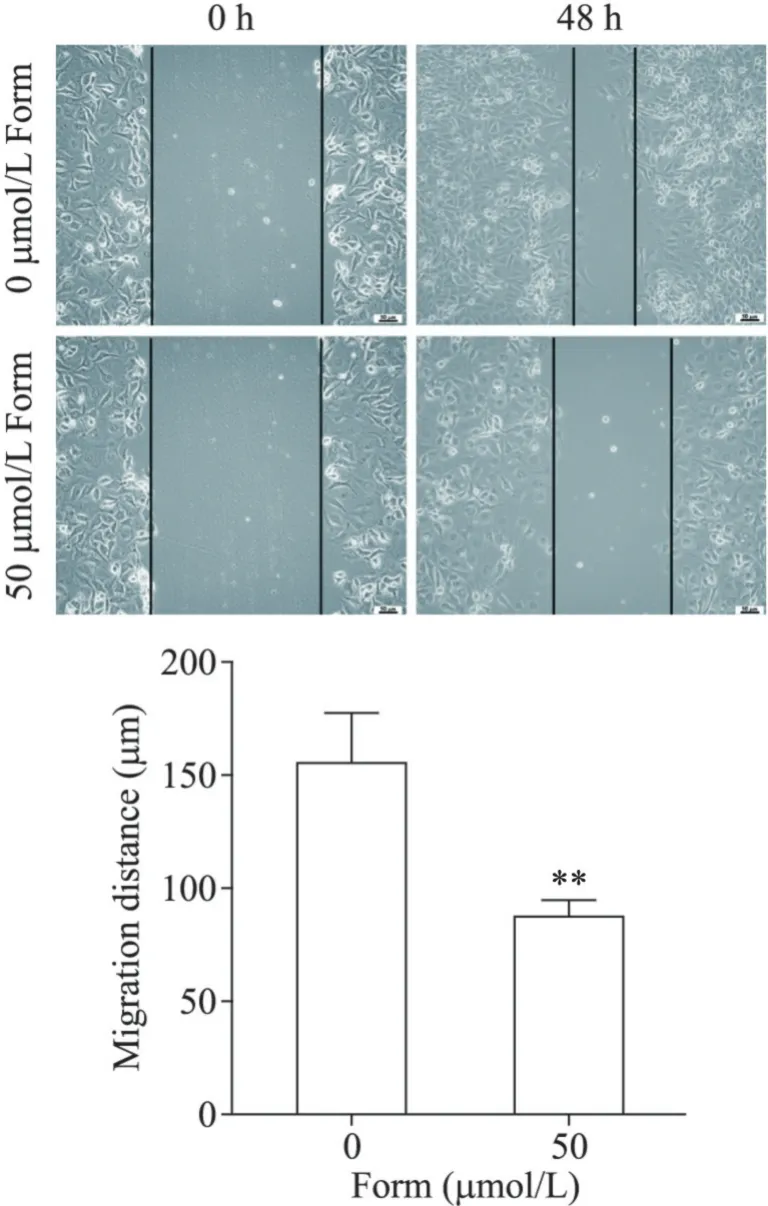
Figure 2.Effect of formononetin(Form)on SKOV-3 cell migra‑tion(scale bar=50 µm).Mean±SD. n=3.**P<0.01 vs 0µmol/L Form group.图2 芒柄花黄素对SKOV-3细胞迁移的影响
讨 论

Figure 3.Effects of formononetin on SKOV-3 cell invasion(scale bar=50 µm).Mean±SD. n=3.**P<0.01 vs 0µmol/L Form group.图3 芒柄花黄素处理SKOV-3细胞后对细胞侵袭力的影响

Figure 4.Effects of formononetin(Form)on the mRNA(A)and protein(B)expression of E-cadherin and MMP-9 in the SKOV-3 cells.Mean±SD. n=3.**P<0.01 vs 0µmol/L Form group.图4 芒柄花黄素对SKOV-3细胞E-cadherin和MMP-9表达的影响
卵巢癌是妇科恶性肿瘤中致死率最高、预后最差的肿瘤。芒柄花黄素是一种生物活性异黄酮,其抗肿瘤作用日益受到人们的关注。现有研究证实,芒柄花黄素对多种实体肿瘤细胞有抗肿瘤作用。芒柄花黄素可抑制小鼠宫颈癌的发展[9]及肺癌细胞的增殖与侵袭[10]。Chen 等[11]的研究表明,芒柄花黄素通过microRNA-375-RASD1-ERα 途径参与乳腺癌细胞的增殖。Wu 等[12]的研究显示,芒柄花黄素通过调节miR-21 和PTEN 抑制膀胱癌细胞的增殖与侵袭。然而芒柄花黄素对卵巢癌影响的相关研究较少,作用机制亦不明确。在本研究中,我们检测了芒柄花黄素对卵巢癌SKOV-3细胞活力的影响,结果显示芒柄花黄素对SKOV-3 细胞的抑制率随药物浓度的增加而增加,这表明芒柄花黄素能够剂量依赖性抑制卵巢癌细胞活力,初步显示芒柄花黄素对SKOV-3细胞的抗肿瘤效用。
肿瘤侵袭转移过程受到多种因素的影响,是一个涉及多阶段和多步骤的复杂过程[13]。肿瘤细胞间黏附丧失是肿瘤侵袭、转移的第一步。研究显示E-cadherin 参与此过程调节,E-cadherin 是上皮细胞的标志物,通过调节细胞与基质间或细胞与细胞间的黏附反应来维持组织结构的完整性[14]。研究显示,E-cadherin 在多种肿瘤中表达降低,如肾细胞癌[15]、胃癌[16]、乳腺癌[17]和肺癌[18]等,揭示 E-cadherin 低表达与肿瘤的发生、分化、侵袭、转移和预后密切相关。因此,本研究在明确芒柄花黄素能够有效抑制卵巢癌细胞活力的基础上,进一步检测芒柄花黄素对SKOV-3 细胞迁移和侵袭能力的影响。结果显示,芒柄花黄素显著降低SKOV-3细胞的迁移和侵袭能力,且可导致E-cadherin表达显著增加。
除了肿瘤细胞间黏附丧失外,细胞外基质的降解也是肿瘤细胞侵袭转移过程的关键步骤之一。研究证实,MMPs 是细胞外基质降解的重要因子,能够促进肿瘤细胞转移,改变细胞间的黏附力和导致肿瘤新生血管形成[19]。MMP-9 作为 MMPs 家族中重要的成员,能够降解明胶和IV 型胶原,进而对细胞外基质进行降解,促进肿瘤细胞的侵袭和转移。已有研究证实,MMP-9 在透明细胞肾癌[20]、子宫内膜癌[21]、肺癌[22]、黑色素瘤[23]、结肠癌[24]和鼻咽癌[25]等多种肿瘤中高表达且与患者预后差相关,同时与肿瘤的侵袭和转移有着紧密的关系。研究显示,MMP-9的表达水平也与卵巢癌侵袭转移有关[1,26]。在本研究中,我们用芒柄花黄素作用于卵巢癌细胞后,观察到MMP-9 的表达显著下降,说明芒柄花黄素可能通过下调MMP-9来抑制卵巢癌细胞的迁移与侵袭。
综上所述,我们证明了芒柄花黄素呈剂量依赖性抑制卵巢癌SKOV-3细胞的活力、迁移和侵袭。此外,芒柄花黄素能够上调E-cadherin 和下调MMP-9 mRNA 及蛋白的表达水平,这可能是芒柄花黄素抑制卵巢癌细胞侵袭和转移能力的可能机制之一,但芒柄花黄素对卵巢癌细胞更具体的作用机制仍有待深入的研究。

