烟酸经LXRα/NPC1途径促进巨噬细胞溶酶体胆固醇外流*
杨 萍,张汉斌,刘钰林,方淑香,李 平,许小洋△
(广州医科大学 1第二临床学院,2基础医学院,广东广州511436)
在动脉粥样斑块的形成过程中,巨噬细胞对胆固醇摄取、代谢及排出这一稳态机制的破坏是导致其转化成泡沫细胞,进而促进动脉粥样斑块形成的关键环节[1-3]。现有的研究结果表明,在动脉粥样斑块的泡沫细胞中,过量胆固醇蓄积在溶酶体中[4-5],提示巨噬细胞溶酶体胆固醇的调节异常是导致泡沫细胞形成、进而促进动脉粥样硬化产生的关键环节。
溶酶体瞬时感受器电位黏脂蛋白1(transient re‑ceptor potential mucolipin 1,TRPML1)钙通道或尼曼-皮克C1 蛋白(Niemann-Pick C1 protein,NPC1)胆固醇转运体缺陷,可造成以溶酶体脂质蓄积为特征的溶酶体贮积症[6-7],与动脉粥样硬化斑块的病理特征非常相似。已有报道显示,烟酸腺嘌呤二核苷酸磷酸(nicotinic acid adenine dinucleotide phosphate,NAADP)可促进 Ca2+经 TRPML1 通道释放[8],提示NAADP 有可能通过抑制溶酶体胆固醇蓄积,进而抑制泡沫细胞的形成,但其详细的信号机制目前尚不甚明了,已有少数报道提示肝X 受体α(liver X re‑ceptor α,LXRα)可能在此机制中起一定作用[9-10]。
鉴于NAADP 及NPC1 在溶酶体中胆固醇转运中的重要作用,本研究从NAADP 合成底物——烟酸(nicotinic acid,NA)入手,观察其对巨噬细胞溶酶体胆固醇外流的影响,并对此过程中LXRα 和NPC1 所起的作用进行了探讨,以期为阐明巨噬细胞在动脉粥样硬化中的作用机制提供更多的实验支持。
材料和方法
1 材料
人单核-巨噬细胞株THP-1 购自江苏凯基生物技术股份有限公司;RPMI-1640 培养基和胎牛血清购 自 Gibco;LXRα小 干 扰 RNA(small interfering RNA,siRNA)、NPC1siRNA 及大鼠抗人β-actin 和溶酶体相关膜蛋白1(lysosomal-associated membrane protein 1,LAMP1)抗体购自Santa Cruz;siRNA 转染试剂盒购自SignaGen;烟酸购自Sigma;实时荧光定量PCR试剂盒购自Qiagen;Alexa Fluor 633标记的山羊抗大鼠IgG(H+L)购自Thermo Fisher;细胞培养玻片(8 室)购自Biologix;氧化型低密度脂蛋白(oxi‑dized low-density lipoprotein,oxLDL)购自广州瑞千公司;佛波酯(phorbol myristate acetate,PMA)购自Promega;filipin complex(filipin)、NAADP 拮 抗 剂trans-Ned-19(Ned-19)和 Ca2+螯合剂 BAPTA 购自Cayman;Nile red购自MCE;抗NPC1兔多抗购自Mil‑lipore;BeyoECL Plus(超敏ECL 化学发光试剂盒)和DMSO 购自碧云天;HRP 标记的羊抗兔IgG 购自SouthernBiotech。
2 方法
2.1 细胞培养 本研究所用细胞系为人单核-巨噬细胞株THP-1,经PMA 诱导成巨噬细胞后使用[11]:以1×109/L 的密度将THP-1 细胞置于装有10 mL RPMI-1640 培养基(含10%胎牛血清和2%双抗)的T25 培养瓶内,在37℃、5%CO2的细胞培养箱内培养。待细胞到达对数生长期时,以每孔6×105个接种于6 孔板中,加入PMA(终浓度100µg/L)诱导分化48 h备用。
2.2 Ned-19 及BAPTA 处理 在NA 影响溶酶体胆固醇外流的实验中,先加入Ned-19 或BAPTA,1 h 后加入NA,再过1 h 后加入oxLDL,48 h 后固定细胞,经破膜、LAMP1抗体标记、filipin和Nile red染色等处理以进行激光共聚焦显微镜观察。在NA 影响NPC1蛋白及LXRα mRNA表达的实验中,按上述时间依次加入Ned-19(或BAPTA)、NA 和oxLDL,24 h 后提取总 RNA 用于检测 LXRα 的 mRNA 表达,48 h 后提取蛋白用于检测NPC1的蛋白表达。
2.3 激光共聚焦技术检测巨噬细胞游离胆固醇及脂质蓄积 巨噬细胞游离胆固醇和中性脂质分别通过filipin 和Nile red 荧光染色剂染色;溶酶体采用溶酶体膜表面特征蛋白LAMP1 抗体免疫标记。将诱导分化好的巨噬细胞按每室5×104个接种于8室细胞培养玻片中,经不同处理后,按已报道的方法进行固定、破膜、LAMP1 抗体标记、filipin 染色[9,12],之后细胞用Nile red 孵育10 min,PBS洗1次后封片,用于激光共聚焦检测。激光共聚焦扫描拍照采用LSM 510多光子激光扫描显微镜(Carl Zeiss),不同通道图像采取依次扫描方式获取以防止干扰,整个过程所有参数均保持一致。Alexa Fluor 633、filipin 和Nile red荧光成像的激发/发射波长(λEx/λEm)分别为633 nm/650~710 nm、740 nm/435~485 nm 和 514 nm/535~590 nm。荧光强度采用Image-Pro 9.1软件(Media Cyber‑netics)定量,其中filipin 荧光强度代表游离胆固醇的量,Nile red 荧光强度代表中性脂质的量。同时分析filipin 与 LAMP1 之间的共定位系数(Pearson 相关系数),以判定溶酶体中游离胆固醇的量。
2.4 Western blot 检测NPC1 蛋白的表达 因NPC1蛋白分子量较大,故在进行蛋白表达检测时注意个别特殊条件,其余均参照已有报道中的方法[13],经标准的Western blot 程序完成。特殊条件为蛋白提取之后不过夜即电泳,随即以电压30 V于4℃环境转膜16 h;常温用抗NPC1抗体(浓度1∶500)孵育4 h。
2.5 RT-qPCR 检测 LXRα 的 mRNA 表达 提取总RNA 后,按已有报道中的方法进行逆转录和qPCR,检测 LXRα 的 mRNA 表达[12]。LXRα 的上游引物序列为5'-CAAGATGCAGGAGACCAGGG-3',下游引物序列为5'-GCTGACTCCAACCCTATCCC-3'。
2.6LXRα及NPC1的 RNA 干扰实验 采用 Gen‑Mute转染试剂盒,依照原报道中的方法[12]将LXRα及NPC1siRNA 转染巨噬细胞。RNA 干扰效应于转染24 h 后经 RT-qPCR 验证。在LXRαsiRNA 影响 NPC1蛋白表达的实验中,于转染scrambled siRNA 和LXRαsiRNA 后 24 h 加入 NA 和 oxLDL,48 h 后提取蛋白进行 Western blot。在LXRα及NPC1siRNA 影响NA 促溶酶体胆固醇外流效应的实验中,于转染siRNA 后 24 h 加入 NA 和 oxLDL,再经 48 h 后固定细胞,再经破膜、LAMP1 抗体标记、filipin 和 Nile red 染色等处理以进行激光共聚焦显微镜观察。
3 统计学处理
采用SigmaPlot 12.5 for Windows 进行数据统计分析。数据以均数±标准差(mean±SD)表示,多组间均数比较使用单因素方差分析。以P<0.05 为差异有统计学意义。
结 果
1 oxLDL 浓度依赖性地促进巨噬细胞溶酶体胆固醇蓄积
在细胞培养液中加入不同浓度的oxLDL 处理后,激光共聚焦结果显示巨噬细胞游离胆固醇(蓝色,filipin 染色)的蓄积逐渐增加,Image-Pro 图片分析结果显示蓝色强度明显增强(P<0.05),见图1A、B。采用LAMP1 标记溶酶体(红色),可见oxLDL 处理后叠加图片中的紫色(蓝+红→紫)部分增强,经Image-Pro 分析共定位系数表明,溶酶体内胆固醇的蓄积明显增加(P<0.05),见图1A、C。随着oxLDL 浓度的增加,巨噬细胞内脂滴(黄色)也明显增多(图1A、D)。
2 NA抑制巨噬细胞溶酶体胆固醇蓄积
若在巨噬细胞接受oxLDL 处理前加入不同浓度的NA,则可发现,随着NA 浓度的增加,巨噬细胞中游离胆固醇的蓄积明显减少(P<0.05),见图2A、B;共定位系数分析结果也显示,溶酶体中游离胆固醇的蓄积逐渐降低,在NA 浓度为1~10 mmol/L 时效果显著(P<0.05),见图2A、C。但NA 对巨噬细胞中脂滴的蓄积无明显影响(图2A)。
3 Ned-19 和BAPTA 抑制NA 减少溶酶体游离胆固醇蓄积的效应
在上一实验的基础上,加入NAADP 拮抗剂Ned-19或细胞内Ca2+螯合剂BAPTA,则NA 减少溶酶体游离胆固醇蓄积的效应被显著抑制(图3A~C),提示NA 的效应可能是通过NAADP 促进溶酶体TRPML1通道释放Ca2+所介导。但Ned-19及BAPTA对脂滴同样没有明显影响(图3A、D)。
4 NA促进NPC1表达
Western blot 结果显示,NA 可显著促进 NPC1 蛋白的表达,而Ned-19 和BAPTA 则可显著抑制NA 促NPC1 表达的效应(P<0.05),见图4。这提示NA 促溶酶体游离胆固醇外流的机制与其促进NPC1 蛋白表达有关。
5 NA促进LXRα的mRNA表达
RT-qPCR 结果显示,NA 可显著提高 LXRα 的mRNA 表达,但这种效应可被 Ned-19 和 BAPTA 明显抑制(P<0.05),见图5。这种效应与NA 促进NPC1蛋白表达的效应基本一致,提示LXRα 与NPC1 之间可能有一定的联系。
6 LXRα介导NA对NPC1表达的上调
为确定NA 促进NPC1 表达是否是经核受体LXRα 介导,我们利用LXRαsiRNA 敲减LXRα的表达,再观察NA对NPC1蛋白表达的影响。结果显示,LXRαsiRNA 可明显干扰LXRα mRNA 表达(图6A);LXRα被siRNA 干扰后,NA 促NPC1蛋白表达的效应被显著抑制(P<0.05),见图6B、C,提示LXRα 介导了NA对NPC1表达的上调。
7 敲减LXRα 和NPC1 表达明显减弱NA 促溶酶体胆固醇外流的效应
为进一步确认NA 促溶酶体胆固醇外流效应的机制,我们利用siRNA 分别敲减LXRα和NPC1表达,观察其对NA 减少巨噬细胞溶酶体胆固醇蓄积效应的影响。结果显示,敲减LXRα和NPC1表达后,NA减少巨噬细胞溶酶体胆固醇蓄积的效应被明显抑制(P<0.05),见图7。这进一步提示LXRα 和NPC1 在NA促进溶酶体胆固醇外流的效应中起重要作用。
讨 论

Figure 1.oxLDL dose-dependently increased lysosomal free cholesterol(FC)accumulation in macrophages.Macrophages were incu‑bated with oxLDL at different concentrations(20~80 mg/L)for 48 h and labelled with filipin(FC,blue),LAMP1 antibody(lysosomes,red)and Nile red(lipid droplets of cholesteryl ester,yellow).Purple spots in the merged images represented the FC sequestered in lysosomes.A:confocal microscopic images of filipin,LAMP1 and Nile red staining;B:fluores‑cence intensity of filipin staining for FC;C:colocalization coefficient between filipin and LAMP1;D:fluorescence intensi‑ty of Nile red staining for lipid droplets(cholesteryl ester).lm:lumen,the SI unit of luminous flux.Mean±SD. n=6.*P<0.05 vs 0 mg/L group.图1 oxLDL浓度依赖性地促进巨噬细胞溶酶体中胆固醇的蓄积
巨噬细胞可通过清道夫受体A 吞噬oxLDL 并将其移至溶酶体中,在溶酶体酸性脂肪酶的作用下,ox‑LDL 中的胆固醇酯被水解成游离胆固醇和脂肪酸[1,14]。游离胆固醇可经溶酶体NPC1蛋白主动转运至细胞质中[1],其中大部分被运送至细胞膜成为细胞膜的组成部分[15];另一部分被运送至内质网经酰基辅酶A:胆固醇酰基转移酶1(acyl-coenzyme A:cholesterol acyltransferase-1,ACAT-1)催化,与脂肪酸结合酯化成胆固醇酯而储存在胞质中;还有一部分则可通过ATP 结合盒转运体A1/G1(ATP-binding cassette transporter A1/G1,ABCA1/ABCG1)经胆固醇逆转运(reverse cholesterol transport,RCT)途径转运至细胞外[16-19]。若胆固醇和胆固醇酯在巨噬细胞内蓄积则可使其转化为泡沫细胞,这种现象是动脉粥样斑块产生的病理生理学基础[2,20]。
NA 是抗动脉粥样硬化的常用药物,其药理机制主要与其抗血脂作用有关[21]。近来发现其除了抗血脂作用外,还有其他不依赖脂质的抗粥样硬化效应,如降低血管内皮细胞中起招募单核细胞作用的黏附分子的表达、通过激活单核巨噬细胞的NA 受体——羟基羧酸受体2(hydroxycarboxylic acid receptor 2,HCA2)而抑制单核巨噬细胞向动脉斑块的聚集、促进ABCA1 和ABCG1 的表达以增加巨噬细胞中游离胆固醇向高密度脂蛋白的转移等[21-24],提示NA 的抗粥样硬化机制广泛。

Figure 2.NA dose-dependently inhibited the accumulation of lysosomal free cholesterol(FC)in the macrophages incubated with ox‑LDL(40 mg/L).A:confocal fluorescence images;B:fluorescence intensity of filipin staining for FC;C:colocalization coefficient between filipin and LAMP1(lysosome).Mean±SD. n=6. *P<0.05 vs oxLDL group;#P<0.05 vs control group.图2 NA浓度依赖性地抑制巨噬细胞溶酶体中胆固醇的蓄积
本研究发现,NA 呈浓度依赖性地降低巨噬细胞中溶酶体游离胆固醇的蓄积(即促进溶酶体游离胆固醇的外流),外流出溶酶体的游离胆固醇可经RCT途径转运至细胞外,从而产生抗动脉粥样硬化的作用。NA 的这种效应可能是其抗动脉粥样硬化的另外一条重要途径。虽然对其促进巨噬细胞溶酶体游离胆固醇外流的机制尚不清楚,但有必要对其进行深入探讨。
溶酶体膜上存在非特异性TRPML1 Ca2+通道[11]和 NPC1 胆固醇转运体[25]。经溶酶体 TRPML1 通道的Ca2+释放与溶酶体胆固醇转运关系密切[26]。TRPML1突变(引起溶酶体Ca2+释放减少)或NPC1缺陷将导致两类溶酶体贮积症[6-7,27],分别为 IV 型黏脂贮积症(mucolipidosis type IV)[28]和 C1 型尼曼-皮克病(Niemann-Pick disease type C1)[29],二者均与动脉粥样斑块的病理特征非常相似,其本质均为溶酶体脂质转运功能紊乱。
已有报道表明,NAADP 可促进Ca2+经TRPML1通道释放[8],提示其可能参与溶酶体胆固醇的调节。本研究中NA 作为NAADP 生成的底物(由ADP 核糖基环化酶CD38催化NADP+与NA 反应产生),其减少巨噬细胞中游离胆固醇蓄积的效应可能与NAADP促TRPML1释放Ca2+的作用密切相关,而后者也可能通过某种途径参与了NPC1功能的调节,影响巨噬细胞溶酶体胆固醇代谢。
为此,本研究观察了NAADP 拮抗剂Ned-19 及Ca2+螯合剂BAPTA 对NA 促溶酶体游离胆固醇外流效应的影响。结果表明二者均可显著抑制NA 的上述效应,提示NA 的效应可能是通过增加NAADP 合成,进而促进溶酶体TRPML1 通道释放Ca2+所导致。这与我们原来的报道相一致,即NAADP 合成酶CD38基因敲除的小鼠,经高脂饮食后冠状动脉出现明显的粥样斑块,且该部位巨噬细胞溶酶体中胆固醇的蓄积明显升高[12]。
如前所述,溶酶体膜上的NPC1胆固醇转运体与其胆固醇调节密切相关,NA 促进TRPML1 释放的Ca2+可能通过某种机制影响NPC1的表达而促进溶酶体中游离胆固醇的外流。因此,我们进一步观察了NA、NAADP 拮抗剂 Ned-19 及 Ca2+螯合剂 BAPTA 对NPC1蛋白表达的影响,发现NA可显著促进NPC1蛋白表达,此效应可被Ned-19 和BAPTA 所抑制,提示NA 的效应与其通过NAADP 促进TRPML1 通道释放Ca2+,进而上调NPC1蛋白表达有关。
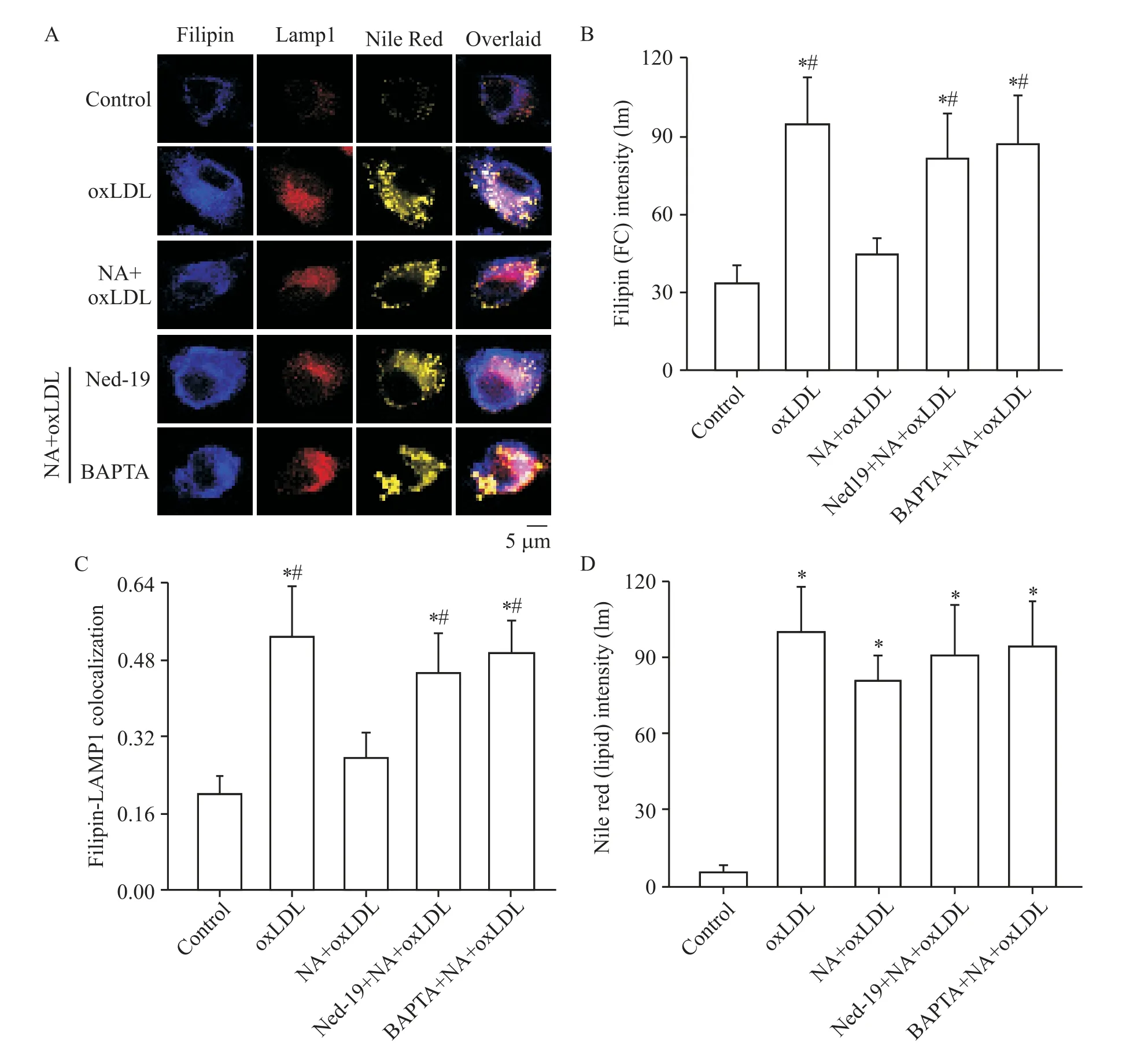
Figure 3.NAADP antagonist Ned-19 and calcium chelator BAPTA attenuated the effect of NA on lysosomal free cholesterol(FC)ac‑cumulation.Macrophages were incubated with oxLDL at 40 mg/L in the presence of NA(5 mmol/L)combined with Ned-19(100 µmol/L)or BAPTA(5 µmol/L)for 48 h and labelled with filipin(FC,blue),LAMP1 antibody(lysosomes,red)and Nile red(lipid droplets of cholesteryl ester,yellow).A:confocal microscopic images of filipin,LAMP1 and Nile red staining;B:fluorescence intensity of filipin staining for FC;C:colocalization coefficient between filipin and LAMP1;D:fluorescence intensity of Nile red staining for lipid droplets(cholesteryl ester).Mean±SD. n=6.*P<0.05 vs control group;#P<0.05 vs NA+oxLDL group.图3 NAADP拮抗剂Ned-19和钙离子螯合剂BAPTA抑制NA对溶酶体胆固醇蓄积的效应
而经TRPML1 通道释放的Ca2+通过何种途径促进NPC1蛋白表达,目前尚不清楚。曾有报道显示核受体 LXRα 是 NPC1 表达上调的重要信号因子[30]。为此,本研究继续观察了NA、Ned-19 及BAPTA 对LXRα mRNA 表达的影响。结果显示,NA 可显著提高 LXRα 的 mRNA 表达,这一效应亦可被 Ned-19 和BAPTA显著抑制;而当敲减LXRα基因表达后,NA促NPC1 蛋白表达的效应被显著抑制。这部分结果与已有的报道和我们近期发表的结果相一致[9-10,30],提示NA促NPC1表达的效应由LXRα介导。
为进一步确认LXRα 和NPC1 在巨噬细胞溶酶体胆固醇外流中的作用,本研究利用RNA 干扰技术分别敲减LXRα和NPC1的表达,结果显示 NA 减少巨噬细胞溶酶体胆固醇蓄积的效应被明显抑制。这进一步证实LXRα 和NPC1 在NA 促进溶酶体胆固醇外流的效应中起关键作用。

Figure 4.NA promoted NPC1 protein expression in oxLDL-loaded macrophages.Mean±SD. n=3.*P<0.05 vs control group.图4 NA促进oxLDL处理的巨噬细胞中NPC1蛋白的表达

Figure 5.NA promoted mRNA expression of LXRα in oxLDL-loaded macrophages.Mean±SD. n=3.*P<0.05 vs control group.图5 NA 促进oxLDL 处理的巨噬细胞中LXRα mRNA 的表达
由于本实验的研究对象是基于人单核细胞白血病细胞诱导的巨噬细胞,虽然相对于动物原代培养细胞而言更接近于人类本身,但所有研究工作均是在细胞水平开展的,因此,今后如能结合人类的临床标本或临床数据,则可取得更具影响力的数据。此外,本研究结果显示,NA 对巨噬细胞中的脂滴无明显影响,其中机制还有待阐明。

Figure 6 The effect of NA on NPC1 protein expression was abolished by LXRα siRNA in oxLDL-loaded macro‑phages.The macrophages were transfected with 20µmol/L scrambled siRNA or LXRα siRNA,and 24 h after transfection,they were incubated with 40 mg/L of oxLDL in the presence of 5 mmol/L NA for 48 h.A:the mRNA expression of LXRα 24 h after transfec‑tion was detected by RT-qPCR to evaluate the inter‑ference efficiency of LXRα siRNA;B:the protein level of NPC1 after NA+oxLDL treatment for 48 h was determined by Western blot.Mean±SD. n=3.*P<0.05 vs scrambled siRNA.图6 LXRα siRNA消除NA对NPC1表达的作用
综上所述,NA 可显著促进溶酶体胆固醇外流,这可能是NA 抗动脉粥样硬化的另外一条重要途径,其机制可能是:NA 增加NAADP 的生成,进而促进TRPML1 通道 Ca2+的释放,后者以核受体 LXRα 为介导,上调NPC1 蛋白表达,最终促进溶酶体胆固醇外流。至于Ca2+以LXRα 为介导上调NPC1 蛋白表达的详细机制,仍有待后续进一步研究。

Figure 7.The effect of NA on lysosomal free cholesterol(FC)accumulation was abolished by LXRα siRNA(siLXRα)and NPC1 siRNA(siNPC1)in oxLDL-loaded macrophages.A:confocal microscopic images of filipin,LAMP1 and Nile red staining;B:fluorescence intensity of filipin staining for FC;C:colocalization coefficient between filipin and LAMP1.Scr:Scram‑bled siRNA.Mean±SD. n=8.*P<0.05 vs control group;#P<0.05 vs NA+oxLDL group or Scr+NA+oxLDL group.图7 LXRα siRNA和NPC1 siRNA抑制NA促溶酶体游离胆固醇外流的效应

