坎地沙坦与卡托普利对1型糖尿病小鼠主动脉活性氧水平的影响
刘 畅,张正浩,许世清
(中日友好医院 临床医学研究所,北京 100029)
糖尿病(diabetes mellitus,DM)大血管病变的基础是动脉粥样硬化,其发生机制目前国内外的共识认为,主要包括内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS) 解偶联所引起的血管内一氧化氮(nitric oxide,NO)减少和超氧化物的含量增多而继发血管内皮功能障碍[1,2]。目前,临床上广泛应用的DM 降压药物包括血管紧张素转化酶抑制剂(angiotension-converting enzyme inhibitor,ACEI) 或血管紧张素受体拮抗剂(angiotension Ⅱreceptor antagonist,ARB)。关于卡托普利与坎地沙坦是否能够减轻DM 大血管氧化应激水平,以及对eNOS 功能障碍的影响国内外尚未见相关深入报道。本研究旨在评估卡托普利与坎地沙坦对链脲佐菌素(streptozotocin,STZ)诱导的Ⅰ型DM 小鼠主动脉氧化应激水平以及eNOS 解偶联的影响。
1 材料与方法
1.1 实验动物
雄性C57BL/6J 小鼠,5~6 周龄 (北京华阜康生物科技股份有限公司),实验动物饲养于中日友好医院临床医学研究所医学实验动物平台,室温保持在25±1 ℃,湿度保持在55%±5%。动物自由摄食,自由饮水,保持规律的12h 昼夜循环。开始实验前,动物正常饮食饮水,适应性饲养1 周。
1.2 试剂与仪器
One-Touch I 稳豪倍易血糖仪及试纸美国(Johnson & Johnson),超氧化物阴离子荧光探针DHE(Sigma,美国),L-NAME(Cayman,美国),坎地沙坦(上海源叶生物),卡托普利(Sigma,美国),Krebs-Henseleit(K-H)溶液(mmol/L):NaCl 119,NaHCO325,MgCl21.19,KCl 4.7,KH2PO41.2,Ca-Cl2 2.5,D-Glucose 11.1。激光共聚焦扫描显微镜(Nikon,日本)。
1.3 标本取材
小鼠灌胃给药3d 后,戊巴比妥麻醉,注入4℃预冷的生理盐水反复灌洗主动脉,取主动脉,在显微镜下小心去除周围脂肪组织,截取3mm 的血管环,OCT 包埋剂包埋后用冰冻切片机切片,切片厚度10μm。
1.4 实验设计与分组
健康小鼠30 只,随机分成正常对照组(NC)和模型组。NC 组4 只,模型组26 只。小鼠禁食12h,但随意饮水,然后以100ml/kg 的剂量连续3d向小鼠腹膜内注射STZ 溶液(浓度12mg/ml)[3]。注射时将STZ 粉末溶于pH 4.5 的冰冷的0.1mol/L柠檬酸盐缓冲液中,避光冰上配置。注射STZ 后72h,血糖可稳定升高,以随机血糖≥16.7mmol/L作为1 型DM 建模成功的标准。成模小鼠共26只,随机分为3 组。DM 对照组(DM):每天用生理盐水灌胃1 次; 坎地沙坦干预组 (DM+CAD):100mg/kg/d 药物灌胃3d;卡托普利干预组(DM+CAP):100mg/kg/d 药物灌胃3d。小鼠分笼饲养,自由饮水,普通饲料喂养。
1.5 血糖测定
测定血糖时进行尾静脉取血,滴在血糖试纸上,利用血糖仪测定血糖水平。
1.6 超氧化物阴离子荧光探针(dihydroethidium,DHE)法检测O2-水平
将冰冻切片于室温下晾干,用PBS 冲洗切片5min 后甩干液体。一部分切片加入eNOS 抑制剂(nitro -L -arginine methyl ester,L -NAME)7μm 37℃条件下在避光预孵育30min,预孵育结束后将所有切片加入DHE (2μm),37℃条件下避光孵育30min,用蒸馏水冲洗切片1min,重复3 次。在激光共聚焦显微镜下观察荧光,每个标本选取3个高倍视野 (×400),相对荧光强度反映反应性ROS 水平,相对荧光强度为处理组平均荧光强度相对未处理组的比值,平均荧光强度为同组多个荧光强度的均数。正常组和DM 组的处理和成像使用相同参数平行进行,应用Imagine J 软件进行图像分析。
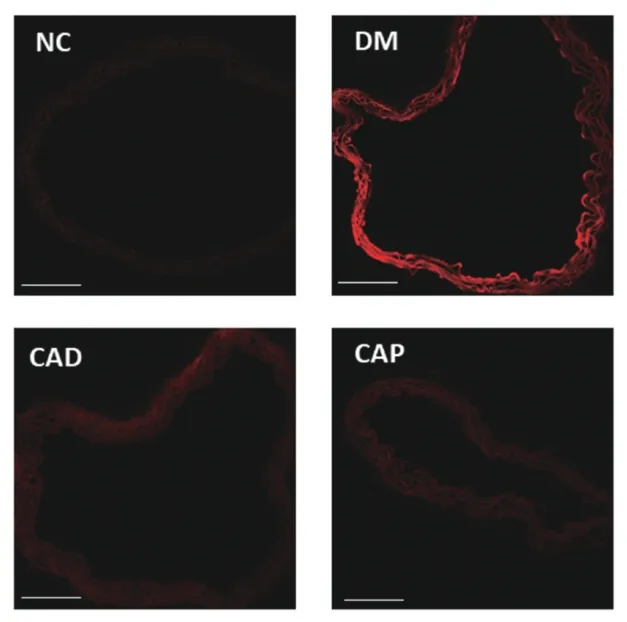
图1 正常对照组与模型组小鼠主动脉超氧阴离子()水平

图2 加入L-NAME后各组别小鼠主动脉超氧阴离子()水平
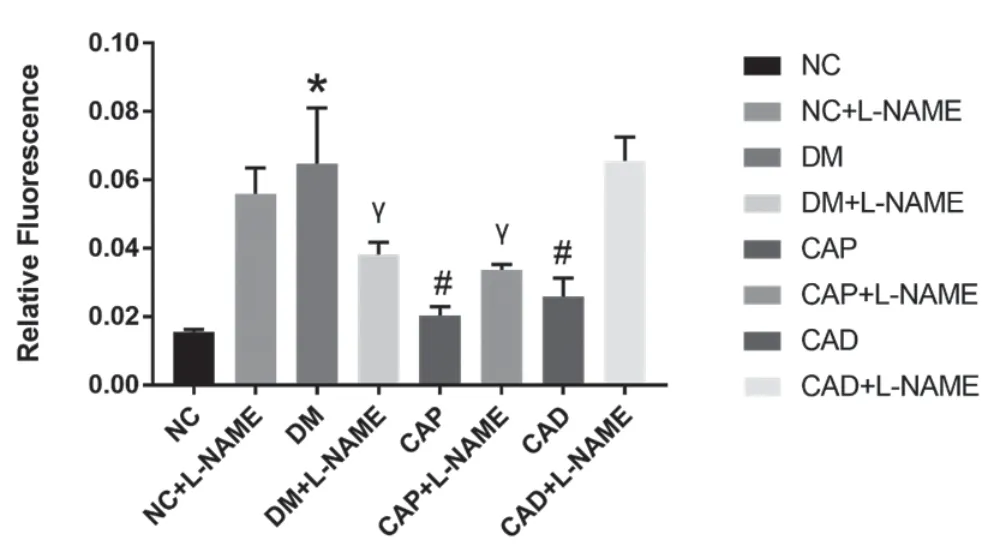
图3 不同组别主动脉相对荧光强度的变化
1.7 统计学方法
2 结果
2.1 实验动物一般情况
正常组小鼠精神状况良好、反应灵敏、毛色光亮、进食水及尿量正常,体重稳定增长;DM 造模组小鼠则出现精神萎靡、反应迟钝、多饮、多食、多尿及体重下降等典型特征。实验结束时造模组小鼠体重略低于对照组,但实验前后动物体重在四组间均无显著差异。
2.2 注射STZ 后小鼠血糖的变化
NC 组 小鼠血 糖正 常;DM 组、DM+CAD 组、DM+CAP 组血糖明显升高 (>16.7mmol/L)。造模前,NC 组与模型组血糖均正常,差异无统计学意义。注射STZ 72h 后,与NC 组相比,模型组小鼠血糖明显升高,差异有统计学意义(9.53±0.67 vs 22.16±1.41,P<0.01)。
2.3 超氧阴离子(O2-)水平
各组小鼠主动脉中O2-检测结果显示,模型组的DHE 荧光信号显著高于对照组 (图1,见封二),证实STZ 诱导的1 型DM 小鼠主动脉内活性氧(reactive oxygen species,ROS)含量增加,氧化应激水平明显增高(P<0.05,图3)。而CAD 组、CAP 组小鼠主动脉中ROS 生成量明显减少,主动脉红色荧光强度明显减弱(图1,见封二)。对MFI的分析结果显示,与DM 组比较,DM+CAD 组、DM+CAP 组小鼠主动脉组织中ROS 生成量均明显减少(均P<0.05,图3)。给予eNOS 阻断剂LNAME 孵育后,与未孵育相比,NC 组小鼠荧光强度增高(图2,见封二),分析结果有统计学意义(P<0.05,图3),DM 组小鼠荧光强度减弱(图2,见封二),分析结果有统计学意义(P<0.05),而DM+CAD 组和DM+CAP 组荧光强度增高(图2,见封二),可逆转这一表型(P<0.05,图3)。
3 讨论
据估计,到2035年,2013年全球3.82 亿人的DM 患病率将升至5.92 亿[4]。DM 并发症以慢性病较为常见,表现为大血管病变、 微血管器官病变等。大血管并发症包括心血管疾病,比如冠心病、中风以及外周血管疾病。据相关报道,DM 患者中超过75%的死亡是由心血管疾病引起的[5]。因此,抑制和减轻大血管并发症已成为DM 治疗中的主要挑战。长期的高血糖状态引起多系统代谢紊乱,导致大血管及微血管的病变,严重威胁患者身体健康。一氧化氮合酶与DM 主动脉损伤有着密切联系。NOS 包括3 种亚型,神经元型(nNOS),诱导型(iNOS),和内皮型(eNOS)[6]。eNOS 在血管内皮细胞中组成型表达,在正常生理状态下产生的NO 能够起到扩张血管的作用。在DM 条件下,eNOS 功能障碍解离为单体,不能产生NO 而是产生大量O2-,O2-与NO 结合生成大量ONOO-,对血管内皮细胞进而产生细胞毒作用[7]。现普遍认为,在DM 早期阶段,高血糖状态诱导肾小球高滤过和尿钠排泄,激活了Ang Ⅱ的合成作为代偿机制维持正常血压[8],由于DM 时血浆及组织中AngⅡ浓度升高,Ang Ⅱ通过与血管紧张素Ⅰ型受体(AT1-R)结合,激活NAD(P)H 氧化酶,促进ROS的产生,进而促进氧化应激和炎症反应,损伤内皮功能,引起血管慢性炎症、纤维化、凋亡以及动脉硬化等病理改变,而ROS 水平升高又是造成eNOS 脱偶联的主要原因[9]。激活的RAS 通过改变血流动力学,促进主动脉平滑肌细胞增生,加重炎症反应和氧化应激等多种机制,进而诱发动脉粥样硬化。抑制RAS 的药物作为常用降压药在临床上广泛使用,Ang Ⅱ拮抗剂包括ACEI 和ARB 类药物。肾素作为激活的激素释放,控制肾脏,钠和体内稳态。肾上腺肾小球细胞响应各种刺激(包括降低的肾脏灌注压力,交感神经激活和减少的黄斑部小管钠传递)而产生肾上腺素。该酶级联反应从循环的(主要是肝脏的)血管紧张素原开始产生相对无活性的十肽血管紧张素Ⅰ(Ang Ⅰ),然后非特异性酶血管紧张素转换酶(ACE)从AngⅠ转变为Ang Ⅱ。除了产生Ang Ⅱ,ACE 分别催化缓激肽的降解[10]。因此,用ACE 抑制剂(ACEI)药物进行的治疗会导致缓激肽积聚并抑制Ang Ⅱ[11]。卡托普利是人工合成的非肽类血管紧张素转化酶抑制剂,通过作用于肾素-血管紧张素-醛固酮系统,同时其分子基团上的巯基还能够有效地保护血管内皮细胞,在降低心血管死亡率方面发挥了重要的作用。坎地沙坦是选择性血管紧张素受体拮抗剂,是继ACEI 后又一类作用于RAS 的降压药物,其阻断RAS,抑制了Ang Ⅱ诱导的氧化应激,具有更加长效、平稳等特点。Ang Ⅱ激活两种类型的血管紧张素Ⅱ受体即ATR Ⅰ和ATR Ⅱ。ATR Ⅰ受体在血管,脑,心脏,肾脏,肾上腺和神经中含量丰富,而ATR Ⅱ在胎儿中显著表达,但在产后期间数量减少。ATR Ⅰ的激活会增加三磷酸肌醇和各种花生四烯酸代谢产物,并降低环状单磷酸腺苷。这会导致血管平滑肌收缩引起的全身血管收缩,醛固酮增加,导致近端小管对钠的重吸收增加。血管紧张素Ⅱ还促进儿茶酚胺从肾上腺髓质和神经末梢的释放,引起交感神经系统亢进。因此,拮抗ATRⅠ会导致心脏后负荷和预负荷的降低,ARB 的抗高血压特性主要归因于周围血管阻力的降低[10]。
目前检测超氧阴离子的方法包括化学发光法、 荧光分析法、 酶学分析法以及电子顺磁共振(EPR)。DHE 可自由透过活细胞膜进入细胞内,并被细胞内的ROS 氧化,形成氧化乙啶,氧化乙啶可掺入染色体DNA 中,产生红色荧光。根据活细胞中红色荧光的产生,可以判断细胞ROS 含量的多少和变化。DHE 在荧光分析法中具有特异性强,保存时间相对较长的优点。
在这项研究中,我们建立了STZ 诱导的1型DM 小鼠模型,研究了坎地沙坦与卡托普利这2种药物对小鼠主动脉的氧化应激水平及eNOS 功能障碍的影响。通过测量有或没有与L-NAME 一起孵育的DHE 的荧光水平来评估主动脉切片中eNOS 的解偶联。结果显示,1 型DM 成模小鼠主动脉出现氧化应激,给予Ang Ⅱ拮抗剂坎地沙坦和卡托普利药物干预后,显著降低了eNOS 衍生的超氧化物产生,氧化应激水平明显下降。LNAME 孵育后,正常对照组小鼠的主动脉荧光水平增高,表明NO 与超氧阴离子相互作用的有效性降低。DM 组小鼠的主动脉氧化应激水平降低,这表明eNOS 解偶联是DM 小鼠主动脉内皮中ROS 的来源。给予AngⅡ拮抗剂坎地沙坦和卡托普利药物干预后,可逆转这一表型。
本研究结果提示,Ang Ⅱ作用于eNOS 解偶联可能揭示了血管疾病中eNOS 功能障碍的常见机制。坎地沙坦和卡托普利通过改善eNOS 功能可能对于1 型DM 大血管病变的发生发展有一定延缓作用,能够显著降低主动脉氧化应激水平,对大血管并发症有一定的预防作用。

