腐竹副产物豆渣固态发酵生产益生菌工艺优化
陈炳钿 况应谷 王芳婷 时祥柱*
(1.福建省农业科学院畜牧兽医研究所,福建福州350007;2.福建省新闽科生物科技开发有限公司,福建福州350007)
我国是豆制品消费大国,每年生产各类豆制品如腐竹、豆浆等所产生的副产物——豆渣数量十分庞大,但由于豆渣口感粗糙,含有抗营养因子,且水分含量高而不利于保存与运输,大部分豆渣作为废物被弃入环境造成污染,仅少量作为饲料原料回收利用,造成很大的蛋白质资源浪费[1-2]。研究表明,豆渣仍然含有比较丰富的营养物质,如粗纤维含量达50%以上,蛋白质含量在10%~20%,说明豆渣可以作为很好的膳食纤维和蛋白质来源,利用价值比较高[3-5]。近些年来研究发现,通过微生物发酵可以使豆渣的很多性能得到改善。在饲料工业中,发酵后的豆渣不仅风味口感得到改善、还能降低抗营养因子,延长保质期,减少资源浪费及环境污染等,从而极大提高了其综合利用价值[6-10]。如李晓辉等[11]用豆渣来生产纳豆芽孢杆菌,可作为饲料添加剂改善动物肠道健康。熊俐等[4]使用绿色木霉进行豆渣固态发酵,极大提高了水溶性膳食纤维的含量,提升了豆渣的利用价值。这些研究主要是以提高蛋白质含量为目标,即利用豆渣生产菌体蛋白,从蛋白质资源的角度提高豆渣的使用价值,但从豆渣基质生产活性益生菌的研究则非常少。
枯草芽孢杆菌是广泛应用在饲料中的一种微生态制剂,可明显提高畜禽尤其是幼龄动物的整体健康水平和生长性能,改善养殖场气味,降低粪污氨氮含量[11-14]。本研究以腐竹生产过程的副产物——新鲜豆渣为主要培养基组分,这种新鲜豆渣水分含量高达83%,加入一定含量的麸皮,麸皮可以使发酵物料蓬松,降低物料水分,并能提供部分氮源,利用课题组前期筛选的枯草芽孢杆菌芽孢数作为发酵菌种,通过L9(34)正交实验对豆渣原料进行固态发酵,以期获得富含高活性益生菌的发酵饲料。
1 材料与方法
1.1 材料
1.1.1 实验材料
豆渣(腐竹加工副产物)为九龙湖生物科技有限公司提供;麸皮购买于市场。
1.1.2 供试菌株
枯草芽孢杆菌为课题组筛选鉴定并经过工艺优化的高产蛋白酶菌株(编号MK-B108)。
1.2 方法
1.2.1 发酵液制备
枯草芽孢杆菌保存培养基为牛肉膏蛋白胨琼脂培养基,液体种子培养基为:葡萄糖2%、豆粕1.5%、牛肉膏0.3%、氯化钠0.5%,pH值7.0。32 ℃恒温培养约16~20 h,将种子液以5%的比例接种至发酵培养基,37 ℃、200 r/min 培养48 h,获得发酵菌液。最终发酵液菌数约为5×109cfu/ml。
1.2.2 腐竹豆渣组分分析
粗蛋白质含量测定:参考中华人民共和国食品安全国家标准[15](GB 5009.5-2010)测定蛋白质;
灰分的测定:参考中华人民共和国食品安全国家标准[16](GB 5009.4—2016)测定灰分;
脂肪的测定:参考中华人民共和国食品安全国家标准[17](GB 5009.6—2016)测定脂肪。
1.2.3 豆渣发酵工艺
基础物料配制与接种:将新鲜豆渣(含水83%)与麸皮按一定比例混合后,加入1%氯化钠,接种枯草芽孢杆菌发酵液,然后置于恒温恒湿生化培养箱培养24 h,湿度保持85%。
1.2.4 豆渣发酵pH值的确定
通过单因素考察实验确定以豆渣/麸皮为培养基进行固态发酵时的最适pH值,将豆渣∶麸皮按9∶1的比例混合,接种发酵液10%,用磷酸盐缓冲液(2 mol/l)调节到不同的pH 值,在温度32 ℃、湿度85%条件下进行发酵培养,3 d后取样测定芽孢数,样品干燥至恒重后测定小分子蛋白含量。
1.2.5 正交实验设计
正交实验考察4 个主要因素:A 豆渣/麸皮比例(%)、B接种量(ml)、C发酵温度(℃)、D发酵时间(d),每个因素设3 个水平,以发酵后芽孢数为指标,进行L9(34)正交实验,各因素水平见表1。

表1 正交实验因素和水平
1.2.6 发酵豆渣组分测定
1.2.6.1 芽孢计数
采用平板活菌计数法,准确称取1 g 发酵后的豆渣样品,按10 倍稀释成不同浓度的稀释液,从3 个合适的稀释液中分别吸取100 μl 置于营养琼脂培养皿中,每个稀释度做2~3 个平行。37 ℃倒置培养24 h,进行菌落计数。
1.2.6.2 小分子蛋白含量的测定
取1 g 发酵豆渣溶于50 ml 蒸馏水中,调pH 值至4.5 后进行沉淀,4 000 r/min 离心10 min,取上清液,用Folin-酚法测定蛋白含量。
1.2.6.3 胰蛋白酶抑制因子活性分析
胰蛋白酶抑制因子活性的测定参照卢晓凌等[18]方法进行。
2 结果与讨论
2.1 豆渣成分测定
新鲜豆渣为半固体白色松散状微粒,含水83%,经测定,湿态豆渣粗脂肪为1.8%,粗灰分为2.6%,粗蛋白质为3.35%,其中小分子蛋白占比为5.8%,换算成干基物料后,豆渣各组分含量如表2所示。

表2 实验用豆渣主要成分(干基,%)
2.2 固态发酵pH值的确定
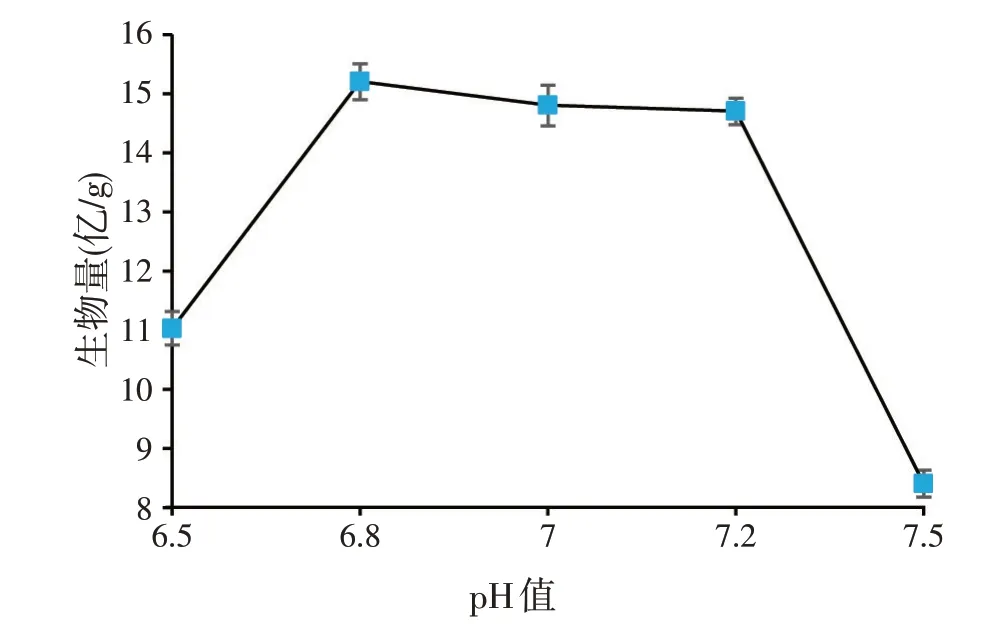
图1 发酵pH值差异对枯草芽孢杆菌生长的影响
实验室所用的枯草芽孢杆菌为高产蛋白酶菌株,该菌种液态发酵时最适生长pH 值为7.0,为了确定以豆渣/麸皮为培养基进行固态发酵时的最适pH 值,进行了单因素考察实验,结果如图1、图2 所示。由图1 可知,以豆渣、麸皮为固态发酵培养基进行发酵时,pH 值对枯草芽孢杆菌的生长影响很大,尤其是pH 值超过7.2 后,菌体生长明显减缓。与此同时,小分子蛋白含量变化趋势跟芽孢发酵结果相同(见图2)。该实验确定了发酵最适pH 值为6.8,在接下来的正交实验中,发酵酸碱度统一调到pH 值6.8 进行。
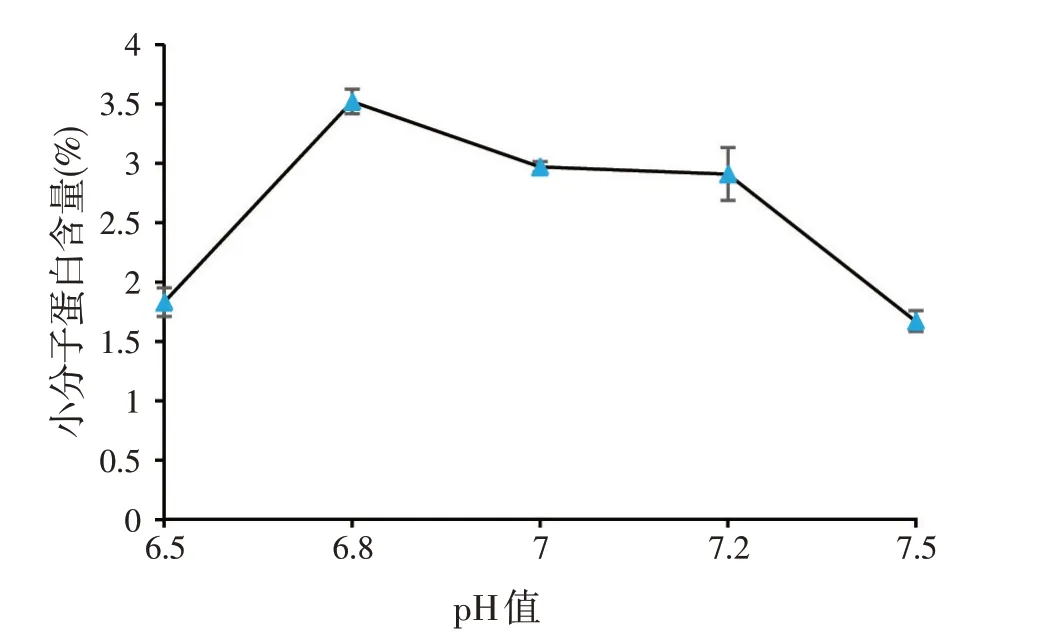
图2 发酵pH值差异对小分子蛋白含量的影响
2.3 正交实验结果
设计了L9(43)正交实验对豆渣/麸皮比例、接种量、发酵温度、发酵时间4 个参数进行考察,结果如表3所示。对正交实验结果进行均值分析,饲料中活菌数量的影响排列顺序为:A2>A3>A1,B3>B2>B1,C2>C1>C3,D2>D1>D3。由极差可以看出,4种因素对饲料中活菌数量的影响由大到小的顺序是:接种量>发酵时间>豆渣/麸皮比例>发酵温度。因此确定最佳条件组合为:A2B3C2D2,即新鲜豆渣固态发酵时与辅助培养基组分麸皮的最佳复配比例为8∶2,最适发酵温度为35 ℃,最适pH 值为6.8,芽孢杆菌发酵液最佳接种量为15%,发酵时间为3 d。
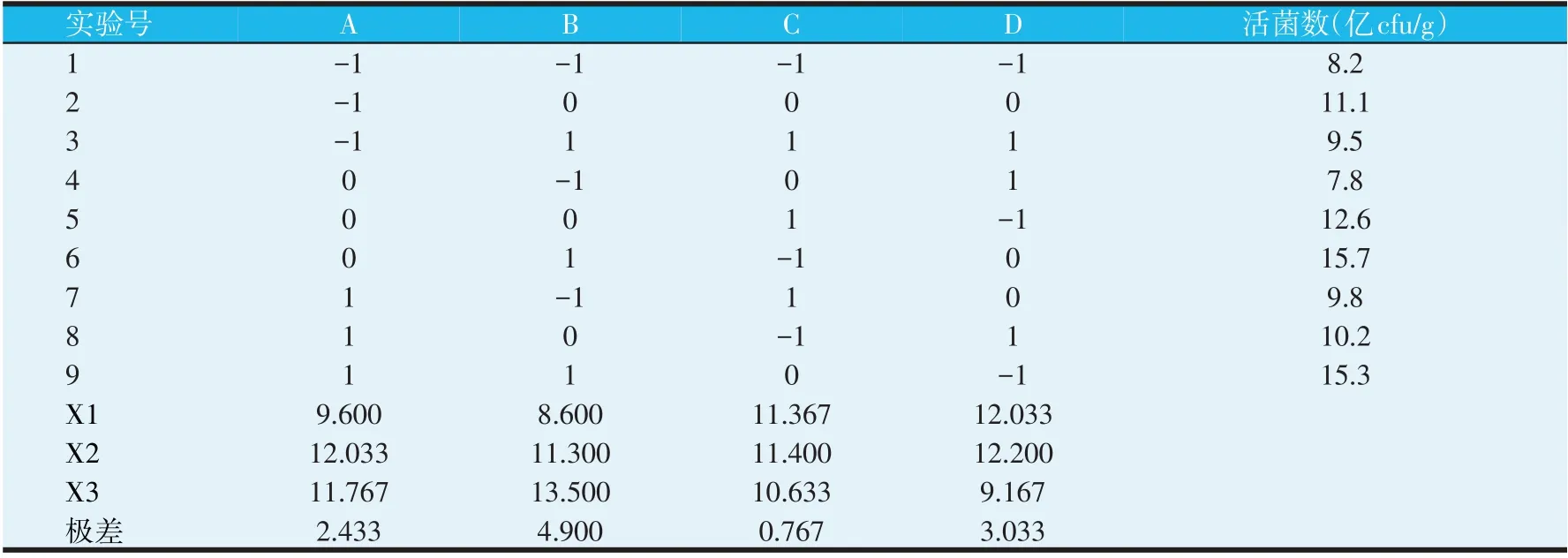
表3 正交实验结果
2.4 最适发酵条件下豆渣发酵前后对比
在上述最适条件下经过3 d 恒温恒湿发酵后,湿态豆渣培养基含枯草芽孢杆菌活性芽孢数达2.77×109cfu/g,豆渣发酵前后粗蛋白质、小分子蛋白质、胰蛋白酶抑制因子活性变化如表4 所示。枯草芽孢杆菌发酵过程中分泌的蛋白酶能够有效水解大豆蛋白,发酵产物中小分子蛋白质含量高达9.7%,大豆中的抗营养因子胰蛋白酶抑制剂活性大幅降低。经干燥处理后,活性芽孢数为1.25×1010cfu/g,发酵后的豆渣已由低值饲料原料转化为高价值的活性益生菌生物发酵饲料。跟原始的豆渣相比,发酵后的豆渣利用价值大大提高,在饲料中只需极少的添加量,就可以达到改善动物肠道健康,提高动物生长性能的目的。

表4 豆渣发酵前后各组分变化(干基)
豆渣单纯作为饲料原料,其营养价值极为低廉,而且新鲜豆渣极易腐败变质,干燥可以延长使用时间,但干燥成本远高于利用价值[19]。豆渣中含丰富的蛋白质,同时也存在多种抗营养因子,例如胰蛋白酶抑制因子、植酸等典型代表。它们的存在对生物体内某些消化酶起抑制作用,与营养物质络合成不易消化的成分,使得豆渣的消化率和动物的利用率下降[20-23]。很多学者利用微生物发酵的方法,本质上改变了豆渣的原料属性,何晓哲[24]使用黑曲霉与绿色木霉组合液态发酵豆渣,将可溶性膳食纤维(Soluble Dietary Fiber,SDF)含量提高了4.46倍,蛋白质含量也获得大幅提高;潘天玲等[25]使用真菌微生物组合,包括黑曲霉、绿色木霉、啤酒酵母、产朊假丝酵母,复配麸皮进行固态发酵以生产菌体蛋白,发酵后豆渣粗蛋白含量也提高到了28%以上;管瑛等[26]使用米根霉和少孢根霉组合对豆渣进行固态发酵,测定发酵过程中还原糖含量、可溶性蛋白含量、纤维素酶活力等,证明用米根霉和少孢根霉发酵豆渣可以提高豆渣的营养成分及抗氧化活性。这些研究主要是以提高蛋白质含量为目标,即利用豆渣生产菌体蛋白,从蛋白质资源的角度提高豆渣的使用价值,但从豆渣基质生产活性益生菌的研究则非常少。本研究以获取高活力益生菌芽孢为出发点,发酵后的豆渣不仅营养结构得到改善,还能够起到改善动物肠道健康,提高动物生长性能的作用。
3 结论
本研究以新鲜豆渣为研究对象,通过复配疏散性发酵基质麸皮,接种枯草芽孢杆菌进行益生菌的生产,经研究,最佳复配比例为豆渣∶麸皮为8∶2,枯草芽孢杆菌发酵液接种量为15%,发酵温度为35 ℃,发酵初始pH 值为6.8,发酵时间为3 d。发酵后的豆渣含活性芽孢数为1.25×1010cfu/g,小分子蛋白质含量为9.7%,同时豆渣中的胰蛋白酶抑制因子极显著降低。本研究选用了优化的枯草芽孢杆菌,该菌株产蛋白酶能力强,应用在畜禽日粮中,不仅可以调节动物胃肠道菌群平衡,还可以通过产生复合蛋白酶系,提高原料蛋白的消化和利用率。本研究将低值的腐竹副产物——豆渣转化为高附加值的功能性益生菌产品,实现了资源的循环利用。

