中晚期NSCLC患者3种不同组织中DNA修复基因XRCC3多态性检测结果比较
许超,邱黎霞,张漫,罗雪平,李荆,郭满盈(中国人民解放军陆军第72集团军医院检验病理科,浙江湖州 313000)
DNA修复基因——X线修复交叉互补基因3(XRCC3)是单链断裂修复系统的主要调节基因;研究表明,在含铂类化疗方案治疗的肺癌、结直肠癌、胃癌、宫颈癌等肿瘤患者的病灶组织中XRCC3能够修复DNA损伤,诱发铂类耐药[1],故而检测XRCC3基因多态性对NSCLC患者化疗方案的选择具有重要的临床应用价值。肿瘤组织进行DNA分析是目前检测XRCC3基因多态性最可靠的方法,但存在标本不易获取的缺点,限制了其在临床上的广泛应用[2]。另有学者通过检测外周血标本分析XRCC3基因多态性,但外周血DNA获取主要源于白细胞,而非肿瘤细胞,影响了其检测的准确性[3]。循环肿瘤细胞(CTC)是肿瘤迁移和侵袭的主要机制;肿瘤细胞从病灶处脱落后进入外周血循环,部分定植于其他脏器,形成转移灶[4]。以CTC为标本的检测技术在较好地提供肿瘤细胞信息的同时,还便于多次、反复获取。本研究拟分别在肿瘤组织、外周血及CTC标本中检测NSCLC患者XRCC3基因多态性,以期探讨CTC能否替代肿瘤组织用于NSCLC患者XRCC3基因多态性分析。
1 对象与方法
1.1研究对象 选取2018年1月至12月于本院普外科就诊的中晚期NSCLC患者84例。其中男64例,女20例,年龄(57.3±8.3)岁;纳入标准:(1)经病理组织学检查确诊的原发性NSCLC患者,不伴有其他肿瘤史;(2)无化疗、生物疗法等抗肿瘤治疗史。TNM分期:Ⅲa期20例,Ⅲb期12例,Ⅳ期52例;病理分型:腺癌50例,鳞癌24例,腺磷癌10例。本研究经医院医学伦理学委员会批准(批准文号:2018-ZL03),患者均知情同意。
1.2主要仪器及试剂 GS-20型负压抽吸系统(上海硅莱医疗器械公司);Light Cycler 480型实时荧光定量PCR检测系统(瑞士Roche公司);Olympus BX63型自动荧光显微镜(日本Olympus公司);CelDocEZ型全自动免染凝胶成像分析系统(美国 Bio-Rad公司)。CTC免疫组化鉴定试剂盒(北京中杉生物技术公司);FITC标记小鼠抗人CD45多克隆抗体(武汉友联特生物公司);DAPI/细胞核染色试剂(上海碧云天生物公司);EB染色试剂盒(重庆迈凯公司);人染色体着丝粒特异性探针杂交混合液(上海起发实验试剂公司);Trizol试剂(北京柏莱斯特科技公司);BstEⅡ限制性内切酶(上海连桥生物科技公司)。
1.3方法
1.3.1标本采集 术中或病理检查时收集患者肺癌组织标本约2 g用于总RNA抽提,采用Trizol试剂提取组织RNA,变性梯度凝胶电泳检测RNA的浓度和纯度,取浓度>20 ng/μL、纯度>2.0的样本用于后续试验,置于-80 ℃保存。此外,收集化疗前患者清晨空腹外周静脉血3 mL,EDTA-K2抗凝,置于4 ℃保存。
1.3.2CTC富集、鉴定与荧光原位杂交 取患者经EDTA-K2抗凝的外周静脉血2 mL,经1%多聚甲醛在室温下预固定10 min,使用负压抽吸系统过滤外周血,PBS洗涤过滤得到的残余血液,4%多聚甲醛再次固定,将富集细胞的滤膜37 ℃烘干,根据CellSearch®标准[CK8/18/19+,含有细胞核的CD45-细胞(DAPI+)[5]]对CTC进行免疫组织化学染色鉴定。使用甲醇和冰乙酸混合液(3∶1)透化处理膜上细胞,加入30 μL人染色体着丝粒特异性探针杂交混合液,与滤膜上的细胞充分接触,置于杂交仪(76 ℃变性)中37 ℃温育12 h,次日洗膜除去探针杂交液,20 g/L胎牛血清封闭30 min,滴加5 μL FITC标记小鼠抗人CD45多克隆抗体(1∶500稀释),4 ℃避光静置2 h,加入30 μL DAPI染料,4 ℃静置2 h。置于Olympus BX63型自动荧光显微镜下随机选取20个视野,计数CTC(呈亮蓝色和橘红色)的细胞数目。
1.3.3XRCC3基因Thr241Met(rs861539)位点基因型分析 采用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)法分析XRCC3基因型。根据GenBank中XRCC3基因Thr241Met位点(C/T,rs861539)的序列号(AY181026),由上海捷瑞生物公司采用Oligo7引物设计软件设计并合成引物。上游引物序列:5′-CCTTGCTCTGTCCCCTCTGT-3′,下游引物序列:5′-AGTCCCCACCCTCTTGTTCA-3′,退火温度57 ℃,产物片段大小630 bp。PCR反应总体积为30 μL,包括10×PCR Buffer 10 μL、dNTP mix 3 μL、10 μmol/L上、下游引物各1 μL、耐热DNA聚合酶2 μL、DNA模板1 μL、双蒸馏水12 μL。反应条件:95 ℃ 5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 45 s,共40个循环;72 ℃延伸10 min。取10 μL扩增产物经BstEⅡ限制性内切酶37 ℃酶切40 min,用20 g/L琼脂糖凝胶电泳并进行EB染色,采用CelDocEZ型全自动免染凝胶成像分析系统检测并观察电泳结果,根据酶切后各片段大小确定XRCC3单核苷酸多态性和基因型。结果判读:XRCC3基因Thr241Met(rs861539)位点BstEⅡ限制性内切酶酶切后出现481 bp、265 bp、193 bp 3条条带,其中突变纯合型为481 bp,杂合型为481 bp、265 bp、193 bp,野生纯合型为265 bp、193 bp。
1.4统计学分析 采用SPSS 19. 0统计学软件进行数据处理,计数资料使用百分比表示,率的比较采用χ2检验及Fisher确切概率法;α=0.05为检验水准,以P<0.05为差异有统计学意义。
2 结果
2.1XRCC3基因Thr241Met(rs861539)位点检测结果 采用PCR-RFLP法可检出突变纯合型、杂合型及野生纯合型3种基因型,各基因型分布情况符合遗传平衡定律(χ2=17.592,P=0.000)。见图1。
2.2不同临床病理参数的NSCLC患者CTC个数比较 CTC个数在不同性别、年龄、病理类型及临床分期的NSCLC患者之间差异无统计学意义(P>0.05)。见表1。
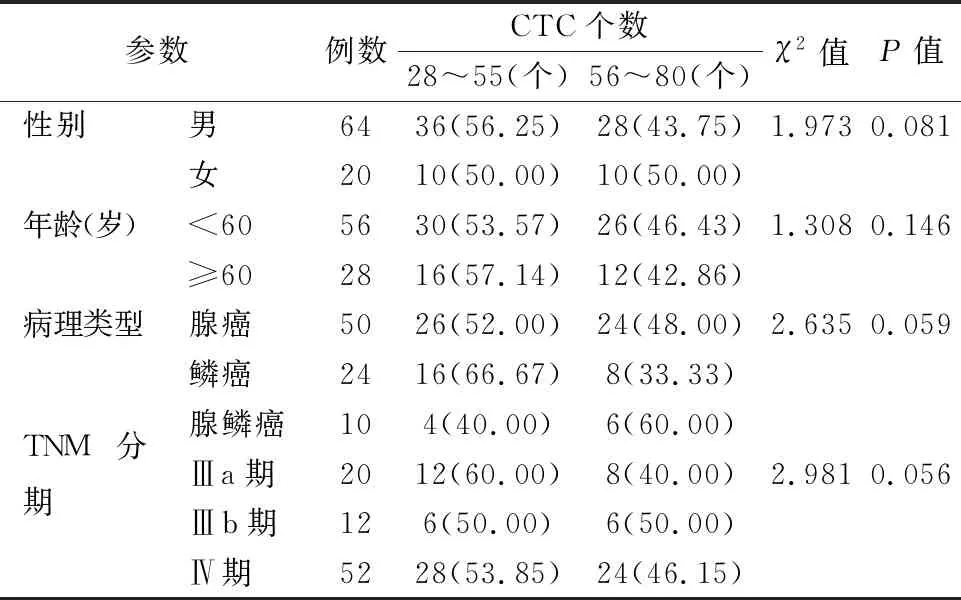
表1不同临床病理参数的NSCLC患者CTC个数比较[n(%)]
2.3不同标本XRCC3基因Thr241Met(rs861539)位点多态性的一致性分析 结果显示,肿瘤组织、CTC及外周血标本XRCC3基因Thr241Met(rs861539)位点多态性阳性率之间的差异无统计学意义(P>0.05)。见表2。以肿瘤组织检测结果为金标准,CTC检测XRCC3基因Thr241Met(rs861539)基因型与肿瘤组织基因位点多态性的一致率为95.24%(80/84);外周血标本与肿瘤组织基因位点多态性的一致率为76.19%(64/84)。CTC检测基因位点多态性的一致率明显高于外周血标本,差异有统计学意义(χ2=16.482,P=0.000)。
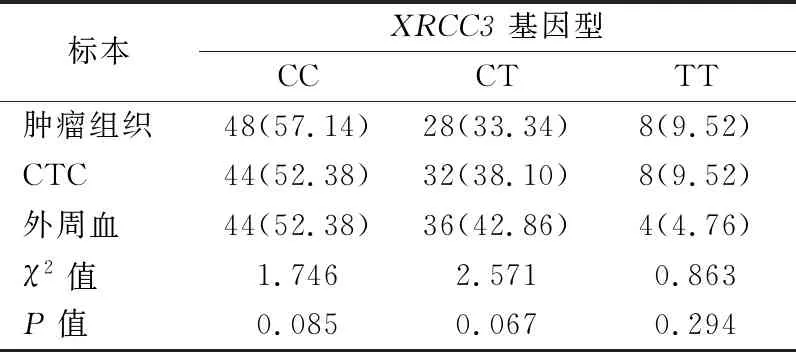
表2不同标本XRCC3基因Thr241Met(rs861539)位点多态性的阳性率比较[n(%)]
2.4XRCC3基因Thr241Met(rs861539)位点多态性与NSCLC患者临床病理参数的关系XRCC3基因Thr241Met(rs861539)位点多态性在不同年龄、病理类型及TNM分期的NSCLC患者之间的差异有统计学意义(P<0.05)。见表3。
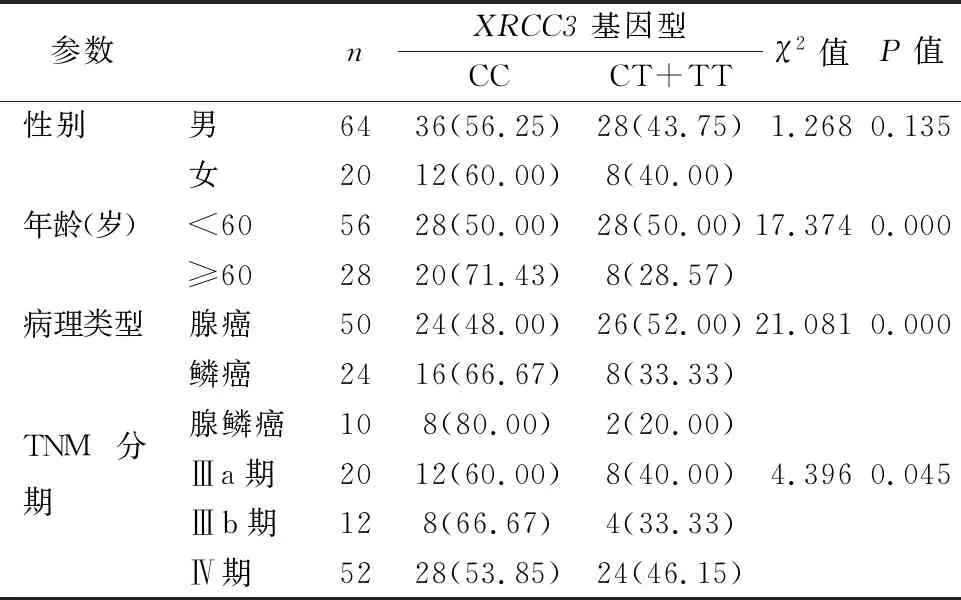
表3不同临床病理参数NSCLC患者XRCC3基因Thr241Met(rs861539)位点多态性比较[n(%)]
3 讨论
人类XRCC3基因首先从中国仓鼠卵巢细胞突变体系中分离得到,其能够编码1个包含346个氨基酸残基的蛋白质,并作为一种关键的DNA损伤修复基因,参与DNA单链断裂和碱基损伤的修复[5-7]。相关研究显示,XRCC3基因多态性与膀胱癌、食管癌、胃癌等多种恶性肿瘤的发生风险有关[8-10]。亦有研究显示,XRCC3基因多态性可影响铂类、卡铂、奥沙利铂等铂类化疗药物敏感性及治疗预后效果[11]。本研究结果显示,XRCC3基因Thr241Met(rs861539)位点多态性在不同年龄、病理类型及TNM分期的NSCLC患者之间存在明显差异,提示XRCC3基因多态性与NSCLC患者年龄等临床病理参数明显相关。另有研究显示,XRCC3基因rs861534和rs8615302位点的多态性与乳腺癌的内分泌治疗风险和转移复发风险密切相关[11-13];XRCC3基因Thr241Met多态性可能参与胃癌易感性[14]。结合本研究结果推测,XRCC3基因多态性在与NSCLC患者年龄等临床病理参数呈明显相关的同时,还可能与肺癌易感性、化疗耐药性等存在关联,但需进一步深入研究。
由于NSCLC患者外周血易于采集,创伤小,DNA提取难度较低,因此目前相关研究多集中于检测外周血XRCC3基因型[15];但由于DNA主要来自于外周血中的白细胞,对检测准确性造成了不良影响[16]。CTC指进入人体外周血的肿瘤细胞,主要来源于原发性或转移性肿瘤病灶组织,基因组构成与肿瘤组织具有高度一致性[11]。目前研究认为,以肿瘤组织为标本检测得到的XRCC3基因多态性准确性最高,但获得难度较高[17];因此,探究CTC检测肿瘤相关基因突变是否能够替代肿瘤组织具有重要意义。本研究以肿瘤组织检测的XRCC3基因多态性为金标准,并与CTC和外周血检测的XRCC3基因多态性进行比较分析,结果显示,肿瘤组织、CTC及外周血检测XRCC3基因Thr241Met(rs861539)位点多态性的阳性率之间差异无统计学意义;我们进一步以肿瘤组织检测的XRCC3基因多态性为金标准,并比较CTC与外周血检测结果的一致率,结果发现CTC检测XRCC3基因Thr241Met(rs861539)位点多态性的一致性高达95.24%,明显高于外周血标本的76.19%,提示CTC能够较好地反映出肺癌组织基因型。目前临床上还可直接从外周血中分离和富集CTC,准确性高,无需通过手术获取肿瘤组织标本。但亦有研究显示,由于目前的CTC捕捉技术无法保证百分百的纯度,临床应用中需对捕获的细胞进行鉴定,以确定为CTC细胞,进而减少检测的假阳性率和假阴性率[18];此外,在肿瘤的发生与发展过程中,CTC的数目呈动态变化的同时,其携带的分子标志物也在不断变化[19]。因此,临床应用CTC检测NSCLC患者基因型时应综合考虑以上因素,提高检测的准确性。虽然本研究纳入的患者均无化疗、生物疗法等抗肿瘤治疗史,避免了化疗等因素对XRCC3基因型的影响,但因此所纳入的样本量偏少,在今后的研究中应进一步扩大样本量进行深入研究。

