miR-146b在高糖环境下对肾小球系膜细胞的作用研究
王琼妮,纪成,尹思琪,胡玉燕,孙丰田,钱晖(江苏省检验医学重点实验室&江苏大学医学院,江苏镇江 212013)
糖尿病肾病是由糖尿病引起的微血管疾病,为糖尿病患者常见且严重的并发症,是终末期肾脏病的主要原因[1]。目前临床上缺乏早期诊断糖尿病肾病的敏感指标,急需寻求新的诊断标志物。微小RNA(microRNAs,miRNAs)是一类非编码小RNA分子,长度为20~25个核苷酸,可通过转录后机制调节基因表达[2]。近年来研究发现,miRNAs在糖尿病肾病进展过程中起着重要的作用[3]。miR-146b位于人类染色体10q24.32,能促进癌症发生并调节炎症及免疫反应[4]。本课题组前期研究发现,miR-146b在急性肾损伤中的表达水平明显升高,并具有潜在的临床诊断价值[5];但对于miR-146b在糖尿病肾病中的研究国内尚未见报道。本研究拟探讨miR-146b在高糖环境下对肾细胞的作用及机制,以期为糖尿病肾病寻找新的诊断指标。
1 材料与方法
1.1主要仪器及试剂 大鼠肾小管上皮细胞(NRK-52E)、大鼠足细胞(podocyte)及大鼠肾小球系膜细胞(HBZY-1)购自中国科学院典藏培养物保藏委员会细胞库。正常培养基(加入L-DMEM培养基使葡萄糖终浓度为5.5 mmol/L)、高糖培养基(加入L-DMEM培养基使葡萄糖终浓度为30 mmol/L)、Trizol试剂购自美国Gibco公司,胎牛血清(美国Excel公司),miScript Ⅱ RT Kit、miScript SYBR®Green PCR Kit、miR-146b、U6引物(德国Qiagen公司),miR-146b模拟物(mimics)、抑制物(inhibitors)及对照序列(NC)购自苏州吉玛公司,LipofectamineTM2000(美国Life Technologies公司),RIPA裂解液(南京诺唯赞生物科技公司),兔抗鼠YAP单克隆抗体、兔抗鼠p-YAP单克隆抗体、兔抗鼠YAP单克隆抗体(美国CST公司),辣根过氧化物酶(HRP)标记的山羊抗兔 IgG二抗(FITC conjugated)、兔抗鼠β-actin单克隆抗体均购自美国SAB公司。CO2培养箱、Nano Drop 1000核酸蛋白测定仪(美国Thermo公司),高速离心机(德国Eppendorf公司),ABI 7500荧光定量PCR仪(美国ABI公司),LAS4000化学发光成像系统、Elite激光共聚焦显微镜(美国GE公司)。
1.2细胞培养及高糖诱导的肾细胞损伤模型构建 NRK-52E、podocyte及HBZY-1细胞均采用含10%胎牛血清的L-DMEM培养基,于5%CO2、37 ℃恒温培养箱中温育,取生长状况良好细胞,经2.5 g/L胰蛋白酶消化后,将2×105个细胞接种于6孔细胞培养板中,实验设为正常组(置于5.5 mmol/L正常培养基培养)及高糖组(置于30 mmol/L高糖培养基培养),每孔加2 mL培养基继续培养48 h,用于后续实验。
1.3HBZY-1细胞转染 取生长状态良好的HBZY-1细胞,经2.5 g/L胰蛋白酶消化后,将1×105个细胞接种于6孔细胞培养板中,实验设为过表达组:包括miR-146b模拟物mimics组(20 nmol/L miR-146b mimics)及NC组(20 nmol/L mimics阴性对照片段);敲减组:包括miR-146b抑制剂inhibitors组(100 nmol/L inhibitors)及NC组(100 nmol/L inhibitors阴性对照片段)。过表达组采用正常培养基培养,敲减组采用高糖培养基培养。置于5%CO2、37 ℃恒温培养箱中继续培养24 h,按照LipofectamineTM2000转染试剂说明书进行转染,转染48 h后收集细胞并提取总RNA及蛋白质进行后续实验。
1.4RNA提取及qRT-PCR反应 采用Trizol试剂提取细胞总RNA,Nano Drop 1000核酸蛋白测定仪测定总RNA浓度及纯度,取吸光度(A260/280 nm)在1.8~2.0间的RNA样本,置于-80 ℃保存。按照miScript Ⅱ RT Kit说明书操作将RNA逆转录为cDNA,置于-20 ℃保存。miR-146b引物(GenBank序列号:NR_030169.1;引物序列:5′-CCUAGGGACU
CAGUUCUGGUG-3′;产物大小为73 bp;退火温度55 ℃)及U6引物(GenBank序列号:NR_004394.1;引物序列:5′-CTCGCTTCGGCAGCACA-3′;产物大小为106 bp;退火温度55 ℃),均由德国Qiagen公司采用Primer Premier 5.0软件设计并合成。以该cDNA为模板,按照miScript SYBR®Green PCR Kit说明书进行qRT-PCR。PCR总反应体系为10 μL,包括10×miScript通用引物1 μL,2×QuantiTect SYBR Green PCR Master Mix 5 μL,miR-146b/U6引物(10 μmol/L) 1 μL,RNase free H2O 2 μL,3 ng/μL cDNA 1 μL。循环参数:95 ℃预变性15 min;94 ℃ 15 s,55 ℃ 30 s,63 ℃ 30 s,40次循环。以U6为内参,miR-146b的相对表达水平以2-ΔΔCt法计算,公式:ΔΔCt=[(样本Ct目的基因-样本Ct管家基因)-(对照组Ct目的基因-对照组Ct管家基因)]。试验重复3次。
1.5western blot检测 取1.3中各组细胞(1×106个),加入100 μL RIPA裂解液提取细胞总蛋白质,Nano Drop 1000核酸蛋白测定仪测定蛋白质浓度。以3∶1体积比加入4×Loading buffer,煮沸10 min后置于-20 ℃保存。以12%SDS-PAGE凝胶进行电泳,每孔蛋白质加样量为150 μg,80 V电泳150 min,350 mA冰浴转膜2 h,50 g/L脱脂奶粉封闭1 h。分别加入兔抗鼠p-YAP单克隆抗体(1∶1 000稀释),兔抗鼠YAP单克隆抗体(1∶1 000稀释),兔抗鼠β-actin单克隆抗体(1∶2 000稀释),4 ℃温育过夜。TBST洗膜,加入辣根过氧化物酶(HRP)标记的山羊抗兔 IgG二抗(1∶2 000稀释),37 ℃温育1 h,TBST洗膜,HRP化学发光底物法进行凝胶成像,采用Image J软件进行灰度扫描及结果判读,试验重复3次。
1.6细胞免疫荧光 取生长状况良好的HBZY-1细胞,经2.5 g/L胰蛋白酶消化,计数2×104个细胞,接种于预先放置细胞爬片的24孔细胞培养板中,试验设为正常组、高糖组(试剂同上),每孔加500 μL培养基继续培养48 h。转染miR-146b的HBZY-1细胞经2.5 g/L胰蛋白酶消化并计数2×104个细胞,接种于预先加入细胞爬片的24孔细胞培养板中,试验设为miR-146b模拟物mimics及NC组;miR-146b抑制剂inhibitors及NC组,试剂浓度同步骤1.3。培养48 h,PBS洗涤后加入4%多聚甲醛室温10 min固定。PBS洗涤5 min,重复3次,0.1% Triton-100破膜20 min。PBS洗涤5 min,重复3次,5% BSA室温封闭20 min。加入兔抗鼠YAP单克隆抗体(1∶100稀释),4 ℃温育过夜。PBS洗涤5 min,每次3次,避光加入HRP标记的山羊抗兔IgG二抗(1∶500稀释),37 ℃温育45 min。PBS洗涤,Hochest 33342染料(1∶200稀释)染核5 min,PBS洗涤,使用激光共聚焦显微镜观察并拍照,Image J软件进行平均荧光强度检测,试验重复3次。
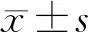
2 结果
2.1miR-146b在不同处理条件下HBZY-1细胞中的表达 与正常组(0.947±0.051)相比,高糖处理后miR-146b在HBZY-1(2.197±0.166)中的表达水平显著升高(t=7.215,P<0.01);而高糖组NRK-52E(0.996±0.056)及podocyte(0.962±0.027)与正常组NRK-52E(1.021±0.020)及podocyte(1.003±0.058)相比差异无统计学意义(t分别为0.421和0.639,P均>0.05)。
2.2高糖诱导HBZY-1后YAP蛋白的表达 western blot结果显示,与正常组(YAP:0.456±0.004;p-YAP:0.628±0.004)相比,高糖组HBZY-1细胞中YAP蛋白(0.753±0.008)的表达水平明显升高(t=32.17,P<0.001),而p-YAP蛋白(0.372±0.005)的表达水平明显降低(t=39.56,P<0.001)(图1A);免疫荧光结果显示,与正常组(25.250±3.100)相比,高糖组中YAP蛋白荧光强度(53.620±4.229)明显升高(t=5.410,P<0.01),且细胞核内YAP蛋白荧光强度明显增强(图1B)。
2.3HBZY-1过表达/抑制miR-146b后YAP蛋白的表达 与mimics NC组(1.009±0.099)相比,mimics组中miR-146b的表达(7.083±0.283)显著升高(t=20.24,P<0.001)。与inhibitors NC组(1.006±0.079)相比,inhibitors组中miR-146b的表达(0.151±0.010)明显降低(t=10.71,P<0.001)。western blot结果显示,正常环境下过表达miR-146b后,与mimics NC组(YAP:0.651±0.003;p-YAP:0.917±0.004)相比,mimics组YAP蛋白(0.883±0.005)的表达明显升高(t=10.71,P<0.001),p-YAP(0.606±0.006)的表达明显降低(t=44.16,P<0.001);而在高糖环境下敲减miR-146b后,与inhibitors NC组(YAP:0.860±0.007;p-YAP:0.638±0.004)相比,inhibitors组YAP(0.706±0.002)的表达明显降低(t=22.15,P<0.001),p-YAP(0.774±0.003)的表达则明显升高(t=25.61,P<0.001)(图2A)。免疫荧光结果显示,与mimics NC组(7.880±0.6196)相比,mimics组YAP荧光强度(25.700±1.589)增强(t=10.45,P<0.001),入核增多;敲减miR-146b后,与inhibitors NC组(26.030±1.074)相比,inhibitors组YAP荧光强度(8.900±1.022)减弱(t=11.56,P<0.001),入核减少(图2B)。
3 讨论
近年来,有关miR-146b作用的研究大多集中于肿瘤、炎症及免疫反应方面[4]。例如在甲状腺乳头状癌中miR-146b通过靶向卷曲螺旋结构域6(CCDC6)促进疾病的发生、发展[6],胃癌中miR-146b通过靶向蛋白质酪氨酸磷酸酶1B(PTP1B)调节胃癌细胞的增殖和凋亡[7]。此外,多项研究表明,miR-146b对于肾脏纤维化疾病具有一定的作用。例如在单侧输尿管结扎的肾纤维化模型中miR-146b表达升高,并可能激活NF-κB参与肾脏纤维化[8];在由镉诱发的肾损伤动物模型中,miR-146b的表达显著升高,表明miR-146b可能是肾脏损伤的生物学标志物[9]。在2型糖尿病患者中,miR-146b表达升高且与糖化血红蛋白具有一定的关联性[10];高糖环境可刺激TNF-α,IL-6和IL-1β等促炎性细胞因子的表达,而这些炎症因子可能是诱导miR-146b表达升高的原因[11]。本研究结果显示,miR-146b在高糖诱导的HBZY-1细胞中表达水平明显升高,提示高糖环境下miR-146b可能主要作用于HBZY-1细胞,影响肾脏皮质中肾小球的功能。
YAP转录共激活因子是Hippo信号通路关键效应分子,调控细胞增殖、分化和组织稳态[12]。目前研究表明,YAP在糖尿病肾病中具有重要作用。有学者发现YAP在肾组织中高表达,并与肌酐、尿素氮、糖尿病肾病分期及病理分级等相关,提示YAP在2型糖尿病肾病肾损害中起重要作用[13]。另有研究发现,高糖培养的肾小球系膜细胞中Hippo途径高度失活,Mst1和Lats1磷酸化的减少促进了YAP蛋白的表达和核易位,从而造成肾小球系膜过度增殖及肾皮质损伤[14]。本研究亦证实了高糖刺激后HBZY-1细胞的p-YAP蛋白表达减少,而YAP蛋白表达升高,且入核增加,YAP入核后则与TEA转录因子(TEAD)联合,介导细胞增殖和细胞外基质合成,促进肾细胞损伤;过表达miR-146b后YAP表达升高,p-YAP表达减少,而敲减后则相反,提示miR-146b在HBZY-1细胞中可能通过Hippo/YAP信号通路发挥作用。NF2基因是Hippo通路的上游元件,有学者证实,miR-146b-3p与NF2基因具有靶向关系[15],而miR-146b-3p与miR-146b-5p序列相似,因此,我们推测miR-146b可能通过靶向NF2基因,调控YAP蛋白的磷酸化情况,进而影响Hippo/YAP信号通路的功能。然而,本研究不足之处在于缺乏体内实验数据,同时未阐明miR-146b是通过何种机制调控Hippo/YAP信号通路,从而影响高糖环境下HBZY-1的功能。因此,我们将在后续研究中构建糖尿病肾病大鼠模型,结合临床数据进一步分析miR-146b作为早期诊断标志物的可能性,并深入研究miR-146b在糖尿病肾病进展过程中可能的生物学功能及作用机制,为糖尿病肾病的诊断及治疗提供新的治疗靶点。

