基于临床实验室指标的HBV相关性原发性肝癌微血管侵犯预测模型的建立
何羽童,黄晨军,王颖,高春芳(上海东方肝胆外科医院实验诊断科,上海200438)
原发性肝细胞癌(hepatocellular carcinoma,HCC)发病率和致死率至今仍居高不下[1]。微血管侵犯(microvascular invasion,MVI)是肝癌术后复发及不良预后的危险因素,Beppu等[2]报道HCC患者肝切除术后有无MVI对于预测2年内早期复发或早期死亡具有重要的意义。因此,术前对MVI作出准确预测可对选择治疗方案、改善术后生存产生重要的影响。目前临床上诊断MVI时,将全部组织切片内的MVI进行计数,并根据MVI的数量和分布情况进行风险分级,主要分为以下3类:M0:未发现 MVI;M1(低危组):≤5个MVI,且发生于近癌旁组织区域(≤1 cm);M2(高危组):>5 个 MVI,或 MVI 发生于远癌旁肝组织区域(>1 cm)[3]。本研究旨在基于HBV相关性 HCC患者的临床实验结果,通过建立Logistic回归模型,预测HCC患者发生MVI风险,以期对临床治疗有所助益。
1 对象与方法
1.1研究对象 回顾性分析2015年1月至12月东方肝胆外科医院连续性行手术切除治疗,乙肝表面抗原(HBsAg)阳性且病理组织学证实为HCC的患者1 628例,其中男1 412例,女216例。根据MVI病理诊断情况分为M0组(共682例,男583例,女99例)、M1组(共455例,男398例,女57例)和M2组(共491例,男431例,女60例)。3组研究对象年龄、性别差异均无统计学意义(P>0.05)。纳入标准:(1)患者血清HBsAg持续阳性6个月以上或血清HBV DNA >104IU/mL;(2)所有患者均接受根治性肝癌切除术,即肿瘤切缘显微镜下无肿瘤细胞残留;(3)术前接受完整的实验室检查,且临床和病理资料齐全。排除标准:(1)排除丙型肝炎等其他肝炎病毒感染;(2)排除术前接受其他抗肿瘤治疗,且发生大血管侵犯或远处转移;(3)排除既往其他肿瘤史。本研究经上海东方肝胆外科医院医学伦理委员会批准(批准文号:EHBHKY2018-1-009),各研究对象知情同意。
1.2标本采集 所有的肝切除标本切成连续的 2~3 mm厚的薄片,10%甲醛固定,以便进行病理组织学检查。主要检测项目包括:肿瘤最大径、肿瘤数目、MVI、包膜形成与组织学分级。
1.3试剂、仪器 XE2100全自动血液分析仪及血小板 (platelet,PLT)配套试剂、CA7000全自动血凝分析仪及其凝血酶原时间(prothrombin time,PT)配套试剂(日本希森美康株式会社),C702全自动生化分析仪及其血清总胆红素(total bilirubin,T-Bil)、清蛋白(albumin,Alb)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)配套试剂,Cobas e601全自动免疫分析仪及其甲胎蛋白(Alpha fetoprotein,AFP)、HBsAg、乙肝e抗原(Hepatitis B e antigen,HBeAg)配套试剂(德国罗氏公司),甲胎蛋白异质体(AFP-L3)分离试剂(北京热景生物技术公司),ABI 7500荧光定量PCR仪及其乙肝病毒载量(HBV DNA)配套试剂(上海科华生物技术公司)。
1.4方法 PLT采用电阻抗法检测,参考范围为(125~350)×109/L;PT采用凝固法检测,参考范围为10~13 s;T-Bil采用重氮法检测,参考范围为≤23 μmol/L;Alb采用比色法检测,参考范围为40~55 g/L;ALT采用IFCC推荐方法检测,参考范围为9~50 U/L;AST采用比色法检测,参考范围为15~40 U/L;甲胎蛋白采用电化学发光法检测,参考范围为<20 ng/mL;HBsAg采用电化学发光法检测,参考范围为<1 COI;乙肝e抗原采用电化学发光法检测,参考范围为<1 COI;AFP-L3采用手工亲和吸附分离法和电化学发光法检测,参考范围为<10%;HBV DNA采用磁珠/PCR-荧光探针法检测,参考范围为<50 IU/mL。以上均严格按照仪器及试剂说明书操作及结果判读。
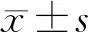
2 结果
2.1各组患者的临床病理资料及临床指标检测结果比较 M0组、M1组、M2组间年龄、性别、PT、T-Bil、HBV DNA差异均无统计学意义(P>0.05);而PLT、Alb、ALT、AST、AFP、AFP-L3、HBeAg差异有统计学意义(P<0.05)。进一步行组间两两比较结果表明,与M0组相比,M1组的AFP、AFP-L3、HBeAg阳性率水平升高(P<0.05);与M0组相比,M2组的PLT、ALB、ALT、AST、AFP、AFP-L3、HBeAg阳性率水平升高(P<0.05);与M1组相比,M2组的AFP、AFP-L3水平升高(P<0.05),且M1组与M2组间PLT、ALT、AST的差异有统计学意义(P<0.05)。各组患者的临床病理资料见表1。

表1各研究对象的临床病理资料
2.2肝癌MVI的危险因素及建立的预测模型 以M0为无MVI对照组,以M1和M2合并为MVI组,进行单因素二元Logistic回归分析,筛选出有意义的指标(P<0.05)后,再进行多因素Logistic回归分析并建模。分析得到有临床意义的参数包括: PLT(OR=1.003),PT(OR=1.122),lgAFP(OR=1.240),AFP-L3(OR=1.020),HBeAg (OR=1.520)。建立多因素Logistic回归模型:Logistic(P)=-1.485+0.418×HBeAg+0.215×lgAFP+0.115×PT+0.020×AFP-L3+0.003×PLT。结果证实HBeAg、AFP、AFP-L3、PT、PLT是肝癌MVI的独立危险因素。见表2。

表2单因素与多因素Logistic回归分析结果
2.3Logistic(P)模型对HCC发生MVI预测效率分析 根据Youden指数最大原则,取1.000 1为cut-off值,该模型鉴别无MVI(M0)与有 MVI(M1+2)、M0与低危MVI(M1)、M0与高危MVI (M2)、低危MVI(M1)与 高危MVI(M2)的结果见表3、图1。
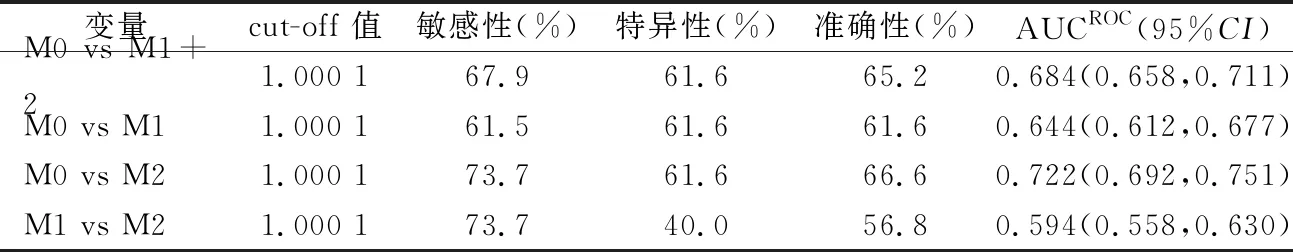
表3Logistic(P)模型对HCC发生MVI预测效率分析结果
3 讨论
目前,术后组织病理学检查是我国MVI 确诊的金标准, CT和MRI图像分析是临床术前预测MVI的常见方法,但由于受医生经验影响、不适合大样本处理以及没有统一判断标准等弊端的影响,单一影像学预测方法难以保证预测准确性[4]。
Wei等[5]报道HBV病毒的持续存在状态是导致HCC患者发生血管浸润的潜在因素,故而本次研究对象为HBV相关性HCC患者,以期得到更为准确的结果。本研究发现,AFP与AFP-L3水平均为M0组
本研究所得模型Logistic(P)=-1.485+0.418×HBeAg+0.215×lgAFP+ 0.115×PT+0.020×AFP-L3+0.003×PLT对于鉴别M0与高危MVI (M2)具有一定预测价值,但是在鉴别是否发生MVI(M0 vs M1+2)、M0与低危MVI(M0 vs M1)以及区分MVI严重程度(M1 vs M2)时的预测价值较为一般。胡月雷等[11]建立的肝细胞癌MVI的危险评分术前预测模型,纳入病例数与临床检验数据均较少。梁志银等[12]建立的列线图预测模型纳入项目较为全面,列线图预测值和观察值符合度良好,但该模型预测效能偏低。而童林等[13]验证了Johnson等[14]建立的GALAD模型预测高危组 MVI(M2)(M0 vs M2)的AUCROC(95%CI)为0.717(0.701~0.733),其认为该模型对于是否发生MVI(M0 vs M1+2)、M0与低危MVI(M0 vs M1)以及区分MVI严重程度(M1 vs M2)时预测价值较为一般,亦与本模型结果符合。Lei等[7]分别用列线图和nomogram建立了MVI预测模型,列线图预测值和观察值符合度良好,但预测效能偏低,nomogram预测效能优于列线图,并且除了纳入临床检验指标、Child-Pugh分级、BCLC分级等之外,还纳入了患者肝切除后的总生存期和复发时间,结果较为可靠。
本研究存在以下不足之处,如有学者发现,AFP、AFP-L3%和PIVKA-Ⅱ三联检测是对早期HCC的重要检测手段[15],在检测HBV相关性HCC时,PIVKA-Ⅱ对于AFP具有补充作用[16]。而本研究由于东方肝胆外科医院开展PIVKA-Ⅱ检测时间较晚,并未纳入此次研究。此外,本次研究仅纳入上海地区的患者,不能消除地域差异存在的影响。在未来条件允许的情况下,纳入多中心的临床常用检验指标及肝癌发生相关指标,有助于提高预测模型的准确性,从而为临床提供非创性MVI预测,协助临床治疗决策和预后判断。

