慢性肾脏病患者血压形态特点及临床疗效分析
吴 鹏,张佳晨,沈 蕾
(苏州大学附属第一医院 肾内科,江苏 苏州 215006)
慢性肾脏病是一个日益严重的公共卫生问题,全球CKD发病率高达8%~16%[1]。高血压作为CKD进展的重要危险因素之一,积极控制血压可降低CKD患者的死亡风险并减少心血管事件的发生[2]。一项针对中国CKD合并高血压患者的研究显示,以低于130/80 mmHg和140/90 mmHg(1 mmHg=0.133 kPa)作为降血压目标值,合并高血压的CKD患者血压控制率分别为15.0%和41.1%[3]。因此,早期识别高血压及积极控制血压是延缓CKD疾病进展的重要手段之一。近年来,随着对夜间高血压和特殊类型血压认识的深入,血压节律改变对高血压患者的预后及靶器官的损伤日渐重视。患有夜间高血压的CKD患者发生肾脏事件与心血管事件的风险均增加[4]。通过充分了解血压的昼夜节律特点,选择合理的治疗时间比联合用药能更好地控制血压。有研究表明,将至少1种降压药改为睡前服用,纳入的高血压患者非杓型率由基线值的84%降低为43%[5],有效降低靶器官损伤的风险。本研究通过回顾性分析CKD合并高血压患者的血压特点,探讨血压异常昼夜节律的影响因素和改变降压药服用时间对临床疗效的影响。
1 资料与方法
1.1病例选择 2018年1月至2019年9月在苏州大学附属第一医院肾内科住院,并接受动态血压监测的CKD合并高血压患者182例。纳入标准:(1)有效的24 h动态血压监测(ambulatory blood pressure monitoring, ABPM);(2)临床资料完整,包括性别、年龄、既往是否有糖尿病及明确的心血管疾病;(3)诊断符合肾脏预后质量(kidney disease outcomes quality initiative, K/DOQI)指南的CKD患者[6];(4)符合中国高血压防治指南中的高血压诊断标准的患者[7];(5)同意进行动态血压监测并签署知情同意书。排除标准:(1)临床资料不完整、缺失的患者;(2)目前存在急性心肌梗死、急性心力衰竭、脑卒中、恶性肿瘤、恶性高血压等病情不稳定患者;(3)确诊为原发性高血压和已进入透析的CKD患者。
1.2方法
1.2.1血压监测及诊室血压 ABPM是在不影响患者正常行为活动情况下连续 24 h 对患者进行血压测量。白天测量时间段为6:00~23:00,测量频率设置为每20 min测量1次;夜间测量时间段为23:00~6:00,测量频率设置为每30 min测量1次。在动态血压测量期间告知患者正常活动及休息,并按时服用降压药物。在超过30%数据丢失或者超过3 h无数据记录,夜间睡眠时间小于6 h或白天睡眠时间大于10 h,监测数据视为无效。采用欧姆龙电子血压计在监测ABPM当天清晨监测患者诊室血压值,需连续测量3次,中间间隔5 min,选取数值较接近的2次计算平均值作为诊室血压值。
1.2.2实验室检查 收集患者血红蛋白、白细胞计数、红细胞计数、血小板计数、丙氨酸转氨酶、天冬氨酸转氨酶、白蛋白、肌酐、尿素氮、尿酸、血糖、甘油三酯、总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇、hs-CRP、总蛋白、球蛋白、24 h尿蛋白、肾小球滤过率(estimatedg lomerular filtrationrate,eGFR)等。
1.2.3高血压诊断标准 (1)诊室高血压:在未使用降压药物的情况下非同日3次测量收缩压≥140 mmHg 和(或)舒张压≥90 mmHg。患者既往有高血压史,目前正在使用降压药物,血压虽然低于140/90 mmHg,仍应诊断为高血压[7]。(2)动态高血压:24 h收缩压和(或)舒张压≥130/80 mmHg,白天收缩压和(或)舒张压≥135/85 mmHg, 夜间收缩压和(或)舒张压≥120/70 mmHg[7]。杓型血压:夜间血压下降率≥10%;非杓型血压:夜间血压下降率0~10%;反杓型血压:夜间血压下降率<0%。(3)白大衣性高血压:患者的诊室收缩压和(或)舒张压≥140/90 mmHg,而24 h、白天或夜间血压均正常[8]。(4) 隐匿性高血压:患者的诊室收缩压和(或)舒张压<140/90 mmHg,而24 h、白天或夜间血压升高[8]。
1.2.4改变降压药服用时间 动态血压监测结果为非杓型或反杓型患者,将至少1种ARB类(缬沙坦、氯沙坦、厄贝沙坦)或CCB类(硝苯地平控释片、氨氯地平、非洛地平)降压药改为睡前服用,随访3个月,监测患者肾功能及24 h尿蛋白。

2 结 果
2.1一般资料 本研究共纳入182例CKD合并高血压患者。男性105例(57.7%),女性77例(42.3%),平均年龄(56.3±16.5)岁,平均eGFR(48.8±36.8) ml(min·1.73 m2)。其中CKD1期35例(19.3%),CKD2期25例(13.7%),CKD3期49例(26.9%),CKD4期40例(22.0%),CKD5期33例(18.1%)。血压节律正常的患者25例(13.7%),血压节律异常的患者157例(86.3%),其中非杓型血压93例(51.1%),反杓型血压64例(35.2%),见图1。
2.2根据CKD分期进行比较 不同分期间,患者的年龄、24 h收缩压、白天收缩压、夜间收缩压差异有统计学意义(P<0.05),见表1。两两比较发现,与CKD1期相比,CKD3期、CKD4期、CKD5期患者的24 h收缩压、夜间收缩压均显著升高,CKD4期、CKD5期患者的白天收缩压显著升高。 CKD各期杓型血压比例分别为25.7%,4.0%,10.2%,15.0%,12.1%,与CKD1期相比,CKD2-5期的杓型率呈下降趋势,但差异无统计学意义。
2.3不同血压形态患者的临床数据比较及影响因素分析 在不同血压形态患者中,年龄、血红蛋白、hs-CRP差异有统计学意义(P<0.05),见表2。与杓型血压患者比较,非杓型或反杓型血压患者的年龄较大,血红蛋白较低,hs-CRP较高,见图2~3。进一步logistic回归分析显示,年龄是发生反杓型血压的独立危险因素;hs-CRP是血压节律异常的独立危险因素,见表3。

表1 不同CKD分期动态血压数据比较
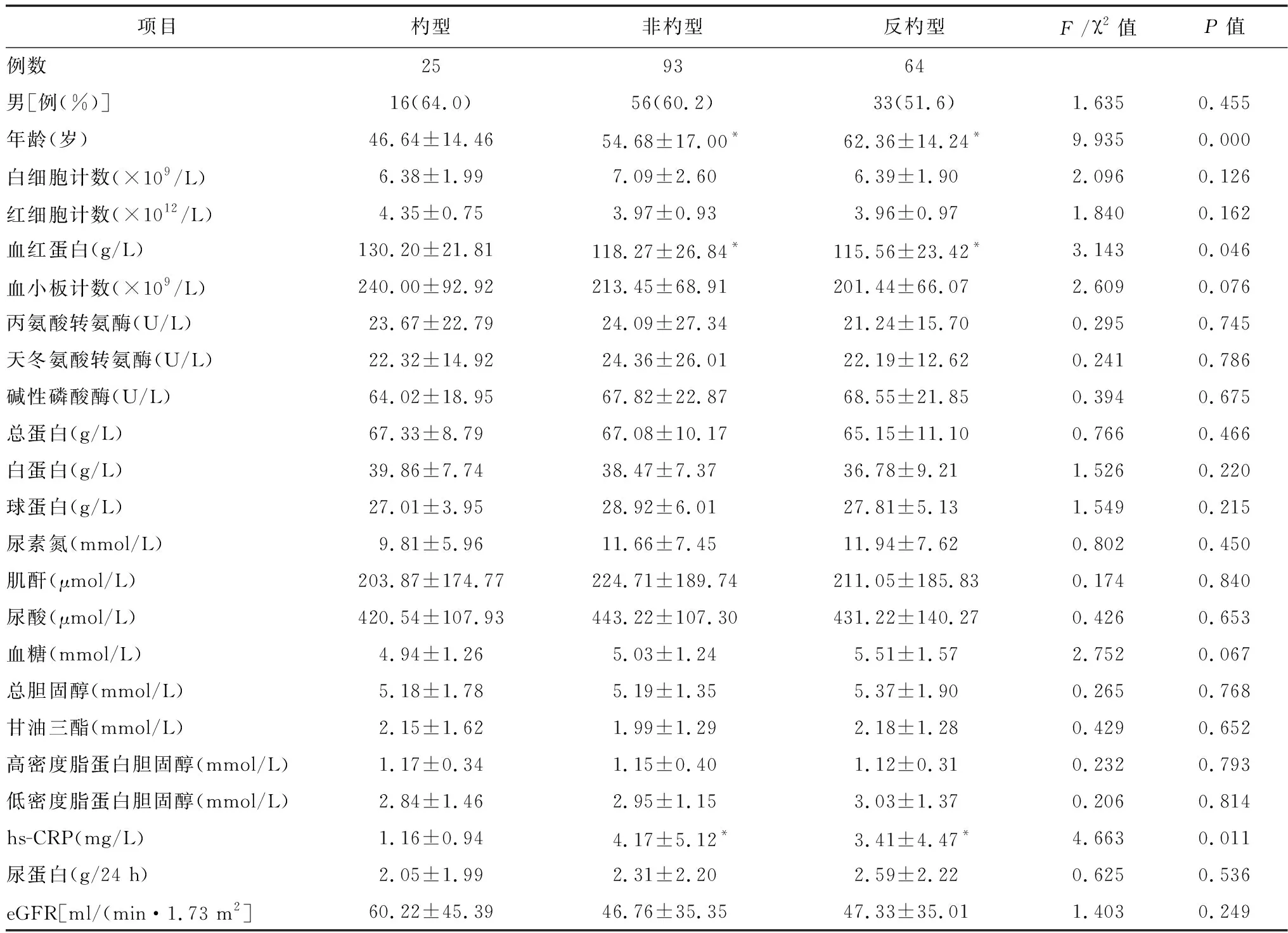
表2 不同血压类型临床数据比较
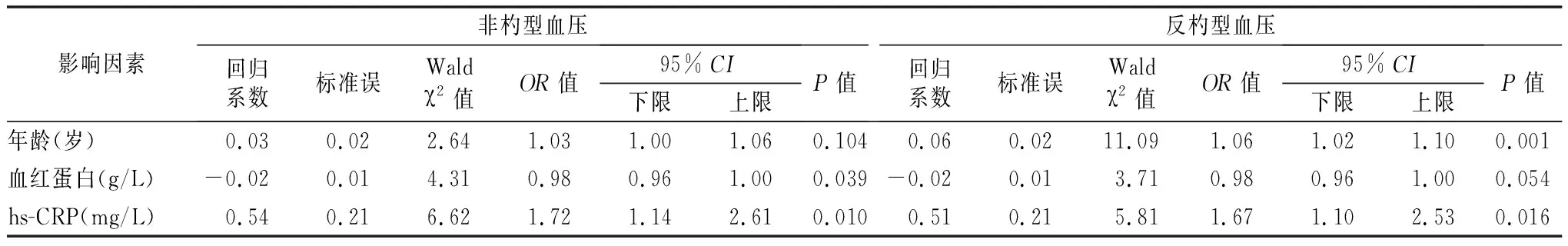
表3 异常血压节律影响因素的logistic回归分析
2.4血压控制情况及特殊血压类型分布情况 所有纳入本研究的患者均规律服用降压药,诊室血压控制人数46例(25.3%),动态血压控制人数26例(14.3%),夜间血压未控制人数高达152例(83.5%)。在诊室血压控制患者中,诊室血压与动态血压均控制人数10例(21.7%),36例(78.2%)有隐匿性高血压;在诊室血压未控制患者中,有16例(11.8%)有白大衣性高血压,120例(88.2%)有持续性高血压,见表4。血压整体控制及分布情况见图4。与血压均控制患者比较,隐匿性高血压患者的肌酐、尿酸均偏高(P<0.05);白大衣性高血压患者的肌酐偏高(P<0.05),见图5~6。血红蛋白、白蛋白、尿素氮、24 h尿蛋白、eGFR、hs-CRP差异无统计学意义,见表5。

表4 诊室血压及动态血压控制情况[例(%)]
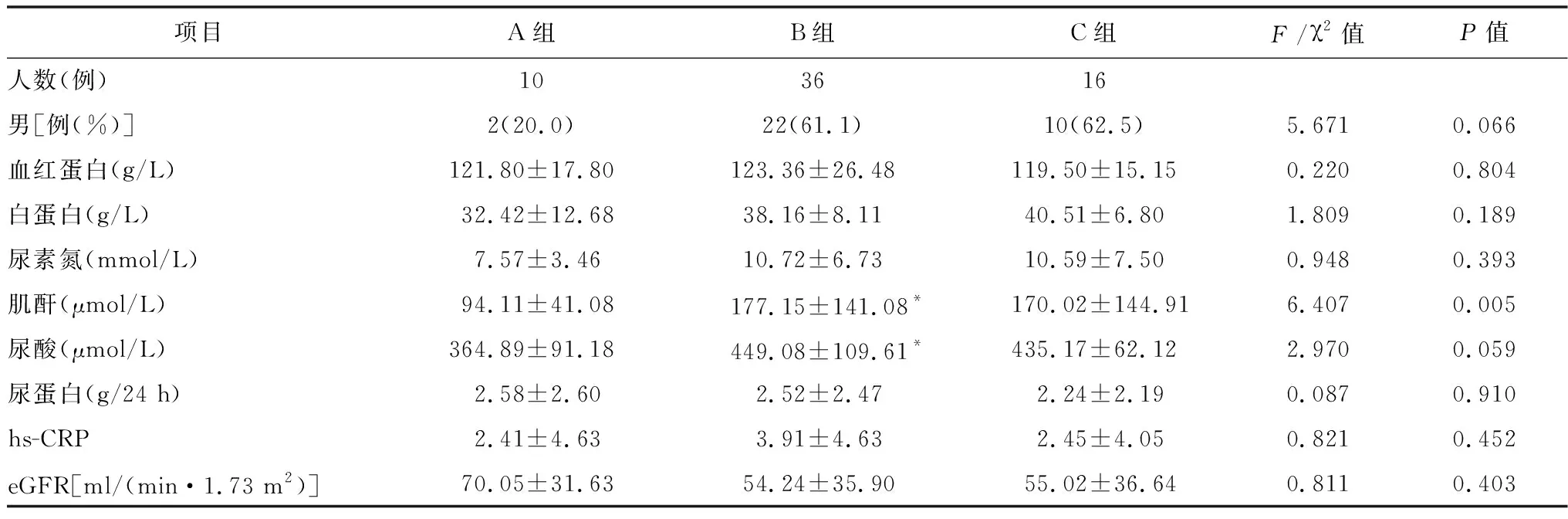
表5 特殊血压类型的临床指标之间的比较
2.5改变降压药服用时间对临床指标的影响 在本研究中,有43例非杓型或反杓型血压患者至少将1种降压药改为睡前服用作为改药组,35例患者均晨起服用降压药作为对照组,两组基线资料差异无统计学意义(P>0.05)。对这78例患者随访3个月后发现,在改药组患者中,24 h尿蛋白、尿酸较3个月前明显改善见图7~8;未改药组患者中,与3个月前基线值比较,24 h尿蛋白、尿酸无显著改变,且尿素氮较基线值升高(P<0.05)。两组3个月后的肌酐、白蛋白、eGFR较基线值无显著改变(P>0.05),见表6。
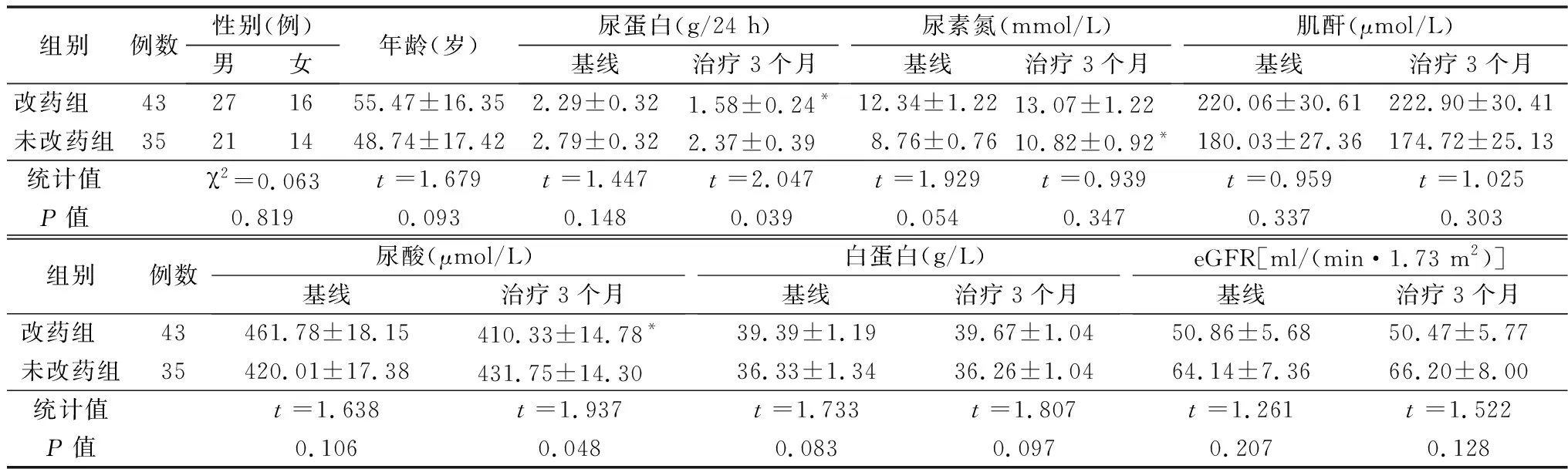
表6 睡前服用降压药物对肾功能相关指标的影响
3 讨 论
生理状态下,人体血压表现为节律性波动,夜间血压比白天低10%~20%,即为“杓型”节律。这种血压昼夜节律对适应机体的活动,以及对心、脑、肾等重要靶器官的正常结构与功能具有重要的保护作用。目前相关研究表示这种昼夜节律的波动主要受自主神经系统和肾素-血管紧张素-醛固酮(renin-angiotensin-aldosterone system, RAAS)系统的调节[9]。CKD合并高血压患者往往表现为夜间收缩压和舒张压下降减少或消失,血压昼夜节律异常率明显增高[10]。与上述研究一致,在本研究发现CKD合并高血压患者的血压类型以非杓型为主,杓型率仅为14%。且随着CKD分期的增加,患者的24 h收缩压、白天收缩压、夜间收缩压之间差异有统计学意义。CKD合并高血压患者的异常血压节律的机制可能:自主神经功能紊乱,RAAS系统激活,血管活性物质异常以及微炎症状态等[11]。随着肾功能的进展,又预示血压升高风险的增加,高血压与CKD患者的肾脏预后息息相关。
在本研究中,与杓型血压患者比较,非杓型或反杓型血压患者年龄、hs-CRP、血红蛋白差异有统计学意义。年龄是影响血压昼夜节律的重要因素,随着年龄的增长,表现为血压节律振幅的减低[12]。本研究的多因素分析显示,年龄是反杓型血压发生的独立危险因素。高血压常伴有微炎状态,炎症细胞因子如IL- 1β、IL-6、IL-10被认为与高血压发生发展相关[13]。Tsioufis等[14]对原发性高血压患者的血压节律及CRP水平进行分析发现,非杓型血压患者表现出明显的亚临床炎症状态。在CKD合并高血压患者中,我们也发现异常血压节律的炎症状态更明显,hs-CRP是此类患者发生血压节律异常的独立危险因素。此外,炎症可抑制促红细胞生成素(erythropoietin,EPO)的功能[15],同时直接上调铁调素的水平,导致铁吸收和利用障碍,引起贫血[16]。因异常的血压节律可激活肾脏RAAS系统,通过血管紧张素Ⅱ介导黏附分子的上调和细胞因子的表达来发挥促炎作用[17],CKD合并高血压的患者的贫血可能一定程度上与此种促炎作用造成的血浆EPO水平降低和上调铁调素水平有关,而这一作用机制独立于肾功能水平。另一方面,异常的血压昼夜节律也会影响肾脏EPO的分泌节律。在分析异常血压节律的影响因素时,我们发现非杓型血压患者更容易出现血红蛋白降低。但是否与促炎作用或肾脏EPO的分泌节律改变有直接关系尚需进一步研究。
CKD合并高血压的患者不仅易发生异常的血压昼夜节律,白大衣性高血压和隐匿性高血压在此类患者中亦不容忽视。纳入本研究的所有患者均规律服用降压药,有8.8%的患者存在白大衣性高血压,19.8%的患者存在隐匿性高血压。Tang等[18]对1 322例CKD住院患者进行研究表示,与血压正常的患者比较,患有白大衣高血压和隐匿性高血压患者的eGFR较低,且左心室射血分数和颈动脉内膜中层厚度均偏高,靶器官损害程度较严重。一项来自中国非透析CKD患者的前瞻性研究表示白大衣性高血压可加速CKD患者的肾脏疾病进展[19]。在本研究中,通过与血压均控制组比较,隐匿性高血压或白大衣性高血压患者的血清肌酐均偏高,表明这两种特殊血压类型可加速CKD患者肾功能恶化的进程。既往研究表示诊室血压正常而诊室外血压升高的CKD患者与肾脏事件、病死率、以及心血管事件风险增加密切相关[20]。与持续性高血压相比,隐匿性高血压与全因病死率及心血管疾病的病死率联系更密切[21]。我们还发现隐匿性高血压患者的尿酸亦高于血压均控制组。而尿酸是心血管事件的独立危险因素[22],提示隐匿性高血压与心血管事件相关。因此,我们应该定期对CKD合并高血压患者进行动态血压监测,及时识别白大衣性高血压和隐匿性高血压,合理进行降压治疗,避免降压不及时或过度降压治疗引起不良反应,影响患者的疾病预后。
多项研究表明,与非杓型血压相比,夜间血压可以更好的作为慢性肾脏病患者心血管事件及肾功能损伤的预测指标[23-24]。通过ABPM,我们发现纳入本研究的患者夜间血压未控制率高达83.5%。控制夜间血压对于延缓CKD合并高血压患者的疾病进展显得尤为重要。已有研究证实在慢性肾病和高血压患者中,睡前服用降压药可以使非杓型血压的CKD患者24 h尿蛋白明显减少[25],肾小球滤过率下降延缓,同时对抗心肌肥大,降低心血管事件的风险[26]。在最新的改善全球预后(Kidney Disease:Improving Global Outcomes,KDIGO)指南争议会议中也指出,使用ARB类降压药与改善CKD患者心血管结局相关,可降低蛋白尿,保护肾功能[27]。为了更好地控制夜间血压,本研究纳入了43例CKD合并高血压患者至少将一种ARB类或者CCB类降压药改为睡前服用,随访3个月后发现,与晨起服用降压药物的患者比较,睡前服用降压药物的患者的尿蛋白和尿酸较改药前有明显改善。提示改变降压药服用时间可能通过恢复患者血压正常昼夜节律,减少尿蛋白的排泄与尿酸在体内的沉积。近几年,几项前瞻性的研究证实,睡前服用ACEI/ARB类降压药可以更好地实现降低夜间血压和恢复杓型血压模式这两项治疗目标,有效改善总体血压控制,最重要的是降低了心血管疾病(包括心肌梗死、缺血性脑卒中和出血性脑卒中)的发病率和病死率[28-29]。CKD合并高血压的患者普遍存在夜间血压不下降的现象,而睡前服用降压药的抗高血压“计时”疗法可以通过降低夜间血压恢复血压正常的杓型节律,优化降压治疗效果,减轻尿蛋白的排泄,延缓肾功能损伤,减少尿酸在体内的沉积。目前对于在CKD合并高血压患者中通过改变降压药物服用时间对肾脏病临床治疗效果的影响在国内的研究尚少,需要更多的研究者去充分利用高血压时间治疗学的特点,探讨最佳的服药时间,使药物作用与血压波动节律相一致,平稳控制夜间血压,减轻并发症,延缓肾脏病进展。
综上所述,CKD合并高血压患者的异常血压节律及特殊类型高血压的发病率较高,其中非杓型或反杓型血压患者的微炎症状态更明显、贫血程度更重。年龄、hs-CRP是血压昼夜节律异常的独立危险因素,且血红蛋白越低的患者往往更容易发生非杓型血压。通过动态血压监测能够准确地测定患者24 h血压水平和昼夜节律变化,早期识别特殊类型血压。再结合高血压时间治疗学观点制定个体化的降压方案,恢复血压正常的昼夜节律,以更好的管控血压。而改变降压药服用时间是否可以改善微炎症状态、减轻贫血程度、延缓CKD进展等靶器官的损害仍需进一步的研究去探讨。

