经颈静脉肝内门体分流术治疗土三七所致肝窦阻塞综合征1例
胡乾坤 蒋旭华 王倩倩 陈良 黄玉仙
患者,男,63岁,退休职工。因“腹胀、纳差、腹围增大1月余”于2019年6月25日至上海市公共卫生临床中心就诊。患者发病前1月曾间断服用自制“三七药酒”治疗腰腿痛,后逐渐出现腹胀、纳差、腹围增大,伴双下肢水肿,无发热、畏寒、寒战,无恶心、呕吐,无呕血、黑便等不适。患者入院前10 d至当地医院就诊,查血常规:PLT 93×109/L;肝功能:ALT 218 U/L,AST 154 U/L,Alb 30 g/L,TBil 32.1 μmol/L,DBil 17.9 μmol/L;凝血功能:PT 17.5 s,INR 1.53;腹部超声示腹腔大量积液。当地医院予腹腔穿刺抽液,腹水常规、生化检查未见异常,腹水细菌培养:阴性。予保肝、利尿、输注白蛋白等治疗7 d,患者腹胀、纳差症状无改善。复查PLT 86×109/L,ALT 118 U/L,AST 124 U/L,Alb 32 g/L。患者为求进一步诊疗转入我院。患者无吸烟、饮酒史,否认病毒性肝炎病史。
入院查体:体温36.8℃,脉搏77次/分,呼吸20次/分,血压130/76 mmHg;神志清,精神可;皮肤、巩膜轻度黄染,肝掌(-),蜘蛛痣(-),肝颈静脉回流征(-);心肺听诊无异常;腹膨隆,无腹壁静脉曲张,腹软,无压痛、反跳痛,肝脾肋缘下未触及,移动性浊音(+)。辅助检查:血常规:WBC 4.44×109/L,Hb 154 g/L,PLT 73×109/L;炎症指标:ESR 20 mm/h,CRP 7.86 mg/L,PCT 0.19 ng/mL;肝功能:ALT 148 U/L,AST 127 U/L,ALP 85 U/L,γ-GT 126 U/L,TBil 45.4 μmol/L,DBil 25.9 μmol/L,Alb 33 g/L,Glo 26 g/L,白球比例1.27;肾功能:Cr 84.1 μmol/L,eGFR 84.7 mL/(min×1.73 m2);凝血功能:PT 21.3 s,INR 1.86。HAV、HBV、HCV、HDV、HEV、梅毒、HIV、CMV、EBV血清免疫学检查均阴性,抗核抗体谱(-)。腹水常规:淡黄色,微浑,白细胞手工计数 155×106/L ,红细胞手工计数 2000×106/L,单个核细胞百分比 85.0% ,李凡他试验(+);腹水生化:总蛋白22 g/L,白蛋白14 g/L, 腺苷脱氨酶8.9 U/L,血清-腹水白蛋白梯度>11 g/L;腹水细菌、分枝杆菌、真菌涂片及培养均阴性。腹部超声:肝脏形态基本正常,肝脂肪轻度浸润;门静脉扩张、流速减低;腹腔大量积液。腹部CT:肝脏体积尚可,表面光滑,各叶比例匀称,肝裂增宽。肝实质密度均匀;增强扫描动脉期肝左、右叶血管纤细,血管分支显示不佳,肝实质未见明显强化;门静脉期肝左、右叶主干显示清晰,远端变细、显示不清,肝实质呈“地图状”不均匀强化(图1A)。进一步行经颈静脉肝穿刺活检,病理提示肝小叶部分肝细胞疏松化,肝窦扩张、充血,可见灶片融合性肝细胞坏死伴液化,汇管区炎性细胞浸润(淋巴细胞为主),轻度纤维组织增生,不除外小静脉或小胆管阻塞性肝损伤(图2)。综合考虑患者诊断为肝窦阻塞综合征。予还原型谷胱甘肽、丁二磺酸腺苷蛋氨酸保肝退黄,螺内酯、呋塞米利尿,特利加压素降低门静脉压力,前列地尔改善微循环,低分子肝素钙抗凝,哌拉西林钠他唑巴坦抗感染,补充人血白蛋白等治疗。患者腹胀、纳差等症状无改善,腹水难以纠正,同时PLT降低至52×109/L,TBil上升至73.7 μmol/L,Cr上升至119.4 μmol/L,eGFR降低至56.5 mL/(min×1.73 m2)。经院内多学科会诊后,于2019年7月14日行经颈静脉肝内门体分流术(transjugular intrahepa-tic portosystemic shunt,TIPS)治疗。患者门静脉压力由术前23 mmHg下降至术后14 mmHg,腹水明显消退。术后口服利伐沙班抗凝,期间复查血常规、肝肾功能等均明显改善,予办理出院。1月后随访,查PLT 82×109/L,ALT 44 U/L,TBil 25.4 μmol/L,Cr 58.6 μmol/L,eGFR 128.6 mL/(min×1.73 m2),PT 18.4 s,INR 1.72;腹部CT所见肝实质密度较均匀,动脉期肝实质强化程度较低,门静脉期肝右叶强化略低于肝左叶,门静脉-下腔静脉支架置入(图1B)。3月后随访,患者一般情况可,腹部B超示门静脉至下腔静脉支架内血流通畅。
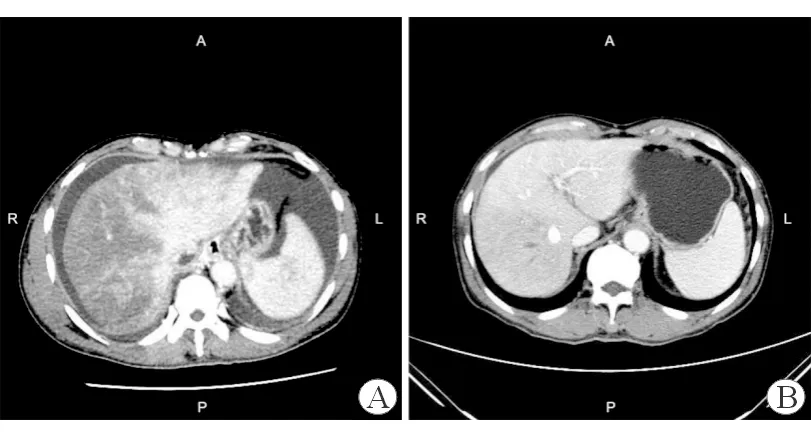
A:入院时腹部CT检查示门静脉期肝实质呈“地图状”不均匀强化;B: TIPS治疗1月后复查腹部CT示肝实质密度较均匀,门静脉期肝右叶强化略低于肝左叶,门静脉-下腔静脉支架置入
讨论肝窦阻塞综合征(hepatic sinusoidal obstruction syndrome,HSOS),也称肝小静脉闭塞病(hepatic veno-occlusive disease, HVOD),是由各种原因导致的肝血窦、肝小
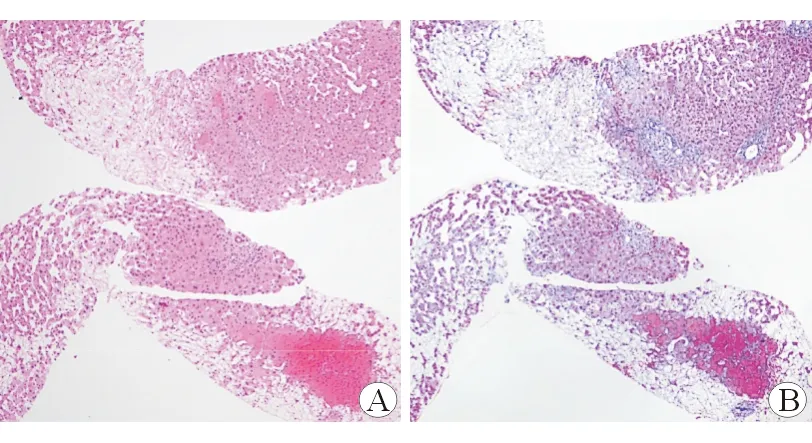
A:HE染色(40);B:Masson染色(40)。肝小叶部分肝细胞疏松化,肝窦扩张、充血,可见灶片融合性肝细胞坏死伴液化,汇管区炎性细胞浸润(淋巴细胞为主)
静脉和小叶间静脉内皮细胞水肿、坏死、脱落进而形成微血栓,引起肝内淤血、肝损伤和门静脉高压的一种肝脏血管性疾病[1]。国外报道的HSOS病因多与造血干细胞移植(hematopoietic stem cell transplantation,HSCT)前应用大剂量细胞毒性药物有关[2-3],而在国内误服含有吡咯生物碱(pyrrolidine alkaloid, PA)的中草药如土三七、野百合、千里光等是导致该病的主要原因[4-5]。本例患者发病前1月有“三七药酒”服用史,持续性腹胀、肝区疼痛和腹水,血清TBil升高,腹部CT示门静脉期肝实质呈“地图状”不均匀强化,同时肝组织病理活检提示肝窦扩张、充血,可见灶片融合性肝细胞坏死伴液化。参照《吡咯生物碱相关肝窦阻塞综合征诊断和治疗专家共识意见(2017年,南京)》[1],符合PA相关HSOS诊断。
目前,尚无治疗PA相关HSOS的特效方法。国内研究表明PA相关HSOS在保肝、利尿、改善微循环等对症处理的基础上联合抗凝药物可以提高治愈率或好转率[5-7]。然而,本例患者在转入我院后联合低分子肝素抗凝治疗,门脉高压性腹水仍难以纠正,同时肝肾功能进行性恶化。分析原因如下:①患者误服土三七的时间较长,PA在肝内转换为有细胞毒性的代谢产物,造成了肝窦内皮细胞和肝细胞的持续性损伤。②患者在当地医院就诊时,未及时进行抗凝治疗。
TIPS能否用于治疗HSOS尚存在争议[8]。国内一项研究报道23例PA相关HSOS患者,在对症处理或联合抗凝治疗无效后行TIPS治疗,术后1周22例出现腹水明显消退,仅1例死于TIPS并发症,随访期22例均存活[9]。国外研究则认为,TIPS虽然能够降低HSCT相关HSOS患者门静脉压力、减少腹水生成,但不能提高HSCT相关HSOS患者的远期存活率[10]。造成上述研究结果不一致的原因可能是国内HSOS通常由误服含PA的中草药所致,患者多无致病性基础疾病;而国外HSOS多发生在骨髓移植、放射性肝病、实体肿瘤化疗或肝移植术后,患者基础情况差。本例患者在对症处理联合规范抗凝治疗过程中,血清ALT、TBil持续异常、PLT和eGFR呈进行性下降趋势且腹腔积液难以纠正。经TIPS治疗后,患者持续门静脉高压和顽固性腹水得到有效控制,提示TIPS治疗对PA相关HSOS有治疗价值。

