沉默USP9X对肝癌HepG2细胞周期和自噬的作用机制
刘晓岗 沈预程 刘春桂 吉浩明
去泛素化酶USP9X(ubiquitin-specific protease 9X,USP9X)是泛素特异性蛋白酶家族(ubiquitin-specific protease, USP)的主要成员,可通过去泛素化靶向蛋白广泛参与细胞多种生物学过程,包括细胞凋亡以及信号转导等[1-2]。已有研究揭示USP9X与宫颈癌、膀胱癌等多个系统的肿瘤发生发展密切相关[3-4]。而在肝癌的研究中,USP9X基因下调可通过诱导肝癌细胞凋亡进而抑制肝癌的发展[5]。但由于肝癌的病理活动较为复杂,USP9X基因对肝癌细胞的调控应需更全面深入的研究。本研究采用siRNA(small interfering RNA,siRNA)技术对肝癌HepG2细胞株的USP9X沉默表达,进一步探讨USP9X基因沉默对肝癌细胞的增殖和自噬的影响,为更全面地揭示沉默USP9X对肝癌细胞功能的调控机制。
资料与方法
一、材料与试剂
人肝癌HepG2细胞株购买自中国科学院上海细胞库,RPMI1640培养基购买自美国Gibco公司。胎牛血清购买自德国PAN公司。MTT试剂盒、胰蛋白酶、BCA蛋白测定试剂盒、ECL发光液以及二抗均购买自上海碧云天生物公司。兔源抗USP9X、LC3-II、Beclin-1以及β-actin抗体均购买自武汉三鹰生物公司。脂质体LipofectaminTM 2000的试剂盒购买自美国Invitrogen公司。质粒DNA纯化试剂盒购买自美国TIANGEN公司。合成siRNA交由上海吉玛生物公司。
二、试验方法
(一)细胞培养和分组 将冻存于-80℃冰箱中的肝癌HepG2细胞复苏后,接种在含有10%胎牛血清的RPMI1640培养基中,2~3 d进行换液,置于37℃的细胞孵育中。待细胞生长至80%以上,采取0.25%胰蛋白酶进行消化传代。本研究根据是否沉默USP9X处理细胞,将实验分为:(1)NC组:将阴性对照链siRNA转染细胞;(2)siRNA组:将编码USP9X的siRNA转染细胞,转染48 h收集细胞,用于蛋白免疫印迹检测和流式细胞术检测。
(二)沉默USP9X质粒的设计合成 根据GenBank中USP9X的基因序列,使用小干扰RNA设计软件,USP9X的siRNA的正向序列为5′-UUCUCCGAACGUGUCACGUTT-3′,反向序列为5′-ACGUGACACGUUCGGAGAATT-3′。而阴性对照链的正向序列为5′-AGAAAUCGCUGGUAUAAA-UUUTT-3′,反向序列则为5′-AAAUUUAUACCAGCGAUU UCUTT-3′。USP9X的siRNA合成交由上海吉玛生物公司完成。
(三)细胞转染及分组 本研究设立对照组(Control)和转染组(siRNA),对照组采用阴性对照链的RNA进行转染,转染组再用Efp的siRNA干扰质粒进行转染,转染时每组细胞设6个复孔,细胞铺满孔内80%以上后采用脂质体LipofectaminTM2000方法进行细胞转染。转染首先采用无血清DMEM培养基6 h,然后再将培养基换为10%胎牛血清后继续培养48 h,其余过程均按照说明书指示进行。
(四)MTT试剂盒检测细胞增殖能力 将HepG2细胞以密度5103个/孔接种在96孔板中,待细胞转染siRNA的时间为0、24、48和72 h时,将细胞依次进行一下处理:洗涤3次、每孔加入100 μL培养基、再加入10 μL MTT溶液、将96孔板置于细胞孵育箱孵育2 h、弃上清液、最后加入DMSO溶液孵育10 min,将细胞置于酶标仪中检测吸光度,最终换算为细胞的增殖率
(五)流式细胞术检测细胞周期分布 将HepG2细胞以1106个/孔接种在6孔板中,待细胞生长至80%以上,根据实验设计采用干扰siRNA转染细胞48 h。首先洗涤细胞、采用胰蛋白酶消化重悬细胞、离心、弃上清,将此步骤重复2次后,在加入1 mL预冷的75%乙醇固定、将细胞置于4℃冰箱过夜。次日清晨采用RNA酶处理细胞、采用碘化丙啶处理细胞、置于流式细胞仪下检测细胞周期分布。
(六)Western blot检测USP9X、IL3-II以及Beclin1蛋白的表达 细胞分组处理步骤同前,首先加入蛋白裂解液后提取各组细胞的总蛋白,严格按照BCA说明书检测蛋白浓度,再将待测蛋白进行电泳、转膜、5%牛奶封闭2 h后,采用USP9X、IL3-II以及Beclin1一抗4℃孵育蛋白条带。次日将条带洗涤后,再将条带浸没在二抗中室温孵育,最终避光加入ECL发光液记录分析相关蛋白的表达。
三、统计学处理
采用SPSS 19.0 统计软件分析,各组的比较采用t检验,计量资料均采用均数±标准差表示,P<0.05表示差异有统计学意义。
结 果
一、沉默USP9X显著抑制肝癌HepG2细胞的增殖率
图1结果揭示,肝癌HepG2细胞株的siRNA组中USP9X蛋白表达为0.44 ± 0.15,明显低于NC组的1.00±0.00,差异具有统计学意义(图1A,P<0.05),此结果提示干扰siRNA成功转染至肝癌HepG2细胞株中,并且显著干扰HepG2细胞中USP9X的基因表达。而MTT增殖试剂盒结果揭示,肝癌HepG2细胞株中siRNA组的细胞增殖率在24、48和72 h时为0.0873 ± 0.0131、0.1047 ± 0.0128和0.1203 ± 0.0148,分别明显低于NC组的0.1113 ± 0.0083、0.1333 ± 0.0062和0.1610 ± 0.0080且差异有统计学意义(图1B,P<0.05)。该结果进一步提示沉默USP9X可呈时间依赖性的抑制肝癌HepG2细胞的增殖能力,但具体机制仍需更全面实验探索分析。
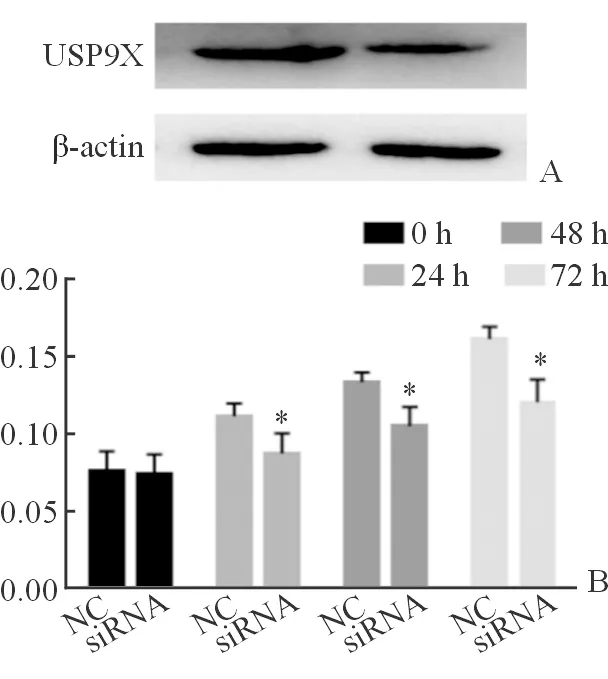
A: 各组HepG2细胞中USP9X蛋白的表达;B: 沉默USP9X对HepG2细胞不同时间点增殖能力的影响;*: 与NC组比较,P<0.05,差异具有统计学意义
二、沉默USP9X显著阻滞HepG2细胞由G0-G1期向S期转化
流式细胞术结果揭示,siRNA组中处于G0-G1期HepG2细胞的数量占总数量的72.32% ± 1.53%,显著高于NC组的56.30% ± 3.47%,且差异具有统计学意义(P<0.05)。而siRNA组处于S期的HepG2细胞的数量比为20.53% ± 0.66%,显著低于NC组的37.73% ± 1.82%,且差异具有统计学意义(P<0.05)。这些数据进一步说明了沉默USP9X可通过阻滞细胞G0-G1期向S期的转化进而抑制肝癌HepG2细胞的增殖。
三、沉默USP9X显著诱导HepG2自噬基因LC3-II以及Beclin1蛋白的表达
图2结果揭示,siRNA组中肝癌HepG2细胞的LC3-II和Beclin1蛋白表达为1.47 ± 0.11和1.48 ± 0.19,明显高于NC组的1.00±0.00,差异具有统计学意义(图2A,P<0.05),此结果说明沉默USP9X明显诱导细胞自噬反应进而调控肝癌HepG2细胞的功能。

A: 各组HepG2细胞中Beclin-1和LC3-II蛋白的表达
讨 论
越来越多的研究表明去泛素化酶DUB家族可通过调节关键蛋白降解而广泛参与肝癌的病理过程[5-7]。已有研究证实沉默USP9X可通过下调Mcl-1蛋白的表达从而诱导肝癌细胞的凋亡[8]。但由于肝癌的发生发展与细胞凋亡、增殖以及自噬等多个生物学过程密切相关,我们应更深入全面地研究USP9X对肝癌细胞的调控机制。
本研究结果显示肝癌HepG2细胞株的siRNA组中USP9X蛋白表达明显低于NC组(P<0.05),MTT结果提示沉默USP9X可呈时间依赖性地抑制肝癌HepG2细胞增殖能力,最终改善肝癌的发生(P<0.05)。进一步地,流式细胞术结果揭示siRNA组中处于G0-G1期HepG2细胞的数量占比显著高于NC组(P<0.05),而siRNA组处于S期的HepG2细胞的数量比显著低于NC组 (P<0.05)。此结果提示采用干扰siRNA技术在体外沉默肝癌HepG2细胞中USP9X基因的表达,增殖反应主要受细胞周期调控,其中S期为细胞DNA复制、合成阶段,其与细胞分裂密切相关,并且USP9X可显著阻滞细胞从G0-G1期向S其转化从而抑制HepG2细胞的增殖。因此,USP9X 在肝癌细胞中表达上调,抑制 USP9X 表达可促进肝癌细胞凋亡,阻止肝癌细胞生长。
此外,siRNA组中肝癌HepG2细胞的LC3-II和Beclin1蛋白表达均显著高于NC组(P<0.05),此结果说明沉默USP9X明显诱导细胞自噬反应进而调控肝癌HepG2细胞的功能。自噬是真核生物中的一种溶酶体降解系统,能够降解长寿蛋白和破损的细胞器,可维持内环境稳态。自噬在肝癌的病理过程中具有双重作用,既可以诱导细胞死亡进而抑制肝癌的形成,又可以在保护应激状态下的肿瘤细胞从而促进肝癌的转移[9]。但大多数研究认为抑制自噬可诱导肝癌发生,而Beclin1和LC3-II基因则可代表自噬启动和活化的标志[10]。本研究实验发现siRNA组中的Beclin1 和LC3-II蛋白的表达,进一步提示USP9X可诱导细胞的自噬从而影响肝癌细胞的功能。
综上所述,本研究验证了沉默USP9X通过阻滞细胞周期进程和诱导细胞自噬发生,从而抑制肝癌的病理过程。但基于肝癌复杂的病理机制和自噬在肝癌进展中的双重效应,我们认为仍需进一步完善USP9X对肝癌细胞生物学作用的研究,而本研究的相关数据也为肝癌研究提供了可靠的理论依据。

