热缺血损伤猪肝脏在门静脉恒压和恒流模式下常温机械灌注的对比研究
何锡然 谭晓宇 张琳 邝伟键 刘华敏 陈素平 郭家钘 梁铭炬 周伟津 霍枫
肝移植已经成为终末期肝脏疾病的主要治疗手段[1-2]。伴随肝移植手术例数的激增,供肝相对短缺的问题日益突出。因此,移植中心已经越来越多地转向于使用扩展标准供体和心死亡供体(donation after circulatory death,DCD)的器官。目前,中国42.98%的器官供体属于DCD[3]。但是传统的静态冷保存并不能有效保存DCD肝脏,而且长时间的冷保存会增加缺血再灌注损伤、移植物早期功能障碍、原发性无功和缺血性胆管病的发生风险,导致移植失败和患者死亡[4-5]。
体外常温机械灌注(normothermic machine perfusion,NMP)作为一种新的保存技术,近几年已进入临床试验阶段[6-8]。但是,该技术操作难度较大,且缺乏统一的实施标准,包括灌注温度、灌注液配方及灌注控制的模式等[9]。目前,NMP模式主要为压力控制[10]。在压力模式下,由于门静脉的压力较低,一旦压力测量出现偏差,会对流量造成较大的影响,过低的流量会导致肝脏营养供应不足,过高的流量会导致肝窦过度扩张,从而导致剪应力,破坏内皮细胞线性,进而会干扰实质细胞的保存效果,提示门静脉恒流模式可能更有利于肝脏灌注。因此,本实验对比门静脉恒压和恒流模式下对热缺血60 min肝脏常温灌注的效果,初步探索两种模式在供肝保存上的差异。
资料与方法
一、实验动物
健康巴马小型猪12只,雌性,体质量45~50 kg,由解放军南部战区总医院(陆总)动物实验中心提供。每头实验猪既用作血液的供体,又用作肝脏的供体。实验操作过程符合动物实验的伦理要求。
二、实验方法
(一)灌注设备 由广东顺德工业设计研究院(广东顺德创新设计研究院)、中国人民解放军南部战区总医院、广东丁沃生医疗器械有限公司联合研发的常温机械灌注设备(DEVOCEAN-LIVER 2000)可以对离体肝脏进行肝动脉和门静脉双重灌注,主要构建部件如下:2个离心泵;2个氧合器;温度传感器;2个压力传感器;2个流量传感器;2个滤血栓;温控水箱;自制的储肝器、自制的灌注管路以及自制门静脉、肝动脉、胆管插管等。
(二)猪血液及肝脏获取 在诱导麻醉后,猪耳缘静脉留置套管针建立输液通道,利用微量注射泵以每小时2~5 mg/kg的剂量泵入丙泊酚维持麻醉。气管插管,连接呼吸机。腹部正中线切口进腹,游离腹主动脉、下腔静脉及门静脉。于腹主动脉和下腔静脉置入已剪开口的16-Fr导尿管取血,血液过滤去除白细胞。静置实验猪60 min。热缺血60 min后,结扎胸主动脉,于腹主动脉和门静脉置入插管,进行在体冷灌注。快速取下肝脏,修整肝门区多余组织,剔除肝门区域的淋巴结,进行肝动脉和胆道插管,记录肝脏重量。
(三)常温机械灌注液和常温机械灌注参数设定 灌注液由猪全血1500 mL,150 mL羟乙基淀粉130/0.4电解质注射液,800 U肝素钠注射液,1 g注射用头孢西丁钠组成。灌注之前灌注管路内用150 mL羟乙基淀粉130/0.4电解质注射液混合部分全血进行预充,排除管路中的气泡。肝脏连接仪器,门静脉恒压组(n=6),门静脉压力设定为6~8 mmHg,门静脉恒流组(n=6),门静脉流量设定为0.5 mL/min/g。两组肝动脉均采用恒压脉冲式灌注,灌注压力为60/80 mmHg,灌注6 h,灌注温度为37℃。记录冷缺血时间(从在体冷灌注至肝脏上机所需的时间)。
(四)观察指标 灌注过程中每2小时取灌注液,离心后留血浆进行血气及生化检测,分析酸碱度、血糖、乳酸、尿素氮、TBil、ALT、乳酸脱氢酶、碱性磷酸酶、γ-谷氨酰转肽酶等指标变化趋势。记录灌注过程中每小时产生的胆汁量。灌注过程中,每2小时取肝组织留作组织病理学检查,根据铃木评分以及其他文献介绍的办法,从淤血、空泡化、坏死、水肿以及肝窦扩张等方面进行评分,每个方面分为无、轻度、中度和重度,分别评分0、1、2、3,每张切片随机选取3个视野进行双人评分,最后统计每项得分以及总得分[11-13]。
三、统计学方法
采用SPSS 23.0统计学软件进行数据处理。正态分布的计量资料以(均数±标准误)表示,比较采用t检验,若方差不等,则采用近似t检验,若样本不服从正态分布则采用非参数检验,P<0.05为差异有统计学意义。
结 果
一、灌注前两组肝脏的对比
灌注前,门静脉恒压组的冷缺血时间为(100.50±24.32)min,门静脉恒流组的冷缺血时间为(83.50±26.51)min,(P>0.05),表明两组肝脏灌注前的缺氧情况无差异,两组可比。
二、灌注过程的血流动力学参数
两组肝动脉均采用恒压灌注模式,门静脉恒压组的平均肝动脉流量为(0.13±0.08)mL/(min·g)(肝重),而门静脉恒流组的肝动脉流量为(0.25±0.09) mL/(min·g)(肝重),其中灌注5 h和6 h两个时间点两组的肝动脉流量差异有统计学意义(P<0.05)(图1)。门静脉恒压组的平均门静脉流量为(0.78±0.19)mL/(min·g),而恒流组的则为(0.54±0.07)mL/(min·g),门静脉恒压组的平均门静脉压力为(7.59±0.17)mmHg,而恒流组的则为(5.16±0.84)mmHg,由于两组门静脉控制模式不同,未对门静脉流量和压力进行比较。
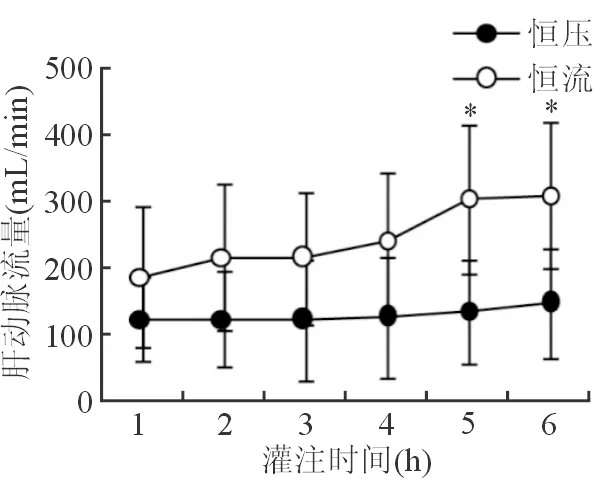
图1 离体猪肝常温机械灌注过程中肝动脉流量
三、灌注过程两组血气生化指标以及胆汁生成量对比
在灌注过程中,两组的pH值均稳定维持在生理值水平附近,差异无统计学意义(P>0.05)。乳酸水平在恒流组中较低,但两组在灌注过程的比较差异无统计学意义(P>0.05)。两组的血糖水平均呈先升高后下降的趋势,但差异无统计学意义(P>0.05)。而两组的BUN在灌注过程中逐步升高,说明两组肝脏能够进行正常的蛋白质代谢,除了灌注初期的第2小时,两组灌注后期的BUN水平比较差异无统计学意义(P>0.05)。在灌注过程中,两组的TBil 变化平稳,未出现明显上升,组间比较差异无统计学意义(P>0.05)。两组在灌注结束时(6 h)肝细胞酶学差异无统计学意义(P>0.05),提示两组肝细胞受损水平相当。恒压组6 h积累胆汁生成量为(6.98±3.20) mL,恒流组6 h积累胆汁生成量为(54.47±15.63) mL,两组的每小时胆汁累积生成量差异均有统计学意义(P<0.05)。见图2。

图2 离体猪肝常温机械灌注过程中灌注参数和代谢指标
四、灌注过程两组病理学的改变
灌注结束时,两组的铃木评分差异无统计学意义(P>0.05),但是恒流灌注组呈较有规律的下降趋势。从淤血、空泡化、坏死、水肿以及肝窦扩张等单项评分观察,虽然恒流灌注组在灌注结束时的平均值低于恒压组,但是差异无统计学意义(P>0.05)。病理改变见图3。

图3 离体猪肝常温机械灌注过程中的病理切片(×200) a-b. 猪肝脏门静脉恒压组NMP 0 h和6 h肝组织;c-d. 猪肝脏门静脉恒流组NMP 0 h和6 h肝组织
讨 论
目前国外的研究结果提示NMP比传统静态冷保存具有以下优势:①延长器官保存时间,②改善肝脏功能,③体外检测肝脏活力,④具有通过添加药物来修复受损肝脏的潜力,⑤完善肝移植的手术时间安排[4, 5, 14-16]。
本实验对NMP的门静脉灌注模式进行了初步的探索,对比了压力恒定和流量恒定两种模式对DCD肝脏常温灌注的影响。在冷缺血时间可比的前提下,两组灌注过程的血气和生化指标变化差异无统计学意义,说明相比主流的压力控制模式,流量控制模式未使肝脏出现明显的异常情况,而且各种指标变化均比较平稳,提示流量控制模式并不劣于压力控制模式的替代模式。在胆汁生成方面,流量控制模式似乎显露出其优势。在本研究中,门静脉恒流组的胆汁生成量比恒压组高,提示维持门静脉稳定的灌注可能更有利于肝细胞进行胆汁的合成。门静脉对血流的自身调节能力有限,而肝动脉则具有较强的血流自身调节能力。门静脉血流变化会引起肝动脉血流出现相应变化,即肝动脉缓冲效应,大量研究发现,小体积供肝移植术后早期,门静脉高灌注可引起肝动脉血流显著下降,从而导致胆道缺血、小叶微小血管脂肪变,最终导致移植肝细胞和胆管细胞坏死,再次减少有效肝体积[17]。控制门静脉流量更有利于维持肝动脉的流量,
从而更利于肝细胞以及胆管的供氧,进而更利于肝脏进行正常代谢。
在病理学方面,流量恒定模式的淤血、空泡化、坏死、水肿以及肝窦扩张的评分与压力恒定模式相当。Vekemans等[18]利用猪动物模型和低温机械灌注探索了流量对肝脏的影响,结果发现高流量组在灌注4 h后出现空泡,低门静脉流量联合氧气组在12 h后肝窦仍保持完整,空泡数量较少。而且低门静脉流量联合氧气组更有利于维持ATP水平。在组织病理学方面,高流量组灌注引起了更严重的肝窦扩张。说明低门静脉流量联合氧气组不仅有助于改善肝组织缺氧情况,而且能够在适当打开微循环的情况下维持肝实质的完整性。Hart等[19]利用鼠肝脏探索了低温灌注下最合适的压力,结果表明25%的压力可以达到100%的灌注,而且灌注24 h后,与50%的相比,25%的灌注压力导致的死细胞数量更少,以上结果表明较低的灌注压力不仅能够维持肝脏的有效灌注,而且能够减少内皮细胞的损伤,提示肝脏的离体灌注需要避免过量灌注。
综上所述,本实验对比了门静脉恒压灌注和恒流灌注在DCD肝脏上的灌注效果,结果表明流量控制模式并不劣于主流的压力控制模式,血气和生化指标稳定,而且流量控制模式可能更有利于肝脏的供血,从而促进肝细胞进行胆汁合成。由于目前尚无统一评价体外灌注肝脏质量的标准,因此项目组未来将开展动物肝移植实验以及临床肝移植试验,以进一步验证以上假设。

