番茄SlNBRP1基因的克隆及抗病性的研究
黄 曼, 于淑坤, 张 琳, 刘永胜, 苗 敏
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
番茄是一种世界性经济作物,在果蔬供应中占有举足轻重的地位。但由于植物的固着性,容易受到各种生物和非生物胁迫的影响,尤其是病原微生物的攻击对植物个体或群体造成的损伤较为严重。因此,植物在长期的进化过程中形成了复杂的免疫机制,以抵御病原微生物的伤害,维持正常生长和发育[1]。
植物的免疫机制可以分为两类:① 基础抗性,是植物通过识别来自病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)或微生物相关分子模式(microbe-associated molecular pattrns,MAMPs)所引发的免疫反应(PAMP-triggered immunity,PTI),是植物抗性的基础[2];② 基因对基因抗性,是通过寄主的抗性基因(R)识别病原体的无毒性基因(avr)引发的,如病原体效应因子引发的免疫反应(effector-triggered immunity,ETI)[3],往往伴随着细胞程序性死亡或过敏反应,是一种更加剧烈和有效的防御反应[4]。
ETI系统所产生的免疫受体都是由抗病R基因编码产生的,多数R基因由核苷酸结合位点(nucleotide-binding site,NBS)结构域和富含亮氨酸重复序列(leucine-rich repeat,LRR)结构域组成[5-7]。根据N端的信号肽的不同,将NBS-LRR基因划分为2种结构:一种类型包括TIR(Toll/白细胞介素-1受体类似结构),形成结构TIR-NBS-LRR;另一种类型包括编码卷曲螺旋(coiled-coil,CC)结构,形成CC-NBS-LRR结构[8]。
本文发现了番茄中的一个典型抗性基因,命名为SlNBRP1,以SlNBRP1基因的编码序列为靶标,构建植物表达载体pBI121-35S::SlNBRP1,并利用根瘤农杆菌介导法将重组基因转化到野生型番茄中,得到共抑制(co-suppression,CoR)转基因阳性植株。
通过在番茄幼苗上接种丁香假单胞菌番茄致病变种Pst DC3000,观察番茄植株病斑扩展与细菌生长状况,计算相同位置叶片1 cm2的菌落数。比较发现,共抑制转基因苗与野生型植株的差异较明显,表现出对病原菌的高度敏感,对病原菌的繁殖抑制作用降低,从而发现转基因植株SlNBRP1 CoR削弱了番茄抗病性,是番茄免疫反应的正向调控因子。
1 材料与方法
1.1 材料
野生型番茄(SolanumLycopersicumMill. cv. Aillsa Craig),由美国康奈尔大学THOMPSON植物研究所提供,后由本实验室繁衍保存。
限制性内切酶、Taq酶、高保真Pfu DNA polymerase、T4 DNA Ligase、pEASY Blunt Simple载体购自TaKaRa公司;TRIZOL购自Invitrogen公司;反转录试剂盒购自TOYOBO公司;琼脂糖凝胶回收试剂盒及质粒提取试剂盒购自Omega公司;引物由上海生工技术有限公司合成,测序由上海生工技术有限公司完成;植物组织培养试剂购自Sigma公司;其他试剂均为国药国产分析纯产品。
大肠杆菌(Escheriachiacoli) DH5α、根瘤农杆菌(Agrobacteriumtumefaciens)EHAl05、丁香假单胞杆菌(PstDC3000)、植物表达载体pBI121、pBTEX、植物绿色荧光蛋白融合表达载体pART27-GFP均由本实验室保存。
1.2 方法
1.2.1 基因在番茄中的组织差异性表达
从野生型番茄幼苗的根、茎、叶、花、不同发育时期的果实中提取总RNA,通过反转录得到cDNA。以这些cDNA为模板,以番茄UBI3基因作为内参基因(GenBank登录号:X58253),利用实时荧光定量聚合酶链式反应(polymerase chainreaction,PCR)的方法分析不同组织中SlNBRP1基因的表达情况。反应条件为:94 ℃ 30 s,94 ℃ 5 s,60 ℃ 30 s,42个循环。采用Step One Real-time PCR仪(AB Applied Biosystems)进行定量PCR反应,基因相对表达量采用2-ΔΔCt计算方法进行数据分析。
1.2.2SlNBRP1目的基因的克隆
根据番茄SlNBRP1基因序列(SGN登录号:Solyc05g008070.2.1)设计引物NBRP1-F1、NBRP1-R1、NBRP1-F2、NBRP1-R2,见表1所列,利用巢式PCR扩增SlNBRP1基因全长编码序列。反应条件为:94 ℃ 2 min,51 ℃ 20 s,72 ℃ 160 s,30个循环;72 ℃ 5 min,获取目的基因PCR产物。

表1 用于扩增SlNBRP1基因的PCR引物
1.2.3SlNBRP1基因过量表达载体的构建
以pBI121为植物表达载体,通过插入其多克隆位点区域构建SlNBRP1过量表达载体。用SmaⅠ和XhoⅠ限制性内切酶处理植物表达载体pBI121和基因SlNBRP1,利用T4连接酶连接并转入大肠杆菌DH5α感受态细胞,提取重组质粒并进行酶切鉴定阳性克隆[9]。将构建好的重组质粒命名为pBI121-35S::SlNBRP1,构建流程示意图如图1所示。

图1 植物表达载体pBI121-35S::SlNBRP1示意图
1.2.4 SlNBRP1蛋白的亚细胞定位
将SlNBRP1基因的编码序列构建到含有增强绿色荧光蛋白(enhanced green fluorescent protein,eGFP)编码序列的载体上。利用农杆菌介导得烟草瞬时表达系统,在35S启动子的作用下,编码出有活性的SlNBRP1-eGFP融合蛋白,通过激光共聚焦显微镜观察细胞中绿色荧光的位置,进而确定SlNBRP1蛋白的亚细胞定位。
1.2.5 番茄的遗传转化及转基因植株阳性鉴定
将获得的重组质粒pBI121-35S::SlNBRP1通过冻融法转化导入农杆菌EHA105菌株中[10],番茄转化通过叶盘法进行[11]。获得转基因番茄植株后,利用CTAB法提取基因组DNA。pBI121载体中的卡那霉素抗性基因NPTⅡ(新霉素磷酸转移酶Ⅱ,GenBank登录号:AF485783)为筛选标记,设计引物见表1所列。PCR阳性鉴定扩增反应过程为:94 ℃ 5 min,94 ℃ 30 s,56 ℃ 30 s,72 ℃ 40 s,30个循环;72 ℃ 5 min。待阳性幼苗的根生长健全后移入田间栽培。
1.2.6 转基因植株的实时荧光定量PCR分析
按照1.2.1所述方法,提取野生型和转基因番茄植株T1代幼叶的总RNA,经反转录得到第1条cDNA。以番茄UBI3为内参基因(GenBank 登录号:X58253),根据表1所示的引物UBI3-F和UBI3-R以及NBRP1-qF和NBRP1-qR进行实时荧光定量PCR分析。
1.2.7 病原菌PstDC3000的抗病性分析
病原菌PstDC3000侵染诱导表型按文献[12]方法培养PstDC3000,低速离心收集菌体,用含10 mmol/LMgCl2的缓冲液稀释至OD600=0.000 01。挑选生长6周左右生长环境相同、长势良好的野生型和转基因植株,用真空渗透法[13]将稀释后的菌液分别注入番茄植株内,每个株系3个重复。按文献[14]方法取样,计算出单位面积叶片上PstDC3000菌落数量。
2 结果与分析
2.1 SlNBRP1基因生物信息学分析
SlNBRP1基因的编码区全长为2 511 bp,位于番茄8号染色体上,分别以ATG和TGA为起始和终止密码子,SlNBRP1基因编码836个氨基酸,相对分子质量为207 279.72,理论等电点为4.94。推测半衰期大于20 h,不稳定参数为35.09,属于稳定蛋白,蛋白质的亲水性平均数为0.705,表明SlNBRP1属于疏水性蛋白。脂肪指数为32.62。SlNBRP1蛋白的结构域分析如图2所示,其编码序列包含CC和NBS2个保守结构域,2个结构域均与植物抗病有关。

图2 SlNBRP1蛋白结构域分析
2.2 SlNBRP1基因表达的组织特异性分析
利用实时荧光定量 PCR仪分析SlNBRP1基因在不同组织中的表达量差异如图3所示,由图3可知,SlNBRP1基因在多数组织中均有表达,在番茄根、茎和红果中的表达量较低,在变色期的果实中表达量最高,在花中的表达量次之。

图3 SlNBRP1基因的表达模式分析
2.3 SlNBRP1蛋白的亚细胞定位分析
构建pART27-SlNBRP1-GFP融合表达载体,并转入农杆菌GV2260感受态细胞,将构建好的载体通过注射介导在烟草中进行瞬时表达。36 h后,取被注射区域的叶片下表皮细胞在激光共聚焦显微镜下进行绿色荧光的观察,同时,用DAPI对细胞核进行染色,从而确定细胞核位置,SlNBRP1蛋白定位在细胞质中,如图4所示。

图4 SlNBRP1蛋白的亚细胞定位
2.4 转基因植株的分子水平鉴定
利用实时荧光定量 PCR的方法,分析转基因植株叶片中SlNBRP1的表达水平。提取野生型和6个独立转基因植株的叶片总RNA,反转录得到cDNA,以此为模板进行实时荧光定量PCR分析,结果如图5所示,图5中,转基因株系与野生型株系有显著差异,**P<0.01,***P<0.001,下同。从图5可以看出,转基因植株中3个独立株系(CoR-1、CoR-2和CoR-3)SlNBRP1基因的表达量相对野生型植株在53%~75%范围内下调,初步判断转基因植株中出现了共抑制现象。
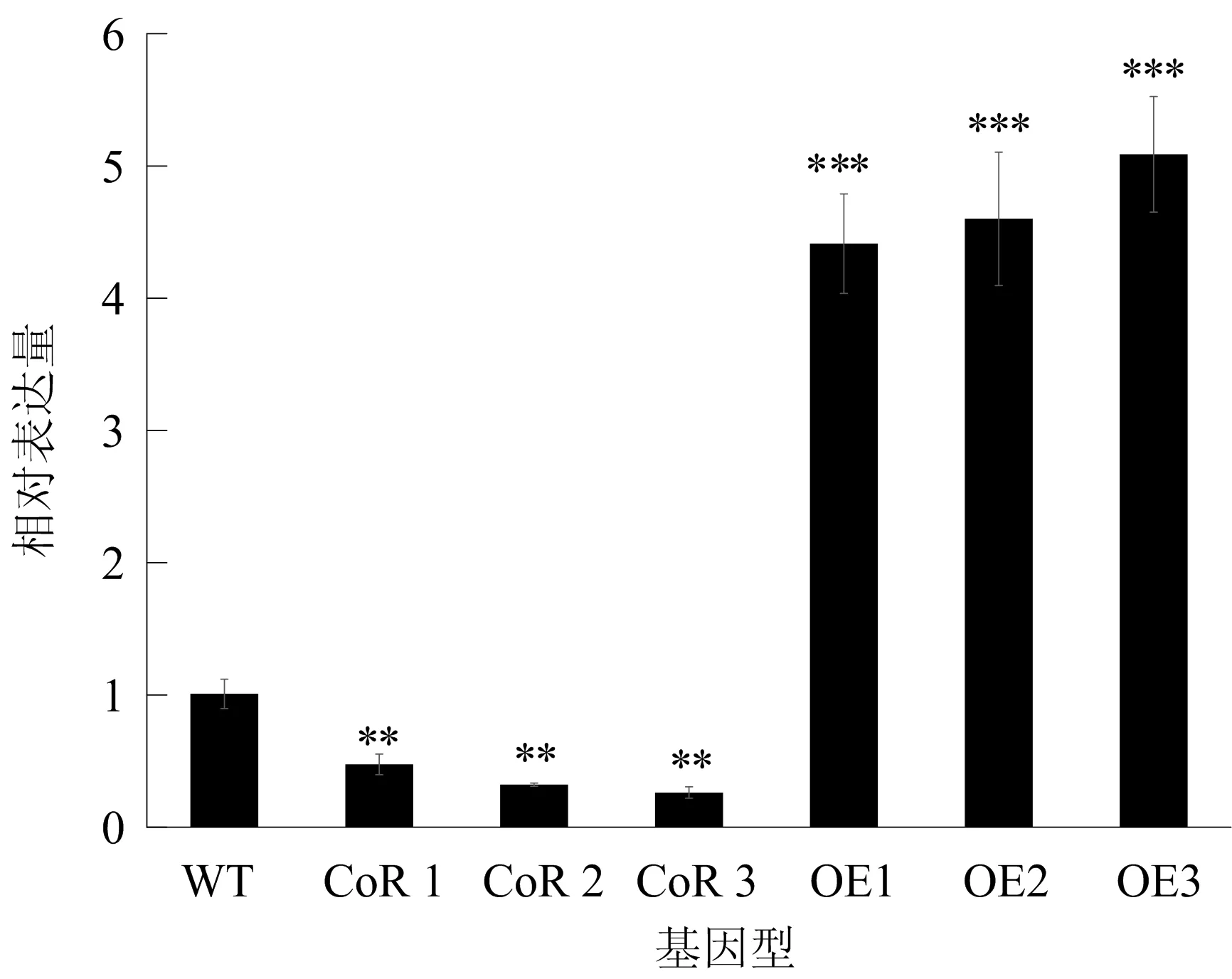
图5 转基因株系中SlNBRP1基因表达水平分析
2.5 转基因植株对Pst DC3000的抗病响应
为了研究SlNBRP1在番茄抗病防御过程中的作用,用相对低浓度(OD600=0.000 01)的PstDC3000渗透野生型植株与转基因植株,观察侵染后第2天和第4天植株的表型及叶片中细菌的生长情况,如图6所示。由图6可知,转基因株系叶片病斑性状比野生型更严重,说明SlNBRP1对PstDC3000具有一定的抵抗作用。


图6 番茄植株接菌发病情况
2.6 转基因植株菌落数量差异
按照1.2.8所述方法,统计野生型与转基因株系经PstDC3000菌液侵染2~4 d后叶片中的菌落数目如图7所示,由图7可知,转基因型植株与野生型相比,叶片菌落数显著增多,转基因株系菌落数与野生型株系菌落数差异显著。
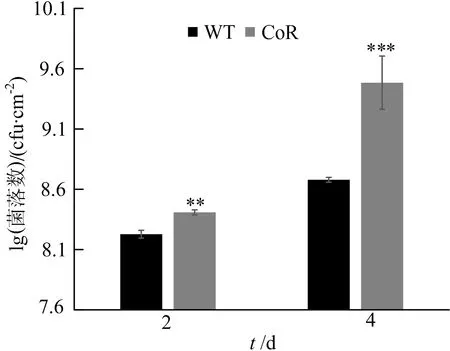
图7 菌落数差异分析
3 讨 论
植物病害是造成农业生产巨大损失的原因之一,因此在农业的可持续发展中,合理有效地治理植物病害至关重要。目前,在农业生产中,对植物病害的防治主要依赖于化学药剂,这不仅会带来食品安全问题,也会造成病原物抗性问题和环保问题。在育种中开发利用植物本身的抗病性可以有效解决病害问题。
本文通过采用根瘤农杆菌介导法将含有CC-NBS结构域的SlNBRP1转化到野生型的愈伤组织中,得到转基因番茄,结合定量分析判断转基因植株中出现共抑制现象,通过接种一定浓度的PstDC3000菌液发现共抑制转基因植物比野生型在一定程度上减弱了抗病能力。因此初步推断SlNBRP1在番茄的抗病防御过程中起正调控作用。探索R基因为揭示植物抗病机制奠定了重要的基础,通过利用R基因可以改进抗病育种、减少植物因病害造成的减产或劣质,从而实现农业的可持续发展。本文通过基因工程技术增强了番茄抗病性,提供了抗病分子靶标,提高了番茄种植的经济价值。随着生物技术的飞速发展,学科之间的交叉渗透,依据植物病理学和分子生物学的原理,越来越多的R基因将被克隆,人类对植物病害的认识和防治必将有跨越式的进步。

