醋氯芬酸相关的狼疮样病症及急性肾损伤
涂远茂 娄丽璇 梁少姗 谢红浪
病史摘要
患者81岁男性,因“水肿20余天,血清肌酐(SCr)升高10余天”于2019-05-24入院。
患者于5月初出现双下肢水肿,后尿量逐渐减少至约500 ml/d,水肿加重。5月13日外院查尿蛋白定量 2.6 g/24,尿隐血+,尿糖阴性;血清白蛋白 20.1 g/L、球蛋白 36.4 g/L,尿素氮14.0 mmol/L、SCr 366.0 μmol/L、尿酸 602 μmol/L,总胆固醇9.6 mmol/L、三酰甘油 2.59 mmol/L,二氧化碳结合力 16.6 mmol/L,钾、钠正常;血常规:血红蛋白 121 g/L、血小板 163×109/L、嗜酸性粒细胞3.5%,C反应蛋白 15.65 mg/L。CT示慢支伴左肺下叶炎症、肺气肿,胆囊炎、胆囊可疑结石;肾血管超声示双肾动脉硬化。予对症治疗病情无改善。5月22日国家肾脏疾病临床医学研究中心查尿蛋白定量 12.3 g/24h,尿沉渣红细胞(RBC) 219.3 /μl(非均一型),尿糖 4+。病程中有口干、眼干,无皮疹、脱发、光过敏、口腔溃疡等症状,体重增加约5 kg,食欲下降,夜尿2~3次/晚。
既往史有“痛风”病史30余年,主要累及双足大拇趾关节,反复发作,未降尿酸治疗,间断口服非甾体消炎药(NSAID)“非普拉宗”止痛;近半年发作频繁,2019年2月改服“醋氯芬酸肠溶片”(累积9.6g)。有“高血压病”病史6年余,最高血压 189/100 mmHg,服用“左旋氨氯地平”降压,血压控制在140/90 mmHg左右。2014~2018每年体检SCr波动于93.7~110.5 μmol/L,尿检蛋白阴性、潜血弱阳性;超声示左肾囊肿,双肾“沙粒样”结石,前列腺轻度增生。
体格检查体温 36.3℃,脉搏 89 次/min,呼吸 18次/min,血压157/85 mmHg,身高 162 cm,体重64 kg。神清,咽不红,扁桃体不大,心肺未见明显异常,腹部膨隆,移动性浊音阳性,右脚拇趾外翻,全身小关节未扪及结节,双下肢重度凹陷性水肿。双下肢不等粗,髌骨下15 cm腿围:左 37.5 cm,右36 cm。
实验室检查
尿液检查 24h尿蛋白定量 13.2g(尿量700 ml),尿沉渣RBC 154.8/μl(非均一型)、白细胞计数 37.4/μl,尿pH 7.0;尿生化 葡萄糖 14.7 mmol/24h(4+)、氨基酸92 mg/24h(参考值70~360 mg/24h)。肾小管功能:N-乙酰-β-D-氨基葡萄糖苷酶 56.8 U/(g·Cr)[参考值<9.7 U/(g·Cr)]、视黄醇结合蛋白 33.2 mg/L(参考值<0.7 mg/L)、胱抑素C 5.17 mg/L(参考值0.52~1.03 mg/L)。禁饮13h尿渗量402 mOsm/(kg·H2O)[参考值>800 Osm/(kg·H2O)];尿C3 36.9 mg/L(参考值≤2.76 mg/L)、尿α2-MG 17.2 mg/L(参考值≤3.98 mg/L)。肾衰指数2.35,钠滤过分数 1.6%。
血常规 血红蛋白111 g/L、网织红细胞0.55%、白细胞计数7.48×109/L、嗜酸性粒细胞0.3%,血小板计数284×109/L;
血生化 白蛋白21.7 g/L、球蛋白26.1 g/L,尿素氮23.8 mmol/L、SCr 513.6 μmol/L、尿酸 414 μmol/L、胱抑素C 4.45 mg/L,总二氧化碳 14.8 mmol/L、氯115.8 mmol/L、钾、钠正常、钙 1.72 mmol/L、磷 1.84 mmol/L,总胆固醇10.54,三酰甘油2.72 mmol/L,肝功能正常。铁代谢 血清铁 7 μmol/L、总铁结合力 9 μmol/L、不饱和铁结合力 2 μmol/L。空腹葡萄糖4.78 mmol/L;餐后2h葡萄糖8.1~10.6 mmol/L,糖化血红蛋白 5.2%。脑钠肽前体73.01 pmol/L,甲状旁腺激素110 pg/ml。
免疫学 抗核抗体(ANA)滴度1∶ 1 024、抗dsDNA阴性;抗核抗体谱:抗组蛋白蛋白(AHA) +++、余阴性;抗β2-糖蛋白1(β2-GP1)抗体 24.63 RU/ml(参考值<20);狼疮抗凝物 1.21(参考值≤1.2);抗心磷脂抗体谱、ANCA、抗GBM均阴性;抗C1q抗体阴性。抗磷酯酶A2受体(PLA2R)抗体阴性;抗1型血小板反应蛋白7A域(THSD7A)抗体40.2 ng/ml(参考值<60 ng/ml)。
淋巴细胞免疫分型 CD3+842个/μl、CD4+624个/μl、CD8+219个/μl、CD19+56个/μl、CD20+57个/μl。
体液免疫 IgG、IgA、IgM、IgE、IgG4、ASO、RF均正常;补体 C3 1.04 g/L、C4 0.377 g/L。
其他 肿瘤标志物阴性。
辅助检查
肾脏超声 左肾106 mm×48 mm×53 mm,右肾99 mm×45 mm×50 mm,肾皮质厚度正常,皮质回声正常,皮髓界限清楚,集合系统正常。左肾上极见一大小约44×47 mm类圆形无回声区,右肾中极见一大小约6×6 mm类圆形无回声区。
胸部CT (1)右肺中叶结节,考虑纤维硬结;右肺下叶小肺大疱。(2)双侧胸腔少量积液。(3)主动脉及冠状动脉粥样硬化。(4)纵隔多发小淋巴结。
腹部CT (1)腹盆腔多发渗出积液。(2)双侧肾周筋膜增厚。(3)肝内多发囊肿。(4)腹壁软组织水肿。(5)双侧胸腔积液。
心电图 窦性心动过速,102次/min。
心脏彩超 EF 65%,轻度主动脉瓣反流。
血管超声 双下肢动脉硬化伴斑块形成。
肾活检病理
免疫荧光 IgG++、C3++,IgG1++、IgG2+、IgG3+、IgG4++,κ轻链+、λ轻链+,呈颗粒状弥漫分布于血管袢,IgM+,呈颗粒状弥漫分布于系膜区及血管袢(图1A、B)。肾组织PLA2R染色阴性。
光镜 2/16肾小球球性废弃,余肾小球体积增大,毛细血管袢僵硬,多个球袢略皱缩。PASM-Masson:肾小球上皮侧少量嗜复红物沉积,偶见“钉突”形成。肾小管间质轻度慢性病变基础上中度急性病变,多灶性肾小管上皮细胞扁平、刷状缘脱落,小灶性肾小管上皮细胞浊肿、颗粒变性,管腔见少量蛋白管型、细胞管型,间质增宽、纤维化+,少量单个核细胞浸润,偶见中性粒细胞。小叶间动脉内膜增厚,小动脉节段透明变性,累及入球小动脉(图1C~E)。
免疫组化 肾间质浸润细胞分类计数CD4+100 个/mm2、CD8+136 个/mm2、B细胞 20 个/mm2,CD68+100 个/mm2、CD138+0。
电镜 上皮侧少量散在高密度电子致密物分布,系膜区偶见散在电子致密物分布。肾小球足细胞足突广泛融合(>90%),胞质少量微绒毛化,胞质内见吞噬性溶酶体(图1F)。
病理诊断:(1)肾小球膜性病变Ⅰ期;(2)肾小管间质急性损伤。
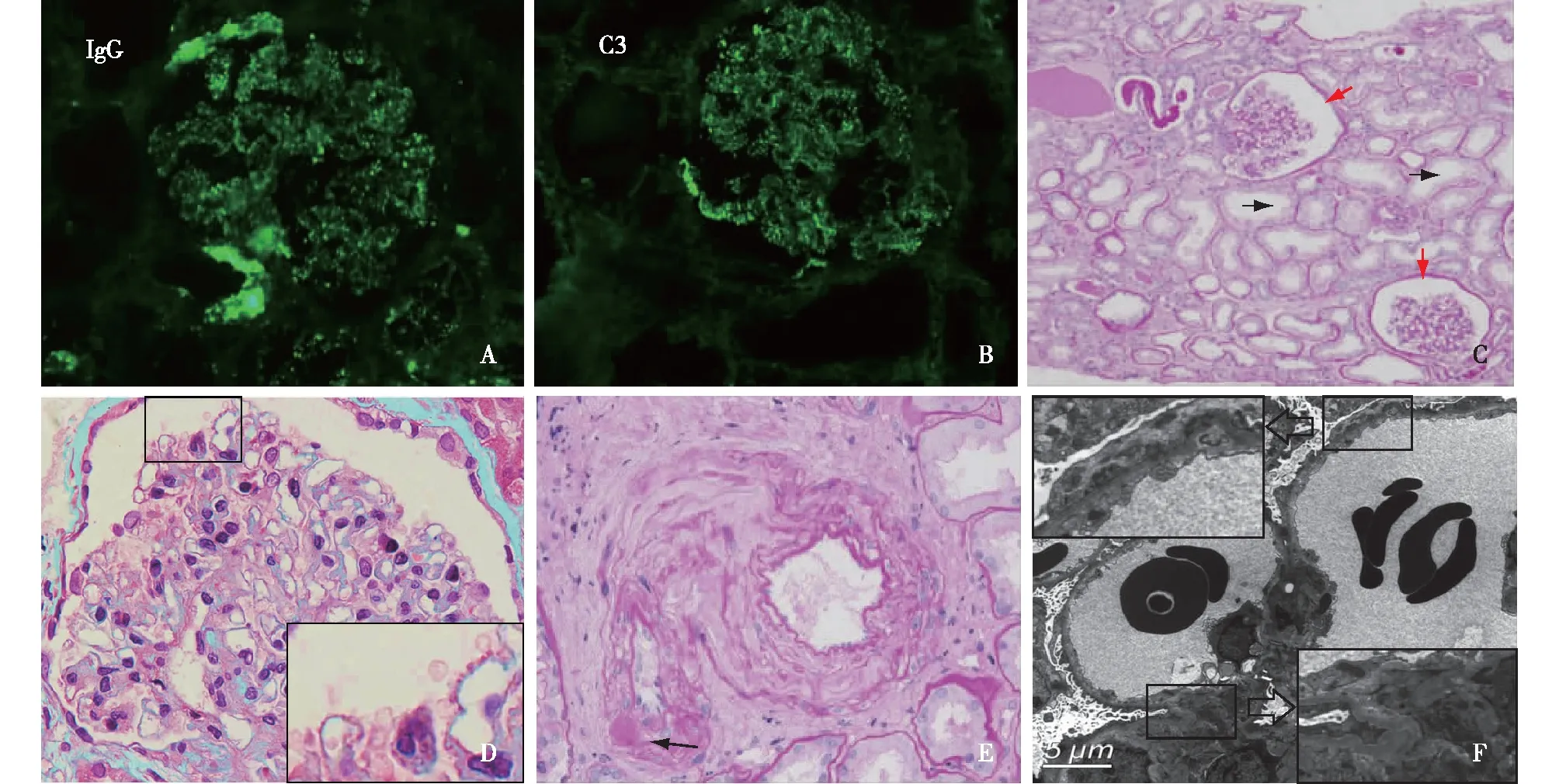
图1 肾活检病理改变A、B:免疫荧光 IgG++、C3++,呈颗粒状弥漫分布于血管袢(IF,×400);C:血管袢皱缩、包囊腔扩大(↑),肾小管间质急性病变(↑)(PAS,×100);D:部分肾小球体积增大,毛细血管袢僵硬,上皮侧嗜复红物沉积(见局部放大)(PASM-Masson,×400);E:小叶间动脉内膜增厚,动脉透明变性(↑)(PAS,×400);F:血管袢上皮侧少量、肾小球系膜区偶见散在电子致密物分布(见局部放大)(EM)
诊断分析和诊疗经过患者为81岁老年男性,长期高血压和痛风病史,长期口服NSAID治疗,但近年多次体检肾功能稳定、尿检阴性。此次在口服醋氯芬酸后突发肾脏损伤,表现为超大量蛋白尿伴少量镜下血尿,低白蛋白血症,尿量减少伴SCr进行性升高,ANA、AHA高滴度阳性,抗β2-GP1抗体和狼疮抗凝物轻度升高,但补体正常。病程中无典型的面部皮疹、关节痛、光过敏、不规则发热等表现。
入院后嘱停用醋氯芬酸。患者尿量少、水肿严重,SCr、尿素氮显著升高,予日间连续性肾脏替代治疗(CRRT)7次(5月26日~6月10日)稳定内环境。5月26日开始予泼尼松片30 mg/d口服;辅以依诺肝素4 000 U/d皮下注射预防静脉血栓形成、控制血压、纠正贫血等对症支持治疗;患者尿量逐渐增加、SCr下降(图2)。为明确肾脏病理特点和肾脏损伤原因,6月12日行肾穿刺活检。6月18日出院前复查尿蛋白水平、自身抗体滴度均显著下降(表1),予泼尼松片减量至20 mg/d。
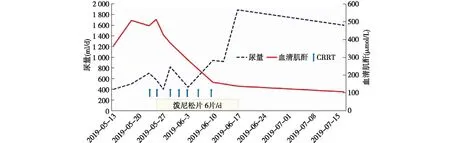
图2 病程期间尿量及血清肌酐变化CRRT:连续性肾脏替代治疗
肾脏病理示肾小球膜性病变,免疫荧光示IgG、C3沉积于肾小球血管袢,以IgG1和IgG4最强,但肾组织PLA2R染色阴性,结合血清抗PLA2R抗体以及抗THSD7A抗体均阴性,高度提示为继发性MN(membranous nephropathy,MN)。患者病程中未查及肿瘤、病毒感染、重金属中毒相关证据,不支持这些常见因素导致的继发性MN,结合ANA、AHA高滴度阳性,需重点排除狼疮性肾炎V型。老年男性狼疮性肾炎并非罕见,但患者除肾脏损害之外,无皮肤黏膜、关节、血液和心脏等系统明显受累,其他自身抗体阴性(包括抗ds-DNA抗体、抗Sm抗体)、补体C3、C4持续正常,不支持系统性红斑狼疮(SLE)的诊断。此外,狼疮性肾炎免疫荧光通常呈“满堂亮”,C1q阳性对诊断有提示意义,常有特征性的小管-间质部位沉积,此患者C1q为阴性、小管-间质未见免疫复合物,不符合典型的狼疮性肾炎特点。
患者在服醋氯芬酸缓释片(累积9.6g)3个月后出现急性肾脏损伤(AKI)伴ANA、AHA高滴度阳性,在停用醋氯芬酸和加用中等剂量糖皮质激素治疗后肾脏损害和自身抗体滴度均明显改善,支持药物性狼疮(drug-induced lupus,DIL)诊断,其肾小球膜性病变和急性肾小管间质病变考虑与醋氯芬酸相关;其轻度慢性病变和动脉硬化考虑与长期高血压以及老年肾脏退行性病变相关。
最后诊断(1)药物(醋氯芬酸)相关的狼疮样病症及肾脏损害;①急性肾损伤3期;②继发性MN;(2)痛风;(3)高血压病3级(极高危)
长期随访出院后逐渐减停激素。1月后(7月17日)门诊查尿蛋白降至 0.63 g/24h,尿糖阴性,SCr 105.2 μmol/L,ANA 1∶ 128、AHA阴性,泼尼松片逐渐减量并于2月内减停。监测肾功能恢复,尿蛋白、自身抗体持续阴性(表1)。

表1 实验室检验指标随访表
讨 论
狼疮样综合征与药物性狼疮狼疮样综合征是指未诊断SLE的患者由于多种原因引起ANA阳性和至少一种SLE的临床表现的综合征,致病因素祛除后症状可消失。药物导致的狼疮样综合征(DIL),是由环境因素在具有遗传易感性的个体中引发自身免疫现象的一个范例。目前已知有80多种药物可导致DIL,NSAID导致的狼疮样综合征也屡见不鲜[1-3],双氯芬酸、布洛芬、对氨基水杨酸、保泰松、美沙拉嗪等均有报道。醋氯芬酸是双氯芬酸的升级产品,在化学结构上比双氯芬酸多一个羧基,均为COX-2倾向性抑制剂。醋氯芬酸在体内代谢过程中少部分(12.9%±10.3%)转化成双氯芬酸原型,其他的代谢中间体和终末产物基本相同[4]。此病例在服用醋氯芬酸3个月后出现肾病综合征(NS)伴AKI以及血清ANA、AHA高滴度阳性,需警惕醋氯芬酸诱发的DIL。
目前尚无DIL特异性诊断标准,满足以下条件可支持诊断[2]:(1)既往无SLE病史;(2)有持续服用(至少1个月)可能诱发DIL的药物史;(3)用药过程中出现典型的狼疮临床表现和血清学改变;(4)停药后临床症状可缓解,血清学异常也可好转甚至恢复正常;(5)再次服药可使疾病复发。
DIL与SLE的临床特点存在显著差别[3]:(1)流行病学特点:DIL好发于老年人(>50岁),男女发病率为1∶ 1,而SLE好发于育龄期女性,男女比例1∶ 9;(2)起病模式:DIL常突然起病,而SLE多为逐渐进展;(3)临床表现:DIL较SLE轻,主要表现为关节炎、胸膜炎和心包炎,部分有皮肤受累表现为盘状红斑,但肾脏、神经系统和血液系统受累少见;(4)实验室检查:DIL主要为ANA和AHA阳性,其AHA阳性率>90%,而抗ds-DNA抗体阳性率<5%,罕有抗Sm抗体阳性及低补体血症;(5)预后:DIL具有可逆性,停用诱发药物后临床症状可逐渐消失,再次使用该药后,症状又反复出现,而SLE呈慢性病程,病情易反复。虽然本例患者以肾脏损伤为突出表现,但其临床特征更符合DIL的诊断标准,可以明确诊断为醋氯芬酸相关的DIL。迄今为止,尚未检索到醋氯芬酸导致DIL的报告,此病例为首次报道。DIL被认为是一种超敏反应,T细胞功能紊乱是导致疾病发生的重要机制,然而每个药物的特点各不相同[2-3]。NSAID导致自身抗体的具体机制目前尚不明确。
NSAID相关肾脏损伤NSAID导致的肾脏不良事件发生率仅为1%~5%[5],但此类药物应用广泛故临床病例并不少见。NSAID相关肾脏损伤常见病理改变包括急性间质性肾炎(AIN)、急性肾小管坏死(ATN)、慢性肾小管间质肾病以及各种肾小球病变。不同NSAID导致的肾损害可不同,但可重叠出现。在各类肾损害中,急性者多见于AIN或与其他药物[如血管紧张素转换酶抑制剂(ACEI)/血管紧张素Ⅱ受体拮抗剂(ARB)、利尿剂等]联用时出现的肾前性AKI,慢性者常表现为各类肾小球病变导致的大量蛋白尿或肾病综合征(NS),以微小病变肾病(MCD)和MN报告较多。
Ravnskov[6]总结了文献报道的97例NSAID相关肾脏损伤的临床特点。研究发现不同类型肾小球病变的患者接受NSAID治疗时长不同,肾炎表现(尿蛋白<1 g/24h)患者平均为1.7月,MCD和MN分别为8.2月和39月;治疗时长与肾小球免疫复合物沉积强度、足突融合程度和蛋白尿的水平成正比,与过敏反应表现、间质损伤和肾功能损害成反比。表现为MN者多合并风湿性疾病(自身抗体阳性)。多数患者预后良好,72例患者停药后,68例肾功能改善,其中 57例恢复正常。出现肾小球病变者以老年长期用药者多见,常合并自身抗体阳性,细胞因子损伤是其主要机制(表2)。此病例出现狼疮样综合征表现和肾小球膜性病变符合既往类似病例特点。Radford等[7]回顾总结了NSAID相关MN的特点,13例患者以中老年为主(平均年龄55岁),发病前中位用药时间为43周(4周~3年),其中92%表现为NS,平均尿蛋白高达10.2 g/24h,所有患者均无皮疹、发热等过敏表现,大部分患者停药后蛋白尿迅速减少。这些患者服用的药物有双氯酚酸、非诺洛芬,布洛芬,萘布美酮,萘普生和托米汀。回顾文献还见酮洛芬和舒林酸导致的MN报道,这样5大类NSAID导致的MN都有报道。这些不同药物均可导致MN表明其机制可能涉及NSAID对炎症介质的共同药理作用。药物导致的MN和特发性MN在病理特点上无法鉴别,更多的需要结合患者的用药史以及其他临床特点来判断。作者提出的诊断标准如下:(1)服用常规剂量NSAID后出现NS表现;(2)除外其他已知的导致MN的继发因素;(3)停用NSAID后NS迅速缓解,且随访期间无蛋白尿复发。此病例临床特征与文献报道NSAID相关MN基本一致,符合诊断标准,醋氯芬酸相关MN诊断成立。NSAID导致MN的具体机制尚不不明确。有学者提出,药物导致MN的机制可能涉及机体对治疗药物或其代谢产物的免疫反应,其中最合理的解释是阳离子药物衍生抗原穿过肾小球基底膜种植在上皮侧,与循环中针对这些抗原的抗体结合[2],类似于牛血清白蛋白导致的儿童MN[8]。
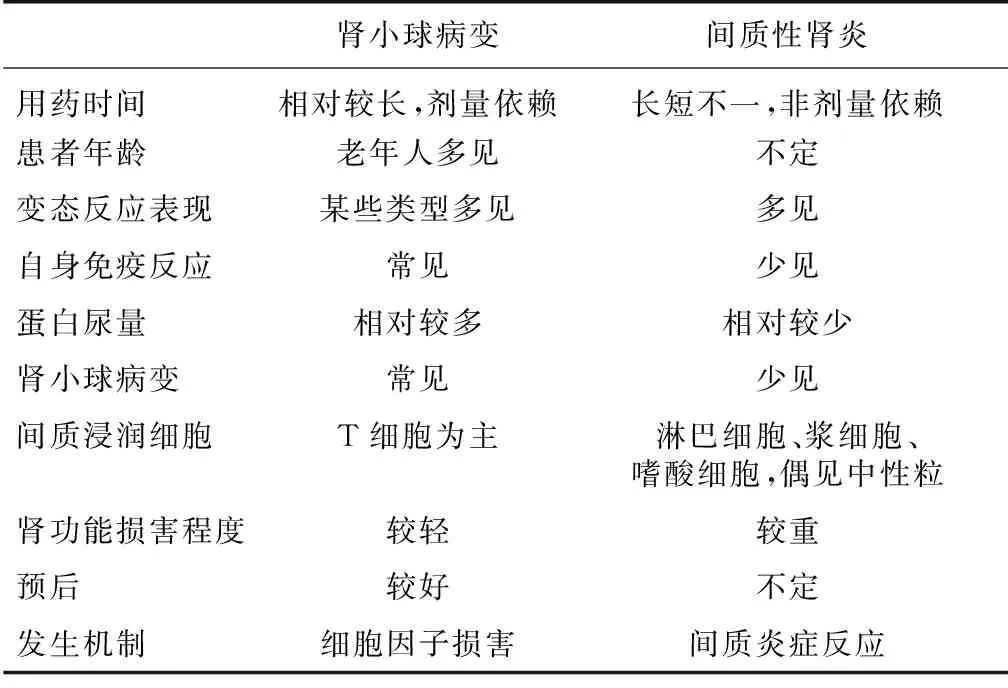
表2 非甾体消炎药相关肾小球病变与间质性肾炎特点比较[6]
NSAID导致AKI的主要危险因素有CKD基础、容量丢失, NS等疾病引起的有效动脉血容量不足等。利尿剂、ACEI/ARB以及钙调磷酸酶抑制剂等药物可增加NSAID诱发AKI的风险;高龄也是AKI的重要危险因素[9]。研究发现具有高选择性环氧化酶2抑制作用的非选择性NSAID(如双氯芬酸等)诱发AKI风险更高[10]。NSAID导致AKI的机制还未完全阐明,可能与以下因素有关[6]:(1)抑制前列腺素合成,肾脏局部血管舒张因子减少,继而导致肾血管收缩、肾血流量减少;(2)抑制肾小管细胞酶活性,产生直接肾小管毒性作用;(3)髓质小血管硬化,导致肾乳头坏死;(4)药物与肾脏抗原结合或者直接充当抗原与抗体结合后沉积于肾间质而引起AIN。此病例肾功能损害严重,可能与以下多个因素有关:高龄,基础高血压和高尿酸血症所致慢性肾脏病变,服用了高度选择性环氧化酶2抑制剂(醋氯芬酸)。其肾活检病理示肾小管间质以急性病变为主,伴轻度慢性病变、动脉硬化,间质少量炎性浸润细胞但以淋巴单核细胞为主,提示肾小管间质损伤以缺血以及直接肾小管毒性为主,不支持急性间质性肾炎诊断。因为肾活检是在糖皮质激素治疗18d后进行,此时患者病情已有所改善,在疾病早期是否合并AIN不得而知。
小结:本文首次报道了一例醋氯芬酸导致的狼疮样病症及急性肾损伤的典型病例,充分说明了NSAID不良反应的复杂性,尤其是其肾脏损伤临床表现的多样性。临床医生在诊疗过程中须仔细询察用药史,认真分析药物与疾病发生发展之间存在的可能联系,以提高诊治水平。

