镉胁迫对姬松茸菌丝生理指标与镉吸收的影响
刘朋虎,陈华,李波,王义祥*,翁伯琦
(1.福建农林大学国家菌草工程技术研究中心,福州350002;2.福建省农业科学院农业生态研究所,福州350013;3.福建省红壤山地农业生态过程重点实验室,福州350003)
姬松茸(Agaricus brasiliensis)是食用菌生产的主要品种之一,由于其具有丰富的营养与特殊的风味,深受城乡消费者的喜爱。但是大多数姬松茸品种对镉比较敏感,在姬松茸生产栽培过程常有镉吸收与累积量超标现象。近年来,镉对食用菌生长的影响及防控技术研究成为研究热点,而不同食用菌品种对栽培基质中的镉响应各异[1-2]。一方面与品种的内在特性有关,例如红平菇耐受与富集镉的能力比较强,其不仅在培养料镉浓度相对较低(1~20 mg·kg-1)状态下对镉有很强的富集能力,而且可以维持一定的产量;另一方面与不同品种镉吸收及代谢能力有关,当栽培原料中镉含量为20~100 mg·kg-1时,随着栽培基质中镉含量的增加,红平菇子实体中镉富集量虽呈逐步提高的趋势,但增幅比较小[3-4]。有研究表明,双孢蘑菇镉胁迫对菌丝体生长会产生先激发后抑制现象,其菌丝体中的SOD、POD 和CAT 3 种酶活性呈现了“低促高抑”的变化动态[5],通过改变其体内重要生物酶活性而影响菌丝体后续生长。有研究表明,食用菌生长过程对镉的富集作用有2 个主要途径,即吸收与吸附[6-7]。红平菇子实体细胞壁上存在的巯基、羧基、羟基等活性基团,进而可以通过共价、静电或分子力的吸附作用,将镉吸附在子实体表面。依靠生物吸附作用累积的镉比较容易解脱,然而镉一旦通过吸收而进入子实体细胞质中,会有部分镉离子与氨基酸、金属硫蛋白等结合,生成没有毒害作用的有机基团物质,很大程度上降低镉累积造成的毒害作用,这一过程可以通过抗氧化酶的变化予以判断[2]。镉胁迫对紫苏[8]、小白菜[9]、水稻[10]及花生[11]生长及体内的抗氧化酶活性均会产生影响,可以因地制宜采取不同技术措施来防控镉毒害,并取得了一定的研究进展。有研究表明,不同食用菌的生理特性会影响其对重金属的吸收,包括菌株组织结构、生物化学成分、基质活性分解、菌丝体的生长等[2]。Malinowska 等[12]研究表明,菌株的生理特性是影响食用菌对镉富集作用的决定性因素。姬松茸对镉敏感并容易引发镉吸收累积,其机制与吸收过程中菌体抗氧化酶的响应内在关系与变化规律,是构建科学诊断方法的重要依据。故本研究利用项目组通过辐射诱变成功选育的低镉姬松茸品种J77 及对照品种J1 作为试验材料,探讨不同浓度镉胁迫对2 个姬松茸品种菌丝SOD、POD、CAT 及APX酶活性、丙二醛含量及镉吸收累积的影响,阐明其响应动态趋势与内在变化规律,旨在为姬松茸前期生产栽培过程中防控镉污染和镉超标提供科学依据。
1 材料与方法
1.1 供试品种与菌种制备
选择J1 与J77 号作为姬松茸供试菌种[13],由福建省农业科学院项目组提供。2 个姬松茸品种培养基配方为10 mg 维生素B1、0.5 g 硫酸镁、2 g 磷酸二氢钾、20 g 蔗糖、20 g 琼脂粉、230 g 马铃薯、1 000 mL 蒸馏水,pH 自然。28 ℃下试管培养至菌丝长满整个斜面,用于后期接种。
1.2 试验设计
试验设0 mg·kg-1(CK)、低中镉浓度(0.5、1、1.5、2、2.5、5 mg·kg-1)和高镉浓度(10、15、20、25、50、75 mg·kg-1);将含镉母液配制好备用,按试验设计将不同浓度镉溶液加入培养液中,每个处理设20 个重复,2个菌株共设2×13×20=520瓶,进行分区排列。
1.3 菌丝培养
菌丝锥形瓶培养:培养基同试管培养(但不加琼脂),将液体培养基与镉母液(1 g·L-1)混合配制成为含不同镉浓度的培养基,置于锥形瓶中,pH 自然;在250 mL的锥形瓶中分装50 mL的液体量,用封口膜将瓶口封好,置于常规高压锅中灭菌30 min,然后在超净台上按照无菌操作接种,将均匀等分的斜面琼脂块接种于锥形瓶中,分区排列在培养室平台架子上并调控室内温度,保持在28 ℃环境下静置培养30 d,之后逐一过滤菌丝,分别称取菌丝鲜质量进行记录与分析,鲜菌丝冷藏备用。
1.4 酶活测定
称取鲜菌丝0.5 g 并放入5 mL 离心管中,用高通量组织研磨器研磨10 min后将离心管取出,缓慢加入5 mL 磷酸缓冲液(pH 7.0),置于离心机中。在4 ℃、15 000 r·min-1下离心时间15 min,抽取上清液待测备用。粗酶液中的过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)、超氧化物歧化酶(SOD)、过氧化物酶(POD)酶活性与丙二醛(MDA)含量测定,参照李波[14]的方法进行。
1.5 菌丝镉含量测定
鲜菌丝在60 ℃烘干至恒质量,然后准确称取0.2 g 进行微波消解,消解液中镉含量采用火焰原子吸收仪测定[15]。
1.6 数据处理
采用SPSS 19.0 数据处理软件对试验数据进行差异显著性分析和相关性分析,数据均为3 个重复的平均值±标准偏差。
2 结果与分析
2.1 镉胁迫对姬松茸菌丝生长过程中抗氧化酶活性的影响
2.1.1 不同浓度镉胁迫对J77与J1菌丝SOD 酶活性的影响
图1 显示,在菌丝生长过程中,不同镉胁迫浓度条件下对SOD 酶活性影响各异。整体而言,J1 菌丝SOD 酶活性比J77 要高。镉浓度处于中低水平(0~5 mg·L-1)时,J1与J77菌丝的SOD酶活性随着外界镉胁迫浓度的增加而提高。与0 mg·L-1处理(对照)相比,当外源添加镉的浓度达到5 mg·L-1时,J1 与J77 菌丝的SOD 酶活性均出现最大值;J1 菌丝SOD 酶活性增加121.5%;J77 菌丝SOD 酶活性增加157.5%,差异均达显著水平(P<0.05);J77 菌丝SOD 酶活性增加率比J1 高,说明J77 菌丝SOD 酶活性反应能力大于J1。当镉浓度>5 mg·L-1时,两个菌株菌丝SOD 酶活性均开始下降。镉浓度处于中高水平(5~75 mg·L-1)时,J1菌丝SOD 酶活性降低68.5%;J77 菌丝SOD 酶活性降低70.1%,差异达显著水平(P<0.05);两个菌株差异不大。当镉浓度达到50、75 mg·L-1时,两个菌株菌丝SOD 酶活性与对照组相比分别降低了3.5%、12.7%,但两品种之间的差异不显著。

图1 不同镉胁迫处理对J1和J77菌丝SOD酶活性的影响Figure 1 Effect of different cadmium concentrations on SOD activity of J1 and J77 mycelia
2.1.2 不同浓度镉胁迫对J77与J1菌丝POD 酶活性的影响
图2 表明,在低镉浓度胁迫处理(0~1.5 mg·L-1)下,J1 与J77 菌丝的POD 酶活性基本相近,两品种之间差异不显著;在中镉浓度处理(2.5~15 mg·L-1)下,J1菌丝的POD酶活性比J77高,且两菌株菌丝POD酶活性随着外界镉胁迫浓度的提高而增加。当镉浓度为5 mg·L-1时,J1 菌丝POD 酶活性达到最大值,与对照的差异达显著水平(P<0.05);当镉浓度为10 mg·L-1时,J77 菌丝POD 酶活性达到最大值,与对照差异达显著水平(P<0.05)。在中高镉浓度胁迫处理(10~75 mg·L-1)范围内,J1 与J77 菌丝的POD 酶活性都开始降低;J77菌丝POD 酶活性比对照减少了92.7%,差异达显著水平;J1 菌丝POD 酶活性比对照减少了95.3%,差异达显著水平。J1 虽然比J77 略高,但两者差异不显著。从菌丝生长过程可以观察到,当外源镉浓度超过15 mg·L-1时,J1 菌丝受到的镉毒害程度比J77 菌丝更为严重;当外源镉浓度为50~75 mg·L-1时,J1与J77菌丝的POD酶活性均达到最小值,且J1的数值更低。
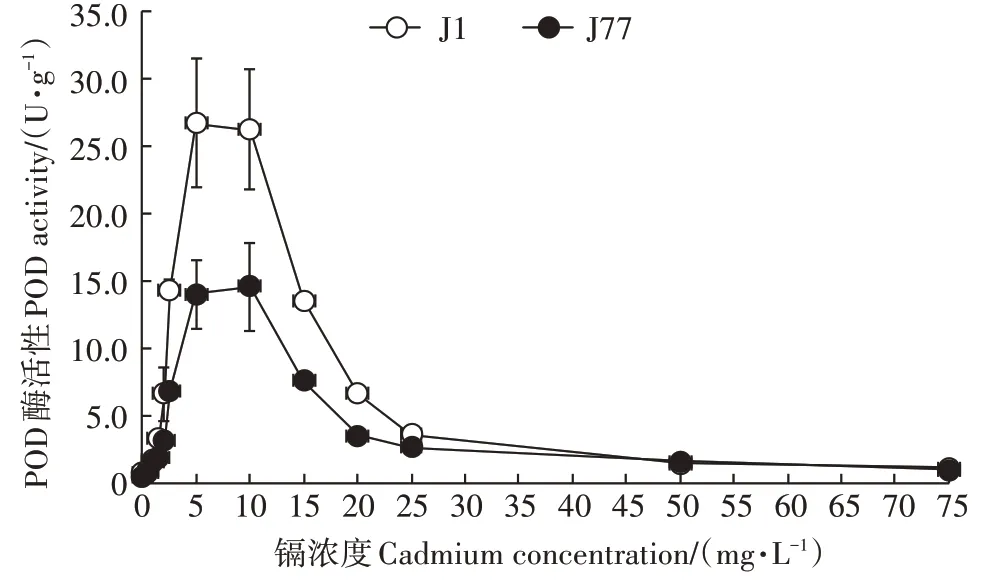
图2 不同浓度镉胁迫对J1和J77菌丝POD酶活性的影响Figure 2 Effect of different cadmium concentrations on POD activity of J77 and J1 mycelia
2.1.3 不同浓度镉胁迫对J77与J1菌丝CAT 酶活性的影响
图3 显示,J77 菌丝CAT 酶活性整体比J1 高。在低浓度镉胁迫处理(0.5~2 mg·L-1)条件下,J1与J77菌丝的CAT 酶活性呈现逐步升高状态,两品种变化相近,差异性不显著。在中浓度镉胁迫处理(2.5~10 mg·L-1)条件下,J77菌丝CAT酶活性则随着外源添加镉浓度的提高而增加,并达到最大值,之后开始逐步下降;同期J1 菌丝CAT 酶活性在2.0 mg·L-1时开始上升,到5.0 mg·L-1时达到最大值,之后开始下降;与对照处理(0 mg·L-1)相比,在0~10 mg·L-1镉浓度范围内,J77 菌丝CAT 酶活性增加359.7%,差异性显著;J1菌丝CAT 酶活性增加343.1%,也呈现显著差异;但J77增幅与J1增幅相差较小。在10~50 mg·L-1镉胁迫浓度范围内,J77 菌丝CAT 酶活性减少40.9%,J1 菌丝CAT 酶活性减少60.4%,两菌株相差19.5%,具有显著差异性(P<0.05),说明随着镉胁迫浓度提高对J1 菌丝的毒害程度加剧,CAT酶活性降低幅度更大。当镉浓度为75 mg·L-1时,J77与J1菌丝的CAT酶活性都降到最低。
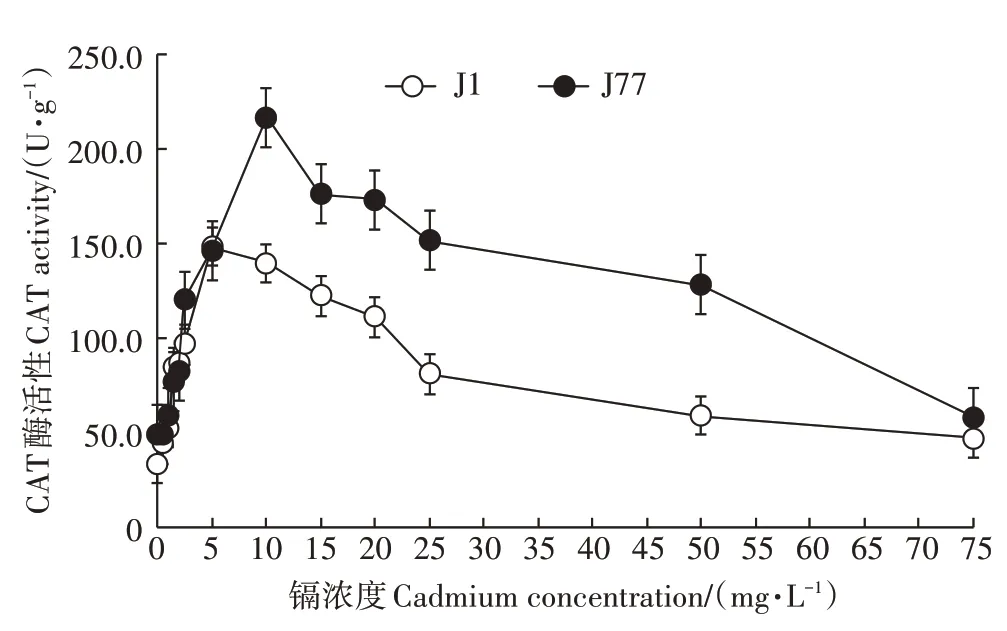
图3 不同浓度镉胁迫对J1和J77菌丝CAT酶活性的影响Figure 3 Effect of different cadmium concentrations on CAT activity of J77 and J1 mycelia
2.1.4 不同浓度镉胁迫对J77与J1菌丝APX 酶活性的影响
图4 表明,在低镉胁迫浓度(0~1.5 mg·L-1)范围内,J1 与J77 菌丝的酶活性均随着外界镉胁迫浓度的提高而增加,而且J1 菌丝的APX 酶活性比J77 菌丝高。与0 mg·L-1(对照)处理相比,当镉胁迫浓度分别为1.5、2 mg·L-1时,J1、J77 菌丝的APX 酶活性分别达到最大值;其中J1、J77 菌丝APX 酶活性分别增加近7.9、13 倍,两菌株之间呈显著差异性;之后两个品种均逐渐降低。在菌丝生长过程中观察到J77 的菌丝状况优于J1,说明其APX 酶活性反应能力大于J1。在2~75 mg·L-1镉浓度范围内,J1、J77 菌丝的APX 酶活性降幅分别为74.1%、73.1%,两品种之间差异不显著(P<0.05);当镉浓度为75 mg·L-1时,J1、J77 菌丝的APX酶活性均达到最低点。
2.2 不同浓度镉胁迫对J77与J1菌丝丙二醛含量的影响

图4 不同浓度镉胁迫对J77和J1菌丝APX酶活性的影响Figure 4 Effect of different cadmium concentrations on APX activity of J77 and J1 mycelia

图5 不同浓度镉胁迫对J77和J1菌丝MDA含量的影响Figure 5 Effect of different cadmium concentrations on MDA content of J77 and J1 mycelia
由图5 可知,在不同浓度镉胁迫处理条件下(0~75 mg·L-1),J1 菌丝丙二醛(MDA,膜脂过氧化指标,氧化应激的标志物)含量整体比J77 菌丝高;而且J1显示了较大幅度的提升,氧化程度比较剧烈,而J77在整个过程中提升幅度比较缓慢,氧化应激程度比较低。在低中浓度镉胁迫(0~10 mg·L-1)处理范围内,J1与J77 菌丝的MDA 活性则随着镉胁迫浓度的提高而增加。J1 菌丝在镉胁迫浓度达10 mg·L-1时,其MDA含量比对照提高161%,达到最大值且达到差异显著水平(P<0.05);J77 菌丝在镉胁迫浓度达15 mg·L-1时,MDA 含量达到6.0 nmol·g-1(最大值),且比对照提高62.2%,达显著性差异水平(P<0.05)。J1 与J77 之间相差较大,表明J1 菌丝细胞膜过氧化反应比J77 更强烈。在中高镉胁迫浓度(15~50 mg·L-1)条件之下,J1、J77 菌丝的MDA 含量分别减少46.1%、26.4%,两品种之间差异显著(P<0.05)。当镉浓度为75 mg·L-1时,J1 与J77 菌丝的MDA 含量都降到最低;但外源镉浓度与2 个菌株菌丝的丙二醛含量之间均无显著相关性。
2.3 不同浓度镉胁迫对姬松茸菌丝镉含量的影响
不同浓度镉胁迫处理对J77 和J1 菌丝中镉含量的影响结果见图6。由图6 可知,在0~75 mg·L-1浓度范围内,J77 与J1 菌丝中镉含量的浓度均随着外界镉含量的提高而增加。当镉浓度在0~2.5 mg·L-1范围内,J77 菌丝镉含量增长近93 倍,而J1 菌丝镉含量增长近117 倍;两者差异显著(P<0.05)。当镉浓度达到2.5 mg·L-1时,J1 菌丝镉含量比J77 菌丝高近2.5 倍。说明在此浓度范围内,J1 菌丝的镉吸收富集量高于J77 菌丝。当镉浓度在2.5~50 mg·L-1范围内,J1 菌丝镉含量增长了17.2倍,J77菌丝镉含量增长了19.1倍;即J77 菌丝镉增长率高于J1 菌丝,但J1 菌丝比J77 菌丝镉含量高近2.3 倍。当镉浓度在50~75 mg·L-1范围内,J77、J1 菌丝镉含量的增长率分别为77.8%、8.27%,但J1 依然比J77 菌丝镉含量高3 895.8 µg·kg-1,这说明即使在高镉浓度胁迫条件下,J77 不仅耐受程度高于J1,且抵制镉吸收能力也高于J1。将外源镉浓度与两个菌株菌丝镉含量进行相关性分析,结果表明,外源镉浓度与J77、J1菌丝镉含量均呈极显著正相关,相关系数分别为0.971 和0.972(P<0.01),且J1菌丝镉含量与外源镉浓度之间相关性高于J77 菌丝。由相关系数可知,随着外源镉浓度的不断增加,J77和J1 菌丝镉含量的增长速率都会显著增加;但J1 菌丝镉含量的增长量明显高于J77 菌丝。两菌株镉含量的变化符合回归方程y=-0.898 8x2+266.12x-200.99(R2=0.973)和y=1.568 6x2+79.907x+271.7(R2=0.954)。
3 讨论

图6 不同浓度镉胁迫对J77和J1菌丝镉含量的影响Figure 6 Effect of different cadmium concentrations on cadmium content of J77 and J1 mycelium
已有研究表明,植物细胞中存在着由超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)等组成的抗氧化酶系统,抗氧化酶系统的综合作用是调节并防止细胞受到外界环境因子的不利胁迫而被氧化[16]。其中超氧化物歧化酶(SOD)可将O2-转化为H2O2,而过氧化氢酶(CAT)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)可以通过相关生理生化反应将H2O2清除[17]。如果POD、CAT、APX 无法及时清理SOD 所产生的H2O2,那么细胞中累积的H2O2将会继续与O2-反应而产生OH·,进而进一步加剧细胞氧化[18]。本试验结果显示,不同镉胁迫处理对J77 和J1 菌丝抗氧化系统的影响各异,其总体变化趋势是:无论是J1 还是J77 姬松茸品种,随着镉胁迫浓度的提高,在菌丝生长过程中其SOD、POD、CAT、APX 酶活性及MDA 含量均呈现先上升后下降的变化动态,与前人进行水稻苗等作物试验结果相近,存在“低促高抑”现象[19]。
SOD 是生物机体内天然存在的超氧自由基清除因子,SOD产生与主要作用是把有害的超氧自由基转化为过氧化氢[20]。虽然过氧化氢会对机体发育产生不利的影响,但生物体内活性极强的过氧化氢酶(CAT)和过氧化物酶(POD)会将其分解为完全无害的水[21]。这3 种酶组成了一个完整的防氧化链条。本试验将J77、J1 菌丝的SOD、POD、CAT、APX 酶活性与外源镉浓度进行相关性分析,结果显示,J1、J77 菌丝的4 种酶活性中只有SOD 酶活性与外源镉胁迫浓度之间呈极显著负相关,其相关系数分别为-0.526和-0.553(P<0.01),J1 菌丝的SOD 酶活性与外源镉胁迫浓度间的相关性大于J77,但J77 与J1 菌丝SOD 酶活性都受到较为明显的抑制作用;POD、CAT、APX 酶活性与外源镉胁迫浓度之间相关性并不显著,但J77菌丝POD、CAT、APX 酶活性受到镉的抑制程度相对小于J1,这与其他作物试验结果有相似之处,即防氧化链条的各个要素之间是相互制约的。按照SOD 中金属辅基的不同,大致可将SOD 分为3 大类,分别为Mn-SOD、Cu/Zn-SOD、Fe-SOD[22]。在镉胁迫程度逐步加大的条件之下,是否产生镉替代的现象,或者由于产生镉毒害而破坏完整的防氧化链条,进而在镉胁迫过程中发生SOD 的失活,这是食用菌生理生化指标体系构建与深入研究需探讨的新命题[23]。在食用菌生长的重金属毒理学研究方面,除了关注SOD 之外,同时测定CAT、POD、APX 指标变化也是重要环节,但作为诊断与判别指标,还需要筛选关键因子,实现测定一个指标即可了解食用菌菌丝或者子实体防氧化链条(系统)健康状况,进而进行必要的修复与防控,这仍需要深入的研究[24]。
生物适应逆境胁迫的重要机制之一就是有效清除活性氧,而生物体内的SOD、POD、CAT和APX是活性氧自由基清除系统中关键的系列保护酶[25]。生物体内镉过量富集会诱发活性氧的积累,通常会直接或者间接破坏抗氧化酶和抗氧化剂功能,其抗氧化酶活性的提高有助于生物细胞免受镉毒害[26]。在本试验的镉胁迫条件下,J1、J77 品种特征不同,但两个品种菌丝的SOD、POD、CAT 和APX 活性变化规律基本一致,呈先升高后降低趋势,这或许是姬松茸同其他作物品种一样,其SOD、POD、CAT和APX活性存在一个镉胁迫浓度的阈值,对低镉浓度的应激产生的保护作用降低了膜脂过氧化反应;但随着镉浓度的升高,打破了体内活性氧产生和清除的动态平衡,过量镉引起的姬松茸菌丝体内过氧化物不断积累,不断加剧过氧化损伤程度,菌丝活性与生长量逐步减少。J1 和J77的镉胁迫浓度阈值在SOD 活性方面表现基本一致,但镉胁迫对J1 POD、CAT 和APX 活性影响的阈值低于J77。整体而言,J1对镉胁迫的抗性低于J77。在整个镉胁迫过程中,由于J1 本身的抗镉胁迫能力较弱,所以为维持正常的生物代谢过程,受镉胁迫后需维持较高的抗氧化酶活性。此外,对于J77,在镉的含量2.0 mg·L-1处理下,SOD、CAT、APX等的活性均出现一定程度的拐点,其具体原因仍有待进一步探索。今后还需要深入探索不同镉胁迫程度对不同品种食用菌菌丝或者子实体吸收累积镉动力学过程的变化规律,包括镉吸收的增长率与累积量之间的内在关系,或者以丙二醛(MDA)作为诊断评估指标,阐明其直接与间接的机制,为有效的镉污染防控措施提供技术依据。
4 结论
(1)不同浓度镉胁迫处理对J77 和J1 菌丝抗氧化系统的影响各异。就总体变化规律而言,随着镉胁迫浓度的增加,J1、J77 姬松茸菌株菌丝SOD、POD、CAT、APX 酶活性及MDA 含量均呈现先上升后下降的变化趋势。
(2)就J1 与J77 菌丝SOD 酶活性、POD 酶活性而言,镉胁迫浓度敏感值为5 mg·L-1;而J1 与J77 菌丝CAT 酶活性耐受范围相对较宽,在5~50 mg·L-1镉浓度范围内,依然保持40%、60%的活性。在不同镉胁迫处理条件下(0~75 mg·L-1),J1 菌丝丙二醛含量均高于J77 菌丝,且J1 显示了较大幅度的提升,氧化程度比较剧烈;而J77 的提升幅度比较平缓,表明J1 的细胞膜过氧化反应比J77菌丝更为严重。
(3)在0~50 mg·L-1浓度范围内,J77 与J1 菌丝中镉含量的浓度均随着外源镉含量的增加而增加,但J1菌丝镉累积量比J77 高2.3 倍。当镉浓度大于50 mg·L-1时,J77、J1 菌丝镉含量的增长率分别为77.8%、8.27%,但J77 镉含量低于J1,表明J77 具有抵制镉吸收的潜力。

