生物再生生命保障系统中小麦秸秆好氧生物处理及其微生物群落演替
刘佃磊,王律杰,董迎迎,谢倍珍,3*,刘 红,3
(1.北京航空航天大学生物与医学工程学院,北京100191;2.北京航空航天大学环境生物学与生命保障技术研究所,北京100191;3.北京航空航天大学生物医学工程高精尖中心,北京100191)
1 引言
生物再生生命保障系统(Bioregenerative Life Support System,BLSS)是目前国际上最先进的、可实现高闭合度物质循环的生命保障技术,是实现在空间基地长期生存必不可少的关键技术[1]。高等植物作为BLSS中极其重要的部分,能为整个闭合系统持续提供食物和氧气,帮助实现水循环,但是同时也会产生不可食部分,成为系统中固体废物的主要组成之一。植物不可食生物量的循环处理是系统闭合性提高的关键影响因素[2-3]。
BLSS中固体废物主要包括生活垃圾、乘员及动物粪便,以及植物不可食生物量等,其中植物秸秆处理技术要求最高。植物秸秆的处理技术有焚烧、化学处理、类土壤基质(Soil-Like Substrate,SLS)技术及微生物发酵技术等[4]。焚烧技术易产生NOX、SOX等有害气体,化学处理易产生废酸、废水[5],SLS技术将秸秆等不可食部分经过处理最终转化为可种植植物的基质,但会引入蚯蚓等外源不能处理的生物量,且处理时间略长[6]。微生物发酵处理固体废物是将植物不可食生物量经烘干磨碎后加入生物反应器进行生物好氧降解,反应器温度范围为35~70℃,发酵后的基质可以作为植物生长所需养分[7]。嗜热菌在固体废物处理中起着关键作用,尤其是在堆肥过程中[8-10]。
Trotman等[11-12]提出利用微生物处理技术将甜薯的叶、顶端、须根等不可食部分进行生物降解,降解后的基质浸提液与植物营养液一起进行植物种植,实现小麦及大豆等作物栽培。艾为党等[13]研究将植物不可食部分转化为植物营养液供植物生长。Liu等[14-15]对月宫一号舱固体废物处理进行研究,将植物不可食部分好氧发酵为植物提供固体肥料,采用温度调控CO2气体产生,研究其对小麦生长期的影响。
小麦秸秆中木质纤维素含量高,微生物自然发酵周期长,效率低,且腐熟难度大。在植物不可食部分的处理过程中,引入混合微生物菌剂能有效提高难降解有机物质的降解效率[14]。细菌、真菌均有具有纤维素分解能力的种属,其中细菌主要有芽抱杆菌属(Bacillus)、瘤胃球菌属(Run inococcus)、纤维单胞菌属(Cellolon onas)和假单胞菌属(Pseudon onas)等,最适生长pH一般偏中性或碱性,生长温度一般是30~40℃[16]。真菌中的绿色木霉(Trichodern a viride)、康氏木霉(Trichodern a koningii)和黑曲霉(Aspergillus niger)等则被广泛报道具有较强的纤维素和木质素降解能力[17-19]。优化植物秸秆好氧生物处理工艺参数并弄清其过程中的菌群演替规律,可为提高BLSS中固废降解速率提供策略,也为高效菌剂筛选和制备提供参考。
本研究采用复合菌剂对小麦秸秆进行好氧生物处理,首先通过摇瓶正交实验对好氧发酵的温度、初始含水率及碳氮比3个因素进行优化;随后采用适用于BLSS的固废生物转化器实验测试优化条件下小麦秸秆的降解效率;最后对固废生物转化器发酵过程中发酵基质微生物数目及群落结构演变规律进行分析。
2 方法
2.1 实验原料
小麦秸秆分别来自月宫105实验舱内种植小麦[20]及江苏省赣榆市夹山镇农场;微生物菌剂为本实验室筛选的可降解纤维素的复合菌剂,该复合菌剂由食草动物粪便与植物秸秆长期好氧发酵筛选培养而来。
2.2 正交实验设计
设置温度、初始含水率、碳氮比3个因素,每个因素设置3个水平进行正交优化实验,各因素的水平设置如表1所示。经测试,月宫105实验舱内种植的小麦秸秆含氮量为2.52%,含碳量为45.9%;而农场种植小麦秸秆含氮量为0.48%,含碳量为46.5%,因此可通过计算不同碳氮比小麦秸秆的使用比例,设置20∶1、25∶1及30∶1的碳氮比。根据正交试验方法[21],选用L9(34)正交表进行实验设计,共设置9组实验。
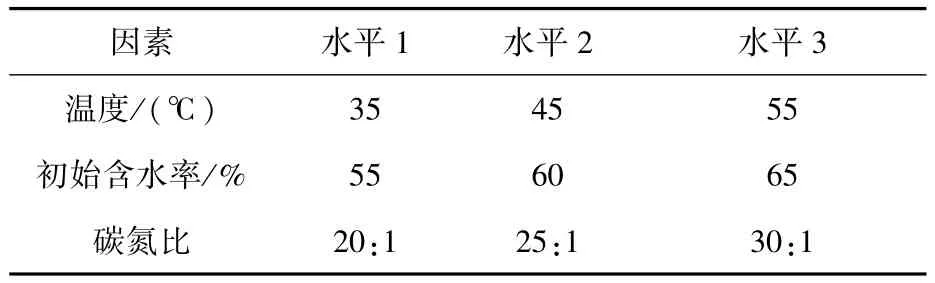
表1 正交因素和水平表Table 1 Orthogonal factors and levels
在9组500mL三角瓶中加入长度约为0.5~1.0 cm的小麦秸秆各20 g(干重),每组按照含水率添加相应比例水分并充分混匀,以透气封口膜封口,高压蒸汽灭菌锅中121℃灭菌20 min。灭菌完成后,冷却,接种小麦秸秆5%(干重比)的复合微生物菌剂,恒温摇床中振荡(200 r/min)发酵20天,随后测试各组小麦秸秆减重率,根据正交试验结果得出最优发酵温度、初始含水率以及碳氮比。每组实验设置3个平行实验。
2.3 固废生物转化器处理秸秆实验过程
利用实验室前期构建的BLSS固废生物转化器[10]进行上述优化条件的发酵效果验证。根据三角瓶优化的最优条件,设置固废生物转化器运行温度、小麦秸秆初始含水率及碳氮比。固废生物转化器搅拌速率设置为20 Hz,固废生物转化器中加入2 kg小麦秸秆(干重),接种100 g干重(秸秆干重比例5%)复合菌剂并连续发酵20天。
对固废生物转化器中发酵第5天、10天、15天、20天发酵样品取样,测试发酵第20天时固废生物转化器中剩余物料含水率、干重、样品pH值、电导率、碳元素、氮元素以及碳氮比。测试第5天、10天、15天、20天发酵样品中的微生物数目。
固废生物反应器中原始菌剂、发酵第5天、第10天、第15天、第20天样品分别标记为A1、B1、B2、B3、B4。对A1、B1、B2、B3、B4样品进行DNA提取及PCR纯化,纯化后的样品进行高通量测序工作。
所有样品均随机取样3个,各测试指标结果以3份样品检测结果的平均值±标准差来表示。
2.4 测试方法
1)减重率的测定。分别称取每组实验发酵前的物料干重n、发酵后的基质重量n'。则减重率M的计算见式(1):

2)微生物数量检测。称取1 g样品(干重)放入在三角瓶里(内置无菌玻璃珠),加入10 mL去离子水,150 r/min摇床上振荡30 min,制成液体样品进行微生物数目检测。通过PROFILE1 3560 10X细菌快速测定仪(NHD,美国)检测微生物中的ATP含量,通过换算得到样品中微生物数[22]。
3)DNA提取及PCR纯化。分别取1 g干重样品加入10 mL去离子水于150 r/min摇床震荡30 min,取1 mL浸提液通过E.Z.N.A DNA Isolation Kit(Omega Biotech,USA)提取样品的全基因组DNA,并使用1.5%琼脂糖凝胶电泳(AGE)在5 V·cm-1的电压下检测30 min。PCR扩增细菌16S rDNA基因的V3+V4超可变区,采用515F-907R引物扩增,正向引物(5'-GTGCCAGCMGCCGCGG-3')及反向引物(5'-CCGTCAATTCMTTTRAGTTT-3')。PCR扩增真菌18S rDNA基因的ITS1区,采用的引物为SSU0817FSSU1196R,正向引物(5'-TTAGCATGGAATAATRRAATAGGA-3')及反向引物(5'-TCTGGACCTGGTGAGTTTCC-3')。
扩增体系采用全式金AP221-02:TransStart Fastpfu DNA聚合酶20μL,反应体系:5×FastPfu Buffer 4μL,2.5 mM dNTPs 2μL,上游引物0.8引物,下游引物0.8引物,FastPfu Polymerase 0.4μL,BSA 0.2μL,DNA模板10 ng,补ddH2O至20μL。PCR反应参数:1个循环(95℃下3min),27个循环 (95℃下30 s;55℃下30 s;72℃下45 s),最后72℃下10 min。通过PCR扩增器(ABIGeneAmp 9700,USA)扩增DNA分子[23]。
4)高通量测序。PCR扩增产物在上海美吉生物科技有限公司的Bio-Pharm Illumina Miseq平台上进行基因组测序。Miseq测序收集荧光信号以读取DNA片段的序列。根据97%相似水平的操作分类单位(OTU)的生物信息的相似性水平及统计分析,对所有序列进行划分。然后产生一组代表性的序列,并使用SILVA数据库(Release115,http://www.arb-silva.de)为这些序列分配分类。基于OTU,构建Veen图,分析属水平上微生物群落的相对丰度。
3 结果与讨论
3.1 小麦秸秆好氧发酵条件优化结果
通过20天的正交实验,以基质的减重率为评价指标,考察温度、初始含水率和碳氮比3个因素的优化结果,如表2所示。计算实验结果之极差R后进行比较,可以看出,温度R>含水率R>碳氮比R,三因素中影响最大的因素是温度,其次是初始含水率,最后是碳氮比。根据减重率K1j、K2j及K3j在温度、含水率、碳氮比因素下对应的最大值分别是120.6,111.69,109.77,得出对应的最优发酵条件分别是含水率60%,温度55℃,碳氮比30∶1。

表2 正交实验结果Table 2 Orthogonal experiment results
图1为正交结果极差图,由图1可知,实验中温度设计范围分别为35℃(低温)、45℃(中温)和55℃(高温),减重率随温度的变化逐渐增高,说明在实验范围内菌剂的最适生长温度是55℃。有文献表明,绝大部分嗜热性真菌的最适生长温度为40~55℃之间[24],而嗜热性细菌的最适生长温度为55~70℃[25]。该研究中温度为55℃时减重率最高,该温度适宜嗜热性细菌和嗜热真菌繁殖。随着温度升高减重率提高,但温度高于60℃时,微生物活性会显著降低[26],因此,选择55℃作为最佳反应温度。Strom[27]研究表明,嗜热性细菌及嗜热性真菌在高温好氧生物转化过程中,主要降解基质中的纤维素及木质素。这些嗜热菌在高温环境下新陈代谢迅速、代谢时间短、且酶的热稳定性高,因此在菌剂中加入此类菌有助于增加生物转化的代谢率及缩短生物转化周期。
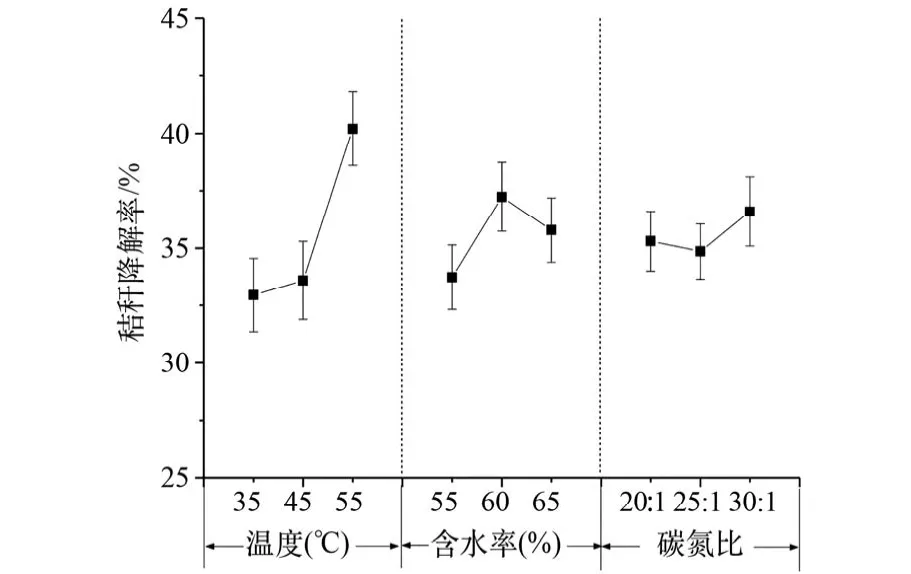
图1 正交优化结果极差图Fig.1 Range graph of orthogonal optim ization results
随着初始含水率升高,减重率则呈现先升高后降低趋势(图1)。初始含水率为60%时小麦秸秆减重率最高。在生物转化过程中,微生物每消耗1 g挥发性固体会产生0.6 g的新陈代谢水[28]。实验中微生物利用小麦秸秆过程中产生的水分会导致基质中含水率升高,生物转化过程中基质含水率超过70%可导致基质厌氧反应,不利于植物秸秆的降解[29]。固体废物生物转化过程中最适含水率为65%,在该条件下基质中有机质降解率最高[30],鉴于含水率会在生物转化过程中升高,即初始含水率为65%时可能导致转化过程中含水率高于70%而不利于生物转化。因此,选取初始含水率60%为最优初始含水率。
当碳氮比分别为20∶1及25∶1时,基质的平均减重率分别为35.30%及34.85%,而碳氮比为30∶1时,减重率达到最高,为36.59%(图1)。发酵过程中,60%~70%的碳水化合物都被微生物以CO2的形式降解,剩余部分被作为细菌体的细胞成分利用掉[31]。碳素是微生物生长繁殖过程中,不可缺少的一种元素,高碳氮比的实验条件有利于刺激微生物活性,堆肥中最佳的碳氮比为25~35[32],且高碳氮比有机质的降解率高于低碳氮比有机质降解率[33]。小麦秸秆降解过程选取碳氮比30∶1为最适碳氮比,该碳氮比不仅可以保证碳元素的供应,而且该碳氮比下小麦秸秆的降解率最高。若碳氮比高于40可供消耗的碳元素多,氮素养料相对缺乏,细菌和其他微生物的生长受到限制,有机物分解速度慢,发酵过程就长;若碳氮比低于20,可供消耗的碳素少,氮素相对过剩,则氮极易变成氨态氮而挥发,导致氮素营养大量损失[34]。
3.2 固废生物转化器处理小麦秸秆降解结果
根据正交优化得出的最优发酵结果以及实际情况考虑,采取温度55℃、初始含水率60%、碳氮比30∶1进行固废生物转化器验证。物料发酵前后测试指标见表3。
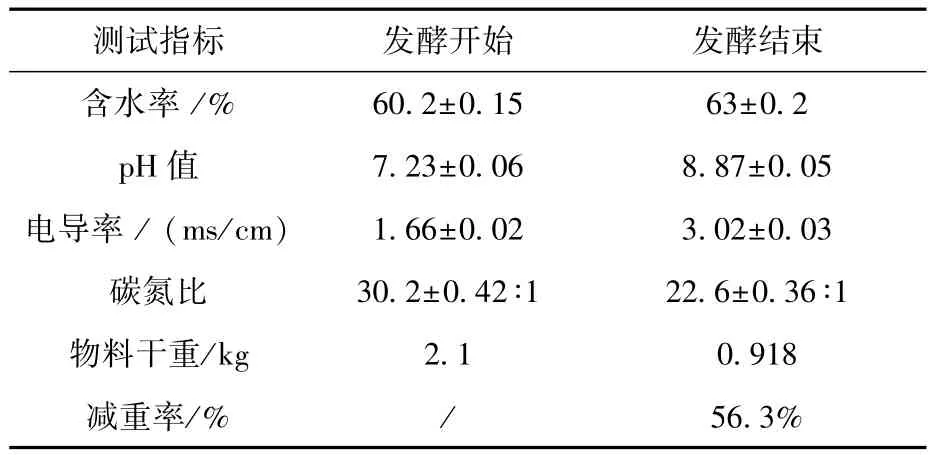
表3 发酵前后物料测试值Tab le 3 Test value ofmaterial before and after fermentatio n
发酵20天,2.1 kg(干重)物料最终剩余0.918 kg(干重),减重率为56.3%,该减重率高于三角瓶正交优化实验结果,在最优发酵条件下固废生物转化器降解率比最优条件下三角瓶中降解率高13.8%,主要原因是固废生物转化器中通风条件采用泵入式,而三角瓶实验中通风主要采用摇床震荡式,固废生物转化器中秸秆降解过程中溶氧更加均匀,微生物反应速度更快,降解率更高。发酵20天后的物料为碱性,物料中离子浓度偏高,碳氮比还没达到腐熟的标准(C∶N小于20∶1)[35],根据腐熟物料pH值显弱碱性为8~9[36],该物料发酵20天时pH值符合腐熟物料pH值标准。且有研究表明发酵物料电导率低于9 ms/cm,物料对种子发芽率没有抑制作用[37],该研究中物料发酵20天后的电导率低于9 ms/cm,说明该电导率条件下物料不会抑制种子发芽,且该电导率也符合Garcia给出的腐熟物料电导率值[38]。pH值与电导率值虽然符合腐熟标准,但这两个指标只是物料腐熟的必要条件而不是充分条件。
3.3 利用固废生物转化器处理小麦秸秆的微生物数目及多样性分析
3.3.1 微生物数量分析
固废生物转化器运行过程中,所处理植物秸秆在不同时期的微生物总数变化如图2所示。
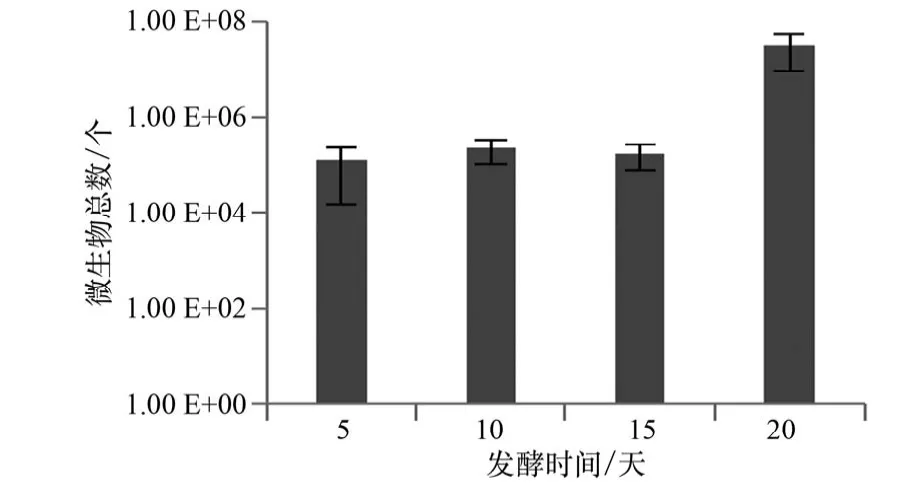
图2 微生物总数变化趋势Fig.2 Trend of totalm icroorganism s
由图2可知,发酵5天后基质中微生物的数量达到1.23×105个/mL,之后在5~15天发酵过程中微生物的总数变化均不大,表明随着实验环境的变化,以及基质中碳源的限制,呈现出微生物的总数变化不明显。但微生物组成可能会有比较大的变化。一方面是因为植物秸秆结构是木质素包被纤维素与半纤维素,微生物要破坏这种微观结构并分泌相关酶以适应环境,可能存在较长的迟滞期[39];另一方面,在这个过程中,可能存在不能够利用物料的微生物被淘汰,而适应的环境的微生物大量增殖,因此呈现出微生物的总数变化不明显。随后,当发酵至20天时,微生物总数大幅增加,达3.27×107个/mL,可能是由于微生物对物料与环境条件已经适应,可降解木质纤维素的微生物成为优势菌群大量繁殖,特别是嗜热细菌及嗜热真菌大量繁殖,促进了小麦秸秆降解,因为嗜热真菌能产生热稳定性的纤维素酶、半纤维素酶、木质素酶[40]。嗜热细菌能较容易地利用半纤维素,并在一定程度上改变木质素的分子结构,进而分解溶解的木质素[41]。
3.3.2 微生物群落变化
1)Venn图
根据OTUs聚类分析统计的结果,构建了Venn图[42],如图3所示。A1为原始菌剂、B1至B4对应实验发酵后第5天、第10天、第15天以及第20天时采集的样品。5个样品中,细菌共有的OTUs达到41个,真菌的共有OTUs只有5个。表明原始菌剂中的可以在发酵过程中一直存活的细菌及真菌种类分别是41种和5种。原始菌剂的细菌OTU数一共有225个,而发酵5天后的OTU下降至155个,在实验中后期即10天、15天时OTU数又升到198个、185个,并在发酵20天后OTU达196个。原始菌剂中真菌的OTU有13个,发酵5天后上升至30个,并维持到15天后下降至27个,发酵结束后真菌OTU有23个。微生物OTU数目的变化表明在发酵前期原始菌剂中的部分细菌及真菌因不适应发酵环境而被慢慢淘汰。发酵中期后适应环境的细菌及真菌大量繁殖,细菌及真菌种类又开始慢慢增加。发酵过程中5天,10天,15天及20天样品中含有的原始菌剂以外的细菌及真菌数目分别是76、132,116、131和21、22,18、17。样品中出现了原始样品中不含有的微生物可能是因为此部分微生物在原始菌剂中含量特别低,没有检测出来,而在发酵过程中,该部分微生物适应发酵条件,开始慢慢大量繁殖,最终在样品中检测出来,另外小麦秸秆本身带有微生物,并且在取样及实验操作中,环境中及操作人员身上有一部分微生物也可能进入固废生物转化器中。
2)微生物群落结构变化分析
根据样品所测得序列结果,对比Silva数据库对各个细菌OTU进行物种注释。通过注释结果可知,5个样品总共检测到来自404个不同属(genus)的细菌,原始菌剂中含有225个、发酵后的样品分别含有155个、198个、185个和196个。其中原始菌剂中丰度最高的细菌主要分布在Pedobacter(地杆菌属)、Phyllobacteriaceae(叶杆菌属)、Sanguibacter(血杆菌属)等。发酵5天的基质中丰度较高的细菌主要分布在Cellvibrio(纤维弧菌属)、Pedobacter(地杆菌属)、Sanguibacter(血杆菌科)。发酵10天及15天的基质样品中细菌物种主要分布在Sphingobacteriun(鞘脂杆菌科鞘氨醇杆菌属)、Thern obacillus(热芽胞杆菌属)、Bacillales(芽孢杆菌目)等。在基质发酵20天后丰度最高的细菌物种分布在Ureibacillus(尿素芽胞杆菌属)、Bacillus(芽胞杆菌属)、Thern olactis(热乳芽胞杆菌属)等。Sphingobacteriun(鞘脂杆菌科鞘氨醇杆菌属)是堆肥中温度下降阶段的一种优势菌,可以产生蛋白酶,几丁质酶及纤维素酶[43]。Thern obacillus(热芽胞杆菌属)及Thern olactis(热乳芽胞杆菌属)可以有效降解木质纤维素[44-45]。Bacillus为厚壁菌属中广泛存在于粪便堆肥中的微生物,可以降解有机物,对木质纤维素降解有一定的作用,具有木质纤维素降解活性[46]。

图3 不同发酵时间的基质OTU分布Venn图对比Fig.3 Comparison of Venn diagrams ofmatrix OTU distribution at different fermentation tim es
在真菌方面,根据测序结果对比Unite数据库后,成功对55个不同属的真菌完成注释。原始菌剂中只测得13个不同属,丰度最高的真菌主要分布在Scopulariopsis(帚霉属)、Saccharon ycetales(酵母菌属)、Galacton yces(地霉属白地霉)等。基质发酵5天后,测得30个不同的属,其中优势真菌为Bron eliothrix(凤梨菌属)、Sordarion ycetes-incertae-sedis(硫霉菌科未知属)、Cryptosporidiun(隐孢子虫属)等。发酵10天、15天以及20天后,基质中测得的属分别有30个、27个以及23个,但基质从发酵第10天起直到基质发酵结束,优势真菌维持在Scopulariopsis(帚霉属)、Aspergillus(曲霉属)、Cryptosporidiun(隐孢子虫属)、Basidion ycotaincertae-sedis(担子菌科未知属)、Sordarion ycetesincertae-sedis(硫霉菌科未知属)等。图4所示为具体样品中的微生物组成与相对丰度。

图4 在属水平的样品微生物群落结构柱状图Fig.4 Histogram ofm icrobial community structure of samples at genus level
在发酵5天后的样品中发现,基质中微生物的复杂度明显降低,一些即使在原始菌剂中丰度比较高的菌种如Devosia(德沃斯氏菌属)、Brevundin onas(短波单胞菌属)、Sanguibacter(血杆菌属)、Galacton yces(地霉属白地霉)等都在发酵反应开始后就逐渐被淘汰,可能是因为发酵环境中缺乏这些菌种生长条件。细菌群落的变化结果中基质发酵5天后的样品中,出现大量的Cellvibrio(纤维弧菌属),这是一种纤维素降解细菌,富含于矿化垃圾中[47]。发酵10天后的基质中Bacillus(芽胞杆菌属)的丰度呈指数性增多。有研究表明,Bacillus(芽胞杆菌属)是固体废物生物转化过程中的优势菌种,并能将基质中的木质纤维素分解利用[48]。5~10天时微生物数目变化不大,但微生物组成变化很大,说明微生物在适应基质,不适应基质的微生物被淘汰,适应的基质的微生物大量繁殖。发酵10天至发酵20天期间,样品中的微生物物种组成差别不大。比较原始菌剂与发酵20天后的样品中,原始菌剂中有160个属的细菌在发酵过程中逐渐被淘汰,如Roseon onas(玫瑰单胞菌)、Flavobacteriun(黄杆菌)、Rhizobiun(根瘤菌)等,因为该类微生物不适应发酵条件被慢慢淘汰。另外还有131个属的菌种是原始菌剂中没有的,但在发酵20天以后基质中出现的,包括Ureibacillus(尿素芽胞杆菌属)、Bacillus(芽胞杆菌属)、Thern obifida(高温双歧菌)等会产生纤维素酶和木聚糖酶利于植物不可食生物量生物转化的微生物[46]。
在真菌群落结果的变化分析中,Scopulariopsis(帚霉属)是发酵过程中重要的一类真菌,其能分解木质纤维素并对腐殖酸的形成有一定的作用[49]。发酵5天后,基质中Scopulariopsis(帚霉属)含量低,不是基质中的优势菌种,基质中主要以Bron eliothrix(凤梨菌属)和Sordarion ycetes-incertae-sedis(硫霉菌科未知属)为主,主要原因可能是固废生物转化器中加入的秸秆没有经过灭菌,秸秆本身带有这两种微生物,而原始菌剂中的Scopulariopsis(帚霉属)因为发酵前期秸秆降解困难,Scopulariopsis(帚霉属)营养补充不够充分,导致该菌种繁殖缓慢。随着发酵进行到第10天,Bron eliothrix(凤梨菌属)与Sordarion ycetes-incertae-sedis(硫霉菌科未知属)因为不适应55℃高温条件而被淘汰,此时秸秆降解可以为Scopulariopsis(帚霉属)提高充足营养,并且Scopulariopsis(帚霉属)适应55℃高温条件而快速繁殖成为基质中的优势菌,同时基质中Aspergillus(曲霉属)大量繁殖成为优势菌,Aspergillus(曲霉属)真菌可以具有降解木质纤维素的功能[50]。从第10天开始到发酵结束基质中Aspergillus(曲霉属)微生物相对含量不断增加,基质中具有木质纤维素降解功能的微生物增加对小麦秸秆的降解具有一定的促进作用,也表明小麦秸秆的降解与微生物有关。
通过微生物分析可见,固废生物转化器中主要的优势微生物是木质纤维素降解相关的微生物,所以在BLSS中关于固体废物处理菌剂制备可以采用具有木质纤维素降解功能的嗜热微生物,包括嗜热细菌,真菌等。嗜热微生物的大量繁殖可以加快木质纤维素的降解,从而提高固体废物的降解效率。
4 结论
1)经三角瓶正交优化及固废生物转化器扩大化验证实验得出,利用复合微生物菌剂降解小麦秸秆的最优条件为温度55℃,物料初始含水率为60%及碳氮比为30∶1。
2)利用固废生物转化器发酵20天秸秆降解率达到56.3%。
3)群落结构发生明显变化,种属多样性有下降趋势,与木质纤维素降解相关的优势菌群Bacillus(芽胞杆菌属)、Thern olactis(热乳芽胞杆菌属)、Scopulariopsis(帚霉属)及Aspergillus(曲霉属)多样性显著提高。
4)该研究提供了一种BLSS中固体废物的生物处理的方法,并为固体废物处理菌剂制备提供参考。

