生物强化A/O 工艺处理规模化制革废水效果研究
朱超,贾柳,张文婷,岳丹晴,马宏瑞
(陕西科技大学环境科学与工程学院,陕西西安710021)
在废水污染控制行业,生物原位强化是采用引入外源菌种或生物促生剂的方式,经土著微生物驯化和代谢激活,强化原有废水处理生化系统功能,或缩短系统生化功能的恢复周期[1]。生物原位强化技术的目标为用生化的方式来替代进水的物化预处理方式,在污染物协同去除的基础上逐步减少物化混凝药剂的使用,减少物化污泥产量;强化系统生化降解效率,提升系统出水指标,降低系统综合运行费用;实现高浓度有机废水脱氮除磷处理[2]。
在制革行业中,因在加工过程中使用材料大多为植物鞣剂、蛋白酶、铬鞣剂等,有机含铬废水具有高化学需氧量(COD)、氨氮的特点[3]。一般制革综合废水中COD 为2000~4000 mg/L、NH3-N 为200~400 mg/L。传统的A/O 工艺在处理制革废水过程中存在水解酸化不彻底[4]、污泥量大、出水氨氮不稳定[5-6]等问题。在实验室条件下,基于单一菌株的生物强化通常在去除特定污染物方面非常有效。研究表明[7],将菌株Burkholderia pickettii 投加在处理制革废水的厌氧- 缺氧- 好氧工艺中,3段的COD 去除率分别达25%、16%、59%。使用一种从天然土壤中富集的新型微生物复合菌剂(BM-S-1)用于处理韩国皮革制造业废水,COD、TN和TP 的去除效率分别大于91%、79%和90%;缓冲罐(B),一次曝气(PA),二次曝气(SA)和污泥消化罐(SD)中的分别显现优势种变形杆菌,硬毛菌,拟杆菌,浮游菌和嗜热球菌[8]。但是在规模化工程应用条件下,外加菌剂往往与生物处理系统中的土著菌在种间竞争中呈现群落和代谢功能衰退的现象,从而导致生物强化的效果不好,或为达到效果大量接种导致施用成本高[9]。因此必须通过改善菌剂强化方式和运行参数来达到高效低投入的目的。目前仍缺少在规模化生产中进行工艺嵌入式的菌剂强化效果研究,特别是菌剂不同强化方式,如活化方式和投加方式对处理效果的研究;菌剂投加后处理系统中微生物群落演替及代谢功能变化的系统评估几乎是空白。而这些问题的研究对于菌剂生物强化工业水污染控制的高效精准化、技术实施的低成本化和推广具有重要意义。
为优化制革废水处理A/O 工艺,优化菌剂强化效率,本研究在传统A/O 工艺的O 段投加不同活化方式的功能菌剂,探究对脱氮、脱碳效率的影响。应用宏基因组分析和基于Biolog 板的碳代谢指纹分析不同活化方式对强化过程中菌剂和各单元活性污泥体系中微生物群菌落结构的影响,探究菌剂强化后各生物处理单元功能菌群的演替及相应的代谢功能变化。为制革废水处理提供一套高效脱碳脱氮的分段生物强化处理技术体系。
1 材料与方法
1.1 处理工艺及运行现状
本研究在河北某制革厂综合废水处理站进行生物强化实施和效果评价,该废水处理工艺流程如图1 所示,各单元主要运行参数如下:该废水站处理水量5000 m3/d,废水经粗格栅、细格栅和筛网除废水中的体积较大的悬浮物和沙渣,在调节池加药处理后进入沉淀池进行沉淀,综合废水进入后续生化系统。综合废水进水COD 为3500~5000 mg/L,NH3-N 为 150~200 mg/L,S2-为 100~200 mg/L,SS 为300~450 mg/L。水解酸化池水力停留时间(HRT)为12 h,溶解氧(DO)小于0.3 mg/L;好氧池水力停留时间为35 h,溶解氧保持3.0~4.0 mg/L;各生化单元中MLSS 为7000~9000 mg/L。好氧 段 废 水 COD 为 600~800 mg/L,NH3-N 为180~220 mg/L。
1.2 菌剂多级活化强化实验
1.2.1 多级强化活化实验菌剂
实验所用的菌剂为复合功能菌剂Eure-01。该菌剂为国内某环保公司生产销售的复合功能菌剂,主要由变形菌属、拟杆菌属等组成,常用于污水处理中的生物强化技术。该制革厂综合废水处理站选用此菌剂的主要目的是强化COD 的削减,同时一定程度上提高氨氮去除率。
1.2.2 菌剂强化营养液
菌剂活化过程中所使用的营养液的组成成分为糖蜜3 g/L、葡萄糖0.2 g/L、酵母膏0.1 g/L、蛋白胨0.2 g/L、磷酸氢二钾0.04 g/L、磷酸二氢钾0.03 g/L 以及硫酸镁0.02 g/L。
1.2.3 菌剂多级活化强化小试
投加菌剂、营养液于锥形瓶内,其中菌剂干粉投加量为5%、营养液投加量为95%,将烧杯置于30 ℃恒温培养箱内振荡培养48 h,使DO 保持在1.5~2.0 mg/L,获得菌剂第一级活化液。将第一级菌剂活化液与生化调节池混合液(MLVSS≥2000 mg/L)按照体积比为1∶9 置于1 L 烧杯内进行曝气培养24 h,使DO 保持在2~3 mg/L,获得第二级菌剂活化液。
将河北某制革厂综合废水处理站好氧污泥与好氧段废水进行混合,使SV30 控制在30%左右,在烧杯中进行不间断曝气,其中对照组不投加任何菌剂。菌液活化的处理实验,采用分批投加0.1%第二级菌剂活化液方式,每24 h 投加一次;直投菌粉的处理实验投加等量菌剂干粉,并在24 h 实施菌粉的重复投加。每个处理重复两次,每次处理实验持续3 的d。每隔24 h 移取5 mL 上清液,测定COD 和NH3-N 指标。
1.2.4 菌剂多级活化强化工程应用
投加菌剂、营养液于母液桶内,其中菌剂干粉投加量为5%、营养液投加量为95%,扩配最佳温度为30 ℃,曝气培养,使DO 大于2 mg/L,获得菌剂第一级活化扩配母液。单批母液扩配时间大于48 h,单次培养1 t。母液桶使用2 立方米塑料桶两套,设置曝气系统,实现连续培养。将母液和生化调节池混合液(MLVSS≥2000 mg/L)按照体积比为1∶9 置于活化液桶中进行24 h 混合活化,DO 大于2 mg/L,单次培养10 t,获得第二级菌剂活化液(2.1 × 109 个/mL)。活化液桶使用11 m3现场池体两套,设置曝气系统,实现连续培养。系统运行稳定后,在处理站日常运行过程好氧池中投加上述第二级菌剂活化液,投加量为单次10 t,每天一次持续6 d。
等量菌剂干粉直接投加至好氧池内(7.3 ×107个/mL);不添加营养液强化,在第一级活化过程中使用清水对等量菌剂进行活化,之后采用上述相同的第二级活化方式获得的菌剂活化液(6.3× 108个/mL)投加至好氧池为两组对照。
按照批次实验的方式,每种不同活化方式的菌剂投加间隔为一周,目的是使生物处理系统中的群落恢复原来状态,避免前一次菌剂强化的影响。分别监测每一批次好氧段出水水质指标,每隔12 h 取样检测水质pH、COD 及NH3-N 浓度变化,连续检测6 d。
1.3 处理系统微生物群落代谢测定和多样性分析
1.3.1 功能菌剂代谢能力分析
Biolog 法常作为便捷手段被用于研究微生物群落的代谢特性及功能多样性,优点是可省略分离阶段而直接将水样接种至96 孔板[10]。本研究通过活化菌剂直接接种,酶标仪设置波长602 nm 测定菌剂样品吸光度,计算AWCD 值(平均吸光度)分析功能菌剂代谢能力。
式中:Ci为反应孔的吸光度;R 为空白孔的吸光度;n 为计算孔数。
1.3.2 菌剂微生物机制谢功能分析
Biolog EcoPlate 是一款用于测定微生物群落碳代谢的微平板培养基。每块微平板培养基上共96个微孔,每32 个孔为1 组,每组包含1 个空白及31 种碳源,共3 组实现3 次平行重复。分别取多级强化活化后菌液、好氧池(MLVSS 6000 mg/L)、水解酸化池(MLVSS 3000 mg/L)样品于50 mL 离心管内,设定离心转速为2000 r/min,离心时间为10 min,离心温度为4 ℃的条件下进行离心,取离心后的上层清液稀释进行接种。酒精擦拭超净工作台并对其进行30 min 紫外消毒,之后点燃酒精灯进行无菌操作;Ecoplate 平板培养基内,样品孔接种150 μL 样品清液,空白孔接种等量0.9%生理盐水,将接种好的平板培养基置于28 ℃的环境下恒温培养;酶标仪设置波长602 nm,每24 h 读取一次数据,连续检测240 h,读板前低速震动5 s 使孔内颜色均匀。
1.3.3 菌剂微生物多样性分析
以菌剂干粉为对照,取样编号为A;菌剂在营养液内进行多级活化强化后投加入好氧池,取第六天好氧池样品编号为B;菌剂在清水中进行多级活化后投加入好氧池,取样品编号为C;经干粉菌剂直接投加后活性污泥混合水样,取样品编号为D。将活化后的样品取样放入50 mL 离心管内,设定离心转速为5000 r/min,离心时间为10 min,离心温度为4 ℃的条件进行高速离心处理。离心结束后,去掉离心管内上层清液,获得不同强化方式下的活性污泥样品进行微生物群落结构分析。
1.4 分析方法
COD 的测定采用快速消解法,参考国标《HJ/T399-2007》;NH3-N 的测定采用纳氏试剂分光光度法,参考国标《HJ 535-2009》;MLSS、MLVSS浓度的测定采用重量法;pH 的测定采用仪器快速测定。Origin 处理AWCD 值并作图分析菌剂的代谢特征。Heml 1.0.3.3-Heatmap Illustrator 绘制菌群代谢功能热图。对收集到的样品基于Illumina HiSeq 测序平台,利用双末端测序(Paired-End)的方法[11-12],构建小片段文库进行测序分析菌剂微生物群菌落结构特征。
2 结果与讨论
2.1 菌剂处理效能的影响
2.1.1 菌剂强化处理制革废水
为了解菌剂的生产特点和作用效果,在实验室内进行模拟实验。表1 为投加菌剂进行生物强化处理前后效果对比。结果显示,COD 和NH3-N去除率均有显著提高,加多级菌剂活化液后分别提高45.11%、39.32%。因此将该菌剂的多级活化方式应用至实际污水处理流程中,探究其工程化应用过程中的处理效能。
2.1.2 菌剂多级强化工程处理效能
菌剂对好氧池内碳氮去除的影响如图2 所示。其中,空白为未投加菌剂前好氧池污泥对COD和氨氮的去除效果;样品B 为好氧池内投加菌剂活化强化液后的处理效果;样品C 为不添加营养液,仅使用清水对等量菌剂进行多级活化后的活化液投加至好氧池后的处理效果;样品D 为菌剂直接投加后好氧池的处理效果。经不同活化方式活化后的菌剂及未活化的菌剂投入至好氧池,其对COD 去除率和NH3-N 去除率均呈现促进的变化趋势。
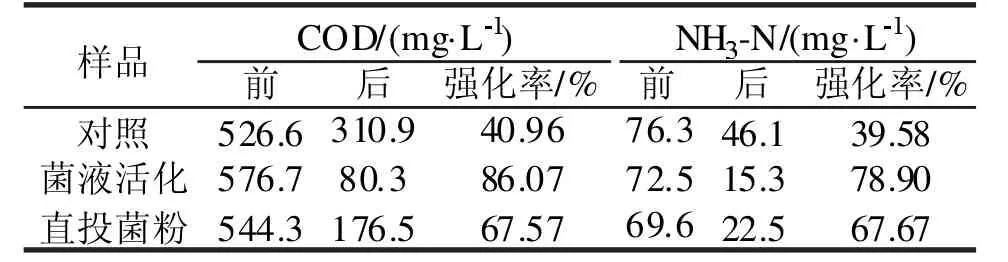
表1 投加菌剂前后处理效果Tab.1 Treatment effect before and after adding bacteria agent

图2 不同处理情况下COD 和NH3-N 去除率的变化Fig. 2 Changes in removal rates of COD (a) and NH3-N (b) under different treatment conditions
由图2 可以看出,当活性污泥内未添加菌剂时,好氧池内COD 去除率保持在35%~50%左右,NH3-N 的去除率保持在20%~35%。在采用营养液进行多级活化的菌剂与活性污泥的共同作用下,反应器中的COD 去除率和NH3-N 的去除率有了明显的提升。COD 去除率可保持在80%~90%之间,系统出水COD 平均去除率分别较未投加前强化50%左右,较菌剂未活化直接投加强化率接近30%。NH3-N 去除率可保持在65%~80%之间,系统出水NH3-N 平均去除率分别较未投加前强化率为40%左右,较菌剂未活化直接投加强化率为30%左右。可能的原因是多级活化过程中营养物质的引入缩短了菌剂的停滞期,使菌剂更快进入对数生长期;同时原厂废水的适应性驯化使菌剂中的功能微生物更容易适应废水环境[13]。
2.2 菌剂代谢特性
2.2.1 功能菌剂代谢能力
对在营养液中多级活化强化获得的菌剂样品采用Biolog 法进行微生物群落的代谢特性及功能多样性检测。图3 为多级活化强化菌剂96 h 内对6 类碳源代谢变化情况。6 类碳源分别是E-coplate上31 种碳源经过分类后的复合碳源,分别为酯类、糖类、醇类、胺类、酸类及氨基酸类(如图4 下部所注),可以用来表征微生物群落碳源代谢能力强弱以及针对各类碳源的代谢能力是否均衡;由图3 可看出,随着培养时间的推移,菌剂样品对各类碳源代谢的AWCD 值逐渐增加且相近。可以说明经过活化强化后的菌剂对类碳源的利用能力均逐渐增加且均衡,活化强化后的菌剂样品针对6类碳源均有较高的碳源利用能力。
2.2.2 菌群代谢差异
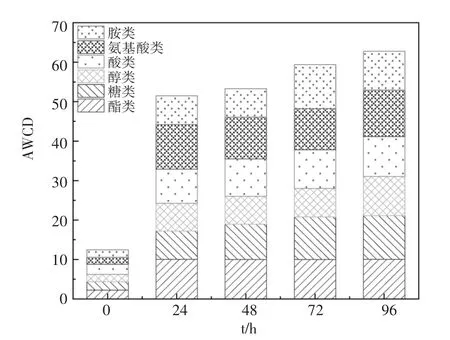
图3 菌剂对6 大类碳源代谢图Fig. 3 Metabolic maps of bacterial agent to 6 types of carbon sources

图4 菌剂的代谢功能热图Fig. 4 Metabolic function heat map of bacterial agent
分别对多级强化活化菌液、投加菌剂强化后的好氧池以及水解酸化池内的活性污泥样品进行E-coplate 培养,对所得数据进行处理获得AWCD值,并利用Heml1.0.3.3-Heatmap Illustrator 软件作图,得到图4 菌剂代谢功能热图。图中色块表征各单元对31 种碳源的利用程度,图右侧所示色阶由红变蓝表示AWCD 值由大到小逐渐降低。AWCD值的大小可以用来表征微生物对碳源的利用能力,表征微生物菌群代谢的功能强弱。马宏瑞等[14]发现当AWCD 值大于1.5 时,可以说明微生物能够很好地利用碳源。由图4 可知,多级强化活化后的菌剂AWCD 值除丙酮酸甲酯外均大于1.5,最大可达到2.44。说明经过多级活化强化后的菌剂微生物群落对碳源的利用能力好,具有制革污水处理所需的高代谢潜力。结合结果2.2.1 可知,该菌剂经过多级强化活化后菌群碳源代谢活性良好且功能均衡。好氧池、水解酸化池内的微生物群落代谢活性虽然低于菌剂活化液中微生物代谢活性,但也具有较好的碳代谢能力,有利于废水处理中碳源的去除,与图2 中COD 的较高去除率一致。色阶中蓝色越深表示菌群碳代谢能力弱、群落衰退程度高,由图可知在好氧池内微生物对6 类碳源中偏好利用脂类、糖类,利用醇类的菌群衰退严重。这与马宏瑞等[14]的研究中,各单元单一碳源代谢活性较菌剂呈现差异性衰退,但对6 类碳源的利用情况均为偏好利用糖类,利用醇类的菌群衰退最严重相一致。

表2 未活化菌剂与不同活化方式下菌剂菌群多样性指数的变化Tab. 2 Changes of diversity index of bacterial flora for the non-activated and activated bacterial agents
2.3 菌剂微生物群落结构分析
2.3.1 微生物多样性分析
菌群经过Illumina MiSeq 高通量测序平台进行基因测序后,共获得2009 条有效序列,表2 为未活化菌剂与不同活化方式下菌剂菌群的有效序列分布情况。通过检测样品Alpha 多样性来反映物种丰度及物种多样性。
由表2 可知,将菌剂在不同的方式下进行活化对比菌剂干粉(样品A1、A2、A3),菌剂在干粉状态下ACE 指数,Chao1 指数和Shannon 指数均为最大。Chao1 和Ace 指数数值越大,微生物群落丰富度越高,由此可知干粉自身生物多样性,生物群落多样性高[15]。但是在不同方式下活化对应菌剂使用方法,菌剂在营养液中活化后工程应用(样品B1、B2、B3)、在水中活化后工程应用(样品C1、C2、C3)为菌剂多级活化方式[16];在活性污泥中活化(样品D1、D2、D3)对应工程应用中的直接投加。相较于三种不同的使用方式,由表2 可知,菌剂在营养液中进行多级强化活化后,ACE 指数、Chao1 指数、Simpson 指数和Shannon 指数相交于其他两种活化方式的较高。说明在此条件下活化的菌剂生物群落多样性高;优势微生物占微生物群落总生物最高[17],菌剂多级活化方式有利于提升废水处理中优势微生物种群占总生物量的比例。另外还统计了有效序列覆盖率Coverage,其数值越高,则样本中物种被测出的概率越高,而没有被测出的概率越低[18]。由表可知Coverage 指数几乎接近于1,可以说明菌剂样品的测序结果可以反映菌剂干粉以及不同活化方式下菌剂的微生物群落的实际情况,结果更具有说服力。因此可以证明菌剂在营养液体培养液中进行活化有利于菌剂在后续工程中的应用。
2.3.2 微生物群落结构分析
在本阶段所选取4 组样品中,共统计得到个十个主要科类,并包含其他物质。图5 为不同活化方式对菌剂和投加后处理系统中微生物群落结构(科)的影响。其中可明显观察到的主要科类为莫拉氏菌科(Moraxellaceae)、芽孢杆菌科(Bacillaceae)、伯克氏菌科(Burkholderiaceae)、黄色单胞菌科(Xanthomonadaceae)、肠杆菌科(Enterobacteriaceae)、梭 菌 科(Clostridiaceae_1)、肠 球 菌科(Enterococcaceae)、高温放线菌科(Thermoactinomycetaceae)、第三类芽孢杆菌科(Paenibacillaceae)、柄杆菌科(Caulobacteraceae)。

图5 不同活化方式对菌剂和投加后处理系统中微生物群落结构(科)的影响Fig.5 Effects of different activation methods on the microbial community structure(Family)in bactericides and post-treatment systems
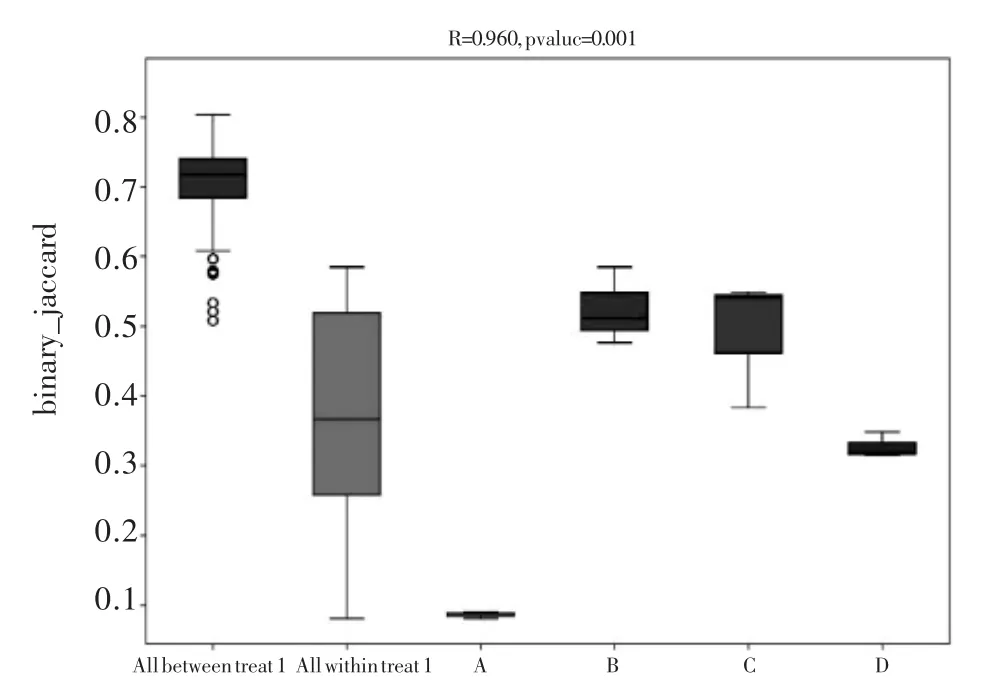
图6 微生物群落结构PERMANOVA 分析图Fig. 6 PERMANOVA analysis of microbial community structure
由图5 可知,未活化菌剂与不同活化方式下,不同微生物的占比呈现不同的变化情况。由图可以看出,在营养液多级强化活化情况下,黄色单胞菌科(Xanthomonadaceae) OTU 数量可占25.7%,数量远远多于菌剂以及其他活化方式。根据Han 等人[19]的研究表明,黄色单胞菌科(Xanthomonadaceae)为生物反应器中分离出用于制革废水处理的硝化细菌,黄色单胞菌科微生物参与硝化反硝化反应,并伴有细胞增殖,可加强污水中脱氮效果,与结果2.1 中NH3-N 去除率增加的结果相符合。同时,伯克氏菌科(Burkholderiaceae)可占22.3%,有研究表明,伯克氏菌科可将氨氮氧化为硝酸盐[20]。芽孢杆菌科(Bacillaceae)、柄杆菌科(Caulobacteraceae)等,对比菌剂以及其他活化方式,这两科的菌群丰度均有一定程度的增长,有研究表明芽孢杆菌菌种对制革废水处理具有促进作用,可以强化废水处理有机污染物的能力[21]。同时菌剂干粉中的高温放线菌科(Thermoactinomycetaceae)应用于废水处理中,丰度明显降低。不利于制革废水处理的肠球菌科(Enterococcaceae)微生物经过营养活化后不再为主要科类,非功能菌群数量降低甚至消失。可以证明经营养活化后的菌剂可以与废水处理过程中好氧池内的土著微生物相适应,经过活化后功能菌群数量增加,更有利于污水处理效果的提升。因此可以推测菌剂进行多级活化强化后,菌剂的投加重构优化了活性污泥的群落代谢能力,更利于废水处理的应用。
2.3.3 微生物群落结构PERMANOVA 分析
PERMANOVA 又称置换多元方差分析,它们主要是用于分析多维度数据组间相似性的统计方法。依据距离矩阵对总方差进行分解的非参数多元方差分析方法。使用PERMANOVA 可分析不同分组因素对样品差异的解释度,并使用置换检验进行显著性统计。在生态统计中,可以使用PERMANOVA,查看不同群落组成结构差异是否显著[22]。对4 组菌剂样品进行16S 测序样本(菌剂微生物群落),4 组样品每组各进行3 组平行取样获得12 个样本。图6 为基于PERMANOVA 方法的菌剂群落组成结构差异分析。PERMANOVA 分析得到的R 表示不同分组对样品差异的解释度,即分组方差与总方差的比值,R 越大表示分组对差异的解释度越高,R 值越接近1 表示组间差异越大于组内差异,R 值越小则表示组间和组内没有明显差异,P 值小于0.05 时说明检验的可信度高[23]。从图6 中可以看出,R 等于0.960,说明菌剂干粉样品和不同活化后的菌剂组间存在差异且显著大于组内差距,证实了结果2.3.2 中菌剂多级活化强化后的微生物群落结构的显著改变。不同样品组间和组内的微生物群落结构差异显著性,菌剂干粉和其他活化后菌剂组间差异大,活化后的菌剂间相对差异不大。菌剂经过多级活化强化,群落结构的变化影响生物强化效果,可能原因是核心菌群黄色单胞菌科(Xanthomonadaceae) 和伯克氏菌科(Burkholderiaceae)的增加,以及非功能菌群数量的降低;或者是根据代谢指纹图谱看出,菌剂对活性污泥整体代谢网络强化的结果。Pvalue 值为0.001,说明检验的可信度极高。
3 结论
1)针对本文所研究的菌剂多级活化强化投加法,将菌剂投加至好氧池,可提高处理效率并节约成本,COD、NH3-N 除率较未投加菌剂分别可得到50%、40%的强化;较菌剂直接投加均可得到30%的强化。对降低处理成本、污泥减量具有指导意义。
2)菌剂经过多级强化活化后菌群碳源代谢活性良好且功能均衡,强化菌剂的添加有对活性污泥整体代谢网络的强化和核心功能种群的稳定作用。
3)微生物群落结构分析结果表明,经过菌剂强化应用于废水处理时,活化过程中添加营养液与其他两种活化方式相比较,更有利于增加微生物种群的物种多样性;同时可以改善活性污泥菌群结构,促进污水处理中功能菌的生长。菌剂微生物群落中可强化废水氨氮的能力的黄色单胞菌科、伯克氏菌科微生物DNA 序列操作分类单元分别可占25.7%和22.3%;非功能菌群数量逐渐降低。强化活化后的菌剂可以与土著微生物更好适应。

