骨髓间充质干细胞穴位移植对痴呆大鼠内源性神经干细胞增殖分化的影响
李容念 ,赵文博 ,赵平 ,朱伟 ,郭建军 ,席家祥 ,赵瑞成
(1.湖南中医药大学,长沙 410208;2.湖南省中医药研究院,长沙 410006;3.河北省尚义县医院,张家口 076750)
内源性神经干细胞(neural stem cells, NSCs)在成人脑组织中主要分布于侧脑室下层(SVZ)和海马齿状回两处[1],具有干细胞多分化潜能的生物学特性,可通过定向诱导增殖分化为某种特异神经元以替代损伤神经元,有效治疗中枢神经系统退行性疾病[2-3],故促进内源性 NSC增殖与分化有望成为阿尔茨海默病(Alzheimer's disease, AD)治疗的新途径。本研究拟通过外周少量骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSC),利用腧穴激发作用和经络的循经作用,诱导痴呆大鼠脑内内源性NSC增殖、分化,探讨治疗AD的新技术与方法。
1 材料与方法
1.1 实验动物
8周龄SPF级SD大鼠50只,体质量(210±20)g,由广州永诺生物技术有限公司提供,许可证号 SCXK(粤)2013-0034。实验大鼠在自由饮食、温度 21℃~27℃、正常环境下饲养 1周后开始实验,实验过程遵循湖南中医药大学实验动物伦理规范。
1.2 主要试剂和仪器
Aβ1-42(A118755,阿 拉 丁 );Nestin 抗 体(SC- 23927,Santa cruz);β-Tubulin-Ⅲ(BM3880,博士德生物科技有限公司);MS二抗IgG(Ab150106,Abcam);Rb二抗IgG(AB150074, Abcam);Hoechst 33258(H1399, Invitrogen);SD 大鼠骨髓BMSC细胞(SCSP-402,上海细胞库);双臂脑立体定位仪(SA-Ⅱ,广州必特生物科技有限公司);高速颅骨钻(JC100A,Saeshin);水迷宫(广州必特生物科技有限公司);全自动正立荧光显微镜(德国CARL ZEISS)。
1.3 模型制备
从50只大鼠中按照随机数字表法抽取10只大鼠作为对照组,剩余 40只大鼠采用Aβ1-42寡聚体侧脑室灌注建立大鼠AD模型[4]。以4%水合氯醛按8 μL/g的剂量腹腔麻醉,动物麻醉后固定于脑立体定位仪上。参考Paxinos和Watson大鼠脑立体定位图谱,以前囟平面为参考平面,按照海马CA1区坐标确定进针部位,即前囟后3.8 mm(A/P),中线旁开2.5 mm(L/R),前囟下3 mm(H),两侧各注射溶于PBS的质量浓度为4 g/L的Aβ1-42 1 μL,对照组同以上方法在双侧海马CA1区各注射1 μL的生理盐水。
1.4 分组与干预
将40只造模成功的AD大鼠采用随机数字表法平均分为模型组、风府穴组、足三里穴组、尾静脉组。大鼠 BMSC细胞复苏后,采用 Gibco公司 10%FBS的a-MEM培养基于5% CO2、37℃细胞培养箱中正常培养,取对数生长期细胞,胰酶消化成单细胞,再用培养基终止消化,离心去除培养基,最后将细胞重悬于PBS溶液中,调整其密度为2×106个/mL。风府穴组于风府穴向后下方斜刺1 mm注入BMSC 1×106个/500 μL;模型组风府穴注入500 μL生理盐水,足三里穴组随机选单侧足三里穴进针 3~5 mm注入 BMSC 1×106个/500 μL;尾静脉组从尾静脉注入 BMSC 1×106个/500 μL;对照组作为空白对照不做处理;大鼠风府穴位于枕骨顶脊后枕寰关节背凹陷处;足三里穴位于膝关节外侧腓骨小头下约5 mm处。大鼠穴位定位参考《实验针灸学》相关定位方法[5]。
1.5 样本采集与处理
各组干预处理 4周后,采用水迷宫行为学检测各组大鼠学习记忆能力。水迷宫实验结束后,进行心脏灌注[6],开颅进行脑组织取材,常规石蜡包埋切片。免疫荧光检测Nestin、β-Tubulin-Ⅲ蛋白在组织切片中的表达,在全自动正立荧光显微镜下观察 Nestin+、β-Tubulin-Ⅲ+细胞,随机拍摄 4个不重叠的视野,用Image J软件计数4个视野下阳性细胞总数,以平均数表示其相应的阳性细胞数[7-8]。
1.6 观察指标
1.6.1 水迷宫行为学检测
水迷宫行为学检测包括定位航行试验和空间探索试验,采用大鼠逃避潜伏期(EL值)和120 s内穿越虚拟平台次数作为检测指标,以评价大鼠的学习能力和记忆能力。定位航行实验将各组受试大鼠按顺时针的顺序分别从水池 4个象限入水点依次放进水中,电脑记录大鼠120 s内寻找平台的时间(即为逃避潜伏期,escape latency, EL),EL 值记录单位为(s)。空间探索实验撤去池中平台,再选择水池第一象限的同一入水点,然后将大鼠面朝水池壁方向放置水中,电脑记录大鼠120 s内穿越虚拟平台(即原平台位置)次数,并以此评估大鼠的存储记忆、提取再现的能力。EL值越大、穿越平台次数越少代表大鼠学习记忆能力愈差。大鼠造模4周后,采用Morris水迷宫行为学测试以评估大鼠AD模型。以对照组大鼠EL的平均值为参考值,计算每只造模大鼠与参考值之差占该大鼠EL的比值,若该值>20%则纳入模型,并统计分析对照组与模型EL值、穿越平台次数,以判定大鼠AD模型构建是否成功[9-10]。各组大鼠干预处理后,再次进行水迷宫行为学检测。
1.6.2 Nestin、β-Tubulin-Ⅲ蛋白表达检测
将组织切片放置恒温箱中60℃烘烤20 min后,放置于二甲苯Ⅰ、Ⅱ中浸泡 10 min,再将组织切片依次放在无水乙醇、95%乙醇、70%乙醇中各浸泡5 min,PBS洗两次,每次 5 min。将 0.01 M枸橼酸钠缓冲溶液(pH6.0)用电炉加热至 95℃左右,放入已水化后的组织切片煮沸10~15 min,待缓冲液冷却后,将切片取出,用PBS洗3次,每次5 min。滴加5%正常山羊血清,室温封闭1 h,吸去多余液体。于两张组织切片上分别滴加 Nestin、β-Tubulin-Ⅲ抗体(浓度分别为 1:200,1:100),放置冰箱4℃过夜,次日37℃复温45 min,PBS洗3次,每次2 min。各张组织切片上分别滴加相对应的 Alexa555荧光标记的二抗,室温避光孵育1 h,PBS洗3次,每次2 min。在每张切片上滴加50 μL PBS稀释 1000倍的 Hoechst,染色 10 min,PBS洗 3次每次2 min,中性树脂封片,待其凝固后拍照。
1.7 统计学方法
应用Graghpad Prism7.0软件进行统计学处理。符合正态分布的计量资料以均数±标准差表示,多组完全随机设计计量资料满足正态分布及方差齐性检验,采用单因素方差分析组间差异,进一步组间比较采用Tukey法检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 两组大鼠造模后EL值、穿越平台次数比较
与正常组比较,模型组EL值显著增加(P<0.01),穿越平台次数显著减少(P<0.001)。详见表1。
表1 两组大鼠造模后EL值、穿越平台次数比较 (±s)

表1 两组大鼠造模后EL值、穿越平台次数比较 (±s)
注:与对照组比较1)P<0.01
组别 n EL(s) 穿越平台次数(次)对照组 10 26.03±1.32 9.20±1.69模型组 10 48.74±5.801) 3.30±1.341)
2.2 各组大鼠干预后EL值、穿越平台次数比较
与模型组比较,大鼠BMSC穴位移植后风府穴组的EL值无明显降低(P>0.05),穿越平台次数无明显增加(P>0.05);而尾静脉组的EL值显著降低(P<0.01),穿越平台次数显著增加(P<0.01)。与对照组比较,尾静脉组 EL值显著延长(P<0.01),穿越平台次数减少(P<0.05)。详见表2。
表2 各组大鼠干预后EL值、穿越平台次数比较 (±s)

表2 各组大鼠干预后EL值、穿越平台次数比较 (±s)
注:与对照组比较 1)P<0.05,2)P<0.01;与模型组比较 3)P<0.01;与风府穴组比较 4)P<0.05,5)P<0.01;与足三里组比较6)P<0.01
组别 n EL(s) 穿越平台次数(次)对照组 10 27.19±2.11 9.50±1.35模型组 10 45.87±1.862) 3.50±1.272)风府穴组 10 42.19±1.632) 4.80±1.232)足三里组 10 44.59±4.202) 4.10±1.662)尾静脉组 10 35.54±1.892)3)4)6) 7.30±2.001)3)5)6)
2.3 各组大鼠干预后海马区 Nestin、β-Tubulin-Ⅲ蛋白的表达
采用免疫荧光法检测各组大鼠海马区 Nestin、β-Tubulin-Ⅲ蛋白的表达,评估大鼠BMSC风府穴穴位移植干预治疗对 AD大鼠海马区内源性神经干细胞增殖与分化的影响。与模型组比较,风府穴组Nestin细胞数增加(P<0.05),尾静脉组增加(P<0.01),足三里组无明显变化(P>0.05);与尾静脉比较,风府穴组Nestin+细胞数无明显差异(P>0.05);表明大鼠BMSF风府穴穴位移植能促进海马区内源性神经干细胞增殖,效果与尾静脉组相当。详见图1,表3。
β-Tubulin-Ⅲ蛋白表达,显微镜下细胞膜或胞质显红色者为β-Tubulin-Ⅲ+细胞,见图 2,细胞计数见表 4。与模型组比较,风府穴组β-Tubulin-Ⅲ+细胞数无明显增加(P>0.05)。

图1 荧光显微镜下各组Nestin+细胞

图2 荧光显微镜下各组β-Tubulin-Ⅲ+细胞
表3 各组大鼠干预后Nestin+细胞个数 (±s,个)

表3 各组大鼠干预后Nestin+细胞个数 (±s,个)
注:与模型组比较 1)P<0.05,2)P<0.01;与风府穴组比较 3)P<0.01;与足三里组比较4)P<0.01
组别 n 细胞个数对照组 10 8.00±0.82模型组 10 5.00±1.47风府穴组 10 9.13±2.101)足三里组 10 4.75±1.713)尾静脉组 10 10.50±2.082)4)
表4 各组大鼠干预后β-Tubulin-Ⅲ+细胞个数(±s,个)
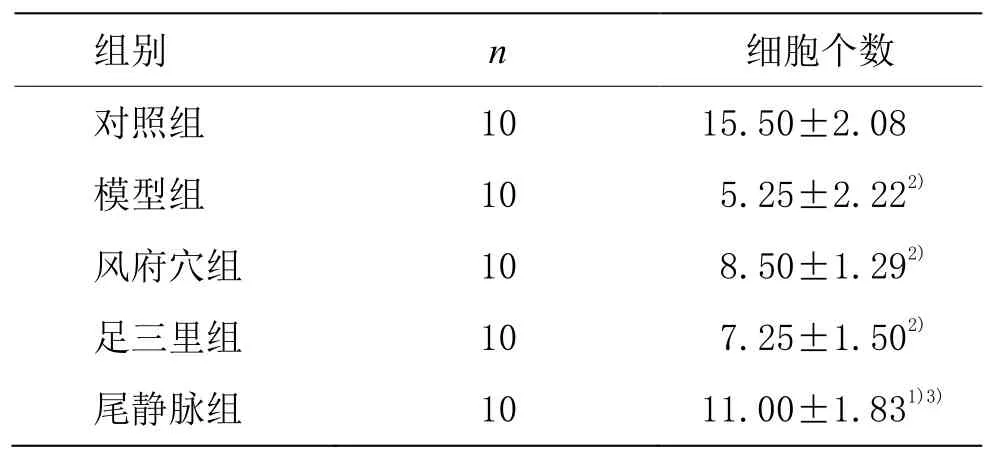
表4 各组大鼠干预后β-Tubulin-Ⅲ+细胞个数(±s,个)
注:与对照组比较 1)P<0.05,2)P<0.01;与模型组比较 3)P<0.01
组别 n 细胞个数对照组 10 15.50±2.08模型组 10 5.25±2.222)风府穴组 10 8.50±1.292)足三里组 10 7.25±1.502)尾静脉组 10 11.00±1.831)3)
3 讨论
阿尔茨海默病是以海马神经元和突触的变性、丢失等病理改变为特征的一种与老化密切相关的中枢神经退行性疾病。该病致死、致残率高,随着人口老龄化的加剧,AD的治疗已成为社会关注的热点问题。目前研究证实,神经干细胞移植或小分子药物影响神经干细胞再生可能成为AD治疗的新途径[11]。
3.1 神经干细胞移植与穴位移植
NSC有进一步分化为神经细胞的潜能,这与其特性有关,包括自我更新,NSC具有对称分裂及不对称分裂两种分裂方式,从而保持干细胞库稳定;多向分化潜能,NSC可以向神经元、星形胶质细胞和少突胶质细胞分化;低免疫源性,NSC是未分化的原始细胞,不表达成熟的细胞抗原,不被免疫系统识别;组织融合性好,可以与宿主的神经组织良好融合,并在宿主体内长期存活。BMSC同样具有干细胞特性,与NSC比较BMSC来源广泛、便于提取、纯化,采用BMSC做为干细胞移植,更具有可行性[12]。神经干细胞移植开创 AD等神经变性性疾病治疗的新途径,目前动物实验及临床应用中所使用的干细胞移植方法主要包括立体定向脑内注射移植、脊髓局部注射移植、腰椎穿刺蛛网膜下腔注射移植、脑室穿刺注射移植、枕大池穿刺移植、静脉内注射移植和动脉内注射移植。但每种方法均有优、缺点,且多数方法难以直接应用于临床。例如立体定向脑内注射移植、脊髓局部注射移植、脑室穿刺注射移植、枕大池穿刺移植等对神经系统损伤太大;腰椎穿刺蛛网膜下腔注射移植需透过脑脊液-脑屏障、静脉内注射移植和动脉内注射移植不仅移程长,还需透过血脑屏障(BBB),造成移行过程中干细胞损失太多。所以将外源性神经干细胞直接移植宿主神经系统,应用于临床并非易事,而且外源性神经干细胞直接移植宿主有致瘤性。本研究采用穴位移植方法,通过外周少量BMSC刺激作用,利用腧穴激发作用和经络循经作用,诱导脑内内源性 NSC增殖,可突破上述神经干细胞移植方法的局限性。经实验证实 BMSC通过风府穴与尾静脉移植均能诱导痴呆大鼠海马区内源性NSC增殖。
3.2 阿尔茨海默病与督脉风府穴
AD属于中医学“呆病”“癫证”“健忘”等范畴。病位在脑,病机为本虚标实,以肾虚致衰的学说为最[13]。《素问·脉要精微论》:“头者,精明之府”;《灵枢·海论》:“脑为髓之海”,肾主骨生髓,所以脑与肾关系密切;脑为奇恒之府,与奇经八脉的气血功能密切相关,其中尤以与督脉关系为最[14]。其次,头为诸阳之会,五脏六腑之清阳皆会聚于脑,而督脉为阳经之海,总督诸阳经,与脑、脊髓等关系相当密切,故历代医家素有“病变在脑,首取督脉”之说[15]。
经络学说认为“督脉起于胞中,下出会阴,后行于腰背正中,循脊柱上行,经项部至风府穴,进入脑内……”,《难经·二十八难》:“督脉者,上至风府,入属于脑”。说明风府穴是督脉经气进入脑内的“门户”。风府穴在项部,当后发际正中直上1寸,枕外隆凸直下,两侧斜方肌之间的凹陷中,深面正对延髓,位于颈脊顶部,周围有神经根分布。针刺风府穴可“通关开窍”,具有补髓益精、醒神开窍之功,现代医家运用毫针、电针、温针、灸法、穴位注射以及针药并用等方法治疗 AD[16]。风府穴也是临床与动物研究常用穴位,目前实验证实电针风府穴能使AD模型大鼠海马区脑源性神经营养因子(BDNF)及其受体TrkB与cAMP反应元件结合蛋白(GDNF)及其受体 GFR-α1表达水平增高,提示对胆碱能神经元有保护作用[17]。但风府穴在脑内内源性NSC增殖分化方面的研究尚不深入。
现代医学证实,由于血脑屏障(BBB)的存在,高达95%的静脉给药被阻挡于脑、脊髓之外。但部分脑脊区缺乏 BBB,与外周神经不同,脊神经根缺乏神经外膜和神经束膜,故没有神经束膜屏障功能,从而易受周围环境因素变化的影响。风府穴周围即分布有颈脊神经根。位于人体正中线上的“无屏障脑区、嗅黏膜-嗅球-SVZ入脑途径”是目前发现的外界物质入脑的最直接的解剖学证据[18]。这与中医学督脉的经络循行高度吻合,是督脉入脑的生理学与解剖学依据。选择督脉风府穴进行干细胞穴位移植,产生的局部刺激信息,抑或反应物,可能通过“无屏障脑区、嗅黏膜-嗅球-SVZ入脑途径”进入脑内SVZ,诱导内源性NSC增殖。本研究证实 BMSC风府穴穴位移植诱导痴呆大鼠海马区内源性NSC增殖作用与尾静脉移植相当。
3.3 阿尔茨海默病与中医刺灸疗法
AD是一个多病因的神经退行性疾病,炎症与氧化应激、代谢障碍、钙离子通道受损、线粒体障碍、神经营养因子缺乏等都与 AD的发生密切相关[19]。中医刺灸疗法可通过多途径、多靶点改善 AD动物模型的学习记忆能力[20]。艾灸可改善小鼠的记忆学习能力,其机制可能与减少大脑额叶皮层及海马区的 Aβ沉积有关[21]。针刺可调控p38 MAPK通路,降低AD大鼠海马区磷酸化Tau蛋白的表达[22]。电针可抑制神经细胞凋亡、促进中枢神经传递、调节能量代谢等[23-24]。穴位注射具备药物和针刺的双重功效,在治疗阿尔茨海默病方面仍需要进一步探究[25]。本项目采用生理盐水风府穴穴位注射,从内源性 NSC增殖角度与对照组没有明显区别,但不能证实穴位注射疗法没有其他作用。
3.4 神经干细胞与神经细胞定向分化
学习记忆是一个复杂的过程,突触改变是水迷宫记忆形成的神经生物学基础[26],移植的神经干细胞定向分化为成熟神经细胞,整合进入宿主的脑组织,或分泌神经递质促进神经系统的修复才能产生有益效果。而神经干细胞定向分化是一个复杂的过程,且神经干细胞增殖不一定与成熟神经细胞分化同步。研究发现AD患者海马区NSCs的数量和未成熟神经元标志蛋白表达增加,但成熟神经元标志蛋白没有增加[27]。成熟的神经元减少,不能完成相应的信号传导,导致学习和记忆障碍。移植的NSCs能够分化成熟神经细胞,但分化速度缓慢,且NSCs的分化与脑内微环境有关[28]。与上述研究结论相类似,本研究 AD大鼠学习记忆能力,风府穴组改善不明显,不及尾静脉组,可能与其促进增殖的内源性NSC向成熟神经细胞分化不明显有关。尾静脉组因BMSC直接注入血液,有可能改善了NSCs分化的脑内微环境,故其成熟细胞分化明显。这就提示BMSC穴位移植联合神经生长因子可能会改善NSCs向成熟神经细胞的定向分化。而 BMSC风府穴穴位移植诱导痴呆大鼠海马区内源性NSC增殖的分子机制与调控机制,有待进一步研究。

