一种4H-吡喃类衍生物的合成
郑 豪,鱼 涛,屈撑囤,李琬菁,王艳飞
(西安石油大学化学化工学院 陕西省油气田环境污染控制与储层保护重点实验室,陕西西安 710065)
吡喃类化合物具有广泛的生物活性,因此该类化合物的合成有着重要的意义。其中4H-吡喃类化合物是天然产物的主要基本单元,也是构建其他杂环化合物的重要合成中间体。目前已报道的文献表明其有抗癌[1-2]、抗过敏性[3]、抗衰老[4]、抑制癌细胞[5]和抗细胞毒素活性[6]等方面的作用。1,4-二氢吡喃与二氢吡啶互为电子等排异构体,是有效的钙拮抗剂,在外周血管扩张和抗高血压等方面有着显著的作用,因此,4H-吡喃类衍生物的合成日益受到化学家们的广泛关注,变成了有机合成的热点,而取代的吡喃和稠合吡喃也是重要的生物可降解的农用化学品[7]。
本文采用“一锅法”合成出8种新型的吡喃类化合物,并用红外吸收(IR)光谱与核磁共振氢谱(1H NMR)表征了产物的结构。
1 实验部分
1.1 试剂与仪器
4-羟基-6-甲基-2-吡喃酮、4-二甲氨基吡啶(DMAP),分析纯(AR),上海吉至生化科技有限公司;丙二睛、苯甲醛、2,4-二氯苯甲醛、2-甲氧基苯甲醛、4-硝基苯甲醛、2-氰基苯甲醛、2-氯-5-硝基苯甲醛、4-羟基-3-硝基苯甲醛、3,5-二溴-4-羟基苯甲醛,分析纯(AR),江苏艾康生物医药研发有限公司;无水乙醇、无水甲醇、石油醚、二氯甲烷、乙酸乙酯,分析纯(AR),天津富宇精细化工有限公司;溴化钾,优级纯(GR),天津市科密欧化学试剂有限公司。
液体超导核磁共振谱仪,INOVA 400 MHZ,美国瓦里安公司;傅里叶变换红外光谱仪,Is50 FT-IR,美国赛默飞世尔科技有限公司;旋转蒸发器,RE201D(2L),郑州华特仪器设备有限公司;显微熔点仪,RY-1,天津恒创立达科技发展有限公司;循环水式真空泵,SHZ-D(CLL),巩义市科瑞仪器有限公司;集热式恒温加热磁力搅拌器,DF-101S,西安常仪仪器设备有限公司;电子天平,MAX-C10001,天津市德安特传感技术有限公司;高效薄层板,烟台江友硅胶开发有限公司。
1.2 吡喃类化合物的合成
吡喃类化合物的合成路线见图1。
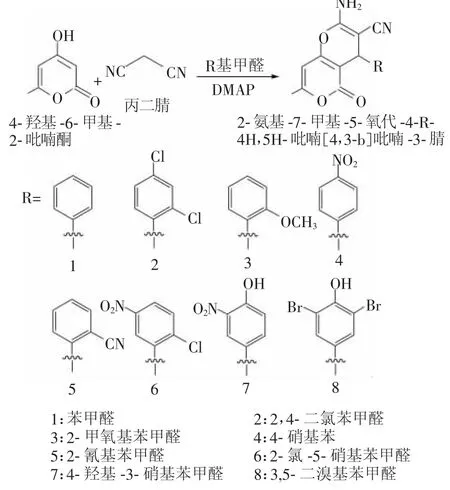
图1 吡喃类化合物的合成路线
1.2.1 2-氨基-7-甲基-5-氧代-4-苯基-4H,5H吡喃[4,3-b]吡喃-3-腈的合成
在干燥的250 mL三颈烧瓶中,放入1.1 g 4-羟基 -6-甲基 -2-吡喃酮、0.7 g丙二腈、0.12 g DMAP、2.1 g苯甲醛和50 mL无水乙醇,摇动混合,并加入磁子,装上回流冷凝管,盖上塞子,在90℃恒温反应条件下油浴加热搅拌1.0~1.5 h,薄层色谱法(TLC)监测,待反应结束后,静置冷却,产物析出,抽滤,用无水乙醇洗涤固体,抽干水分,得到粗产物(白色粉末),再用无水乙醇重结晶,在室温下冷却后再抽滤,把产品放在表面皿上置于烘箱干燥,称重,得到1.5 g白色粉末,取极少量产品溶于二氯甲烷中,用毛细管蘸取少量进行薄层色谱分析[8],展开剂V(二氯甲烷)∶V(石油醚)∶V(乙酸)=1∶2∶3,TLC显示一个点(比移值 Rf=0.516 1)。熔点:247~248 ℃,产率:61.37%。IR(KBr压片):3 401.01、3 086.11、2 891.46、2 199.19、1 712.58、1 674.02、1 197.17、1 262.26、1 138.73 和748.64 cm-1。1H NMR(DMSO-d6,δ):7.298~7.335(t,2H)、7.180 ~7.249(m,5H)、6.286(s,1H)、4.282(s,1H)和 2.224(s,3H)。
1.2.2 2-氨基-4-(2,4-二氯苯基)-7-甲基-5-氧代-4H,5H吡喃[4,3-b]吡喃-3-腈的合成
在干燥的250 mL三颈烧瓶中,放入1.2 g 4-羟基-6-甲基 -2-吡喃酮、0.7 g 丙二腈、0.12 g DMAP、3.4 g 2,4-二氯苯甲醛和50 mL无水乙醇,摇动混合,并加入磁子,装上回流冷凝管,盖上塞子,在90℃恒温反应条件下油浴加热搅拌1.0~1.5 h,TLC监测,待反应结束后,静置冷却,产物没有析出,放入冰箱3 h,之后取出产物析出,抽滤,用无水乙醇洗涤固体,抽干水分,得到粗产物(淡紫色晶体与粉末),再用无水乙醇重结晶,在室温下冷却后再抽滤,把产品放在表面皿上置于烘箱干燥,称重,得到0.8 g淡紫色晶体与粉末,取极少量产品溶于二氯甲烷中,用毛细管蘸取少量进行薄层色谱分析,展开剂V(二氯甲烷)∶V(石油醚)∶V(乙酸)=1∶2∶3,TLC显示一个点(比移值Rf=0.875)。熔点:250~251 ℃,产率:24.07%。IR(KBr压片):3 045.99、2 229.74、1 674.02、1 579.36、1 218.26、1 143.63、1 110.30、1 050.65、822.76 和 759.15 cm-1。1H NMR(DMSO-d6,δ):7.573~7.594(d,1H)、7.487~7.492(d,1H)、7.326(s,2H)、7.206~7.231(q,1H)、6.293(s,1H)、4.388(s,1H)和 2.234(s,3H)。
1.2.3 2-氨基-4-(2-甲氧基苯基)-7-甲基-5-氧代-4H,5H吡喃[4,3-b]吡喃-3-腈的合成
在干燥的250 mL三颈烧瓶中,放入1.1 g 4-羟基-6-甲基 -2-吡喃酮、0.7 g丙二腈、0.12 g DMAP、2.7 g 2-甲氧基苯甲醛和50 mL无水乙醇,摇动混合,并加入磁子,装上回流冷凝管,盖上塞子,在90℃恒温反应条件下油浴加热搅拌1.0~1.5 h,TLC监测,待反应结束后,静置冷却,产物没有析出,放入冰箱3 h,之后取出产物也没析出,放入旋转蒸发器中,将溶剂蒸发到原来的1/3左右为止,产物逐渐析出,抽滤,用无水乙醇洗涤固体,抽干水分,得到粗产物(白色粉末),再用无水乙醇重结晶,在室温下冷却后再抽滤,把产品放在表面皿上置于烘箱干燥,称重,得到2.1 g白色粉末,取极少量产品溶于二氯甲烷中,用毛细管蘸取少量进行薄层色谱分析,展开剂V(二氯甲烷)∶V(石油醚)∶V(乙酸)=1∶2∶3,TLC 显示一个点(比移值Rf=0.468 8)。熔点:270~271 ℃,产率:77.60%。IR(KBr压片):3 480.97、3 098.75、3 009.99、2 959.97、2 835.85、2 190.72、1 694.07、1 199.25、1 674.02、1 141.79、1 103.40、1 024.54、769.31 和 751.74 cm-1。1H NMR(DMSO-d6,δ):7.192~7.235(m,1H)、6.970~7.052(m,4H)、6.858 ~6.895(t,1H)、6.270(s,1H)、4.518(s,1H)、3.730(s,3H)和 2.225(s,3H)。
1.2.4 2-氨基-7-甲基-4-(4-硝基苯基)-5-氧代-4H,5H吡喃[4,3-b]吡喃-3-腈的合成
在干燥的250 mL三颈烧瓶中,放入1.1 g 4-羟基-6-甲基 -2-吡喃酮、0.7 g 丙二腈、0.12 g DMAP、3.0 g 4-硝基苯甲醛和50 mL无水乙醇,摇动混合,并加入磁子,装上回流冷凝管,盖上塞子,在90℃恒温反应条件下油浴加热搅拌1.0~1.5 h,TLC监测,待反应结束后,静置冷却,产物没有析出,放入冰箱3 h,之后产物析出,抽滤,用无水乙醇洗涤固体,抽干水分,得到粗产物(白色粉末),再用无水乙醇重结晶,在室温下冷却后再抽滤,把产品放在表面皿上置于烘箱干燥,称重,得到1.6 g白色粉末,取极少量产品溶于二氯甲烷中,用毛细管蘸取少量进行薄层色谱分析,展开剂V(二氯甲烷)∶V(石油醚)∶V(乙酸)=1∶2∶3,TLC显示一个点(比移值Rf=0.418 8)。熔点:235~236℃,产率:56.39%。IR(KBr压片):3 434.88、3 342.42、2 232.79、1 705.97、1 145.58、1 674.02、1 383.03、1 263.61、1 194.67、1 170.75、1 094.99、1 040.50 和 814.51 cm-1。1H NMR(DMSO-d6,δ):8.114~8.137(m,1H)、8.048~8.057(t,1H)、7.724~7.743(d,1H)、7.619~7.659(t,1H)、7.739(s,2H)、6.325(s,1H)、4.567(s,1H)和 2.236(s,3H)。
1.2.5 2-氨基-4-(2-氰基苯基)-7-甲基-5-氧代-4H,5H吡喃[4,3-b]吡喃-3-腈的合成
在干燥的250 mL三颈烧瓶中,放入1.1 g 4-羟基-6-甲基 -2-吡喃酮、0.7 g 丙二腈、0.12 g DMAP、2.7 g 2-氰基苯甲醛和50 mL无水乙醇,摇动混合,并加入磁子,装上回流冷凝管,盖上塞子,在90℃恒温反应条件下油浴加热搅拌1.0~1.5 h,TLC监测,待反应结束后,静置冷却,产物析出,抽滤,用无水乙醇洗涤固体,抽干水分,得到粗产物(淡紫色粉末),再用无水乙醇重结晶,在室温下冷却后再抽滤,把产品放在表面皿上置于烘箱干燥,称重,得到1.3 g淡紫色粉末,取极少量产品溶于二氯甲烷中,用毛细管蘸取少量进行薄层色谱分析,展开剂V(二氯甲烷)∶V(石油醚)∶V(乙酸)=1∶2∶3,TLC显示一个点(比移值Rf=0.794 1)。熔点:273~274℃,产率:48.82%。IR(KBr压片):3 319.01、2 190.23、1 145.58、1 674.02、1 263.24、1 199.91、1 151.00、1 037.72 和 766.99 cm-1。1H NMR(DMSO-d6,δ):7.784~7.805(d,2H)、7.414~7.434(d,2H)、7.341(s,2H)、6.308(s,1H)、4.435(s,1H)和 2.234(s,3H)。
1.2.6 2-氨基-4-(2-氯-5硝基苯基)-7-甲基-5-氧代-4H,5H 吡喃[4,3-b]吡喃 -3-腈的合成
在干燥的250 mL三颈烧瓶中,放入1.1 g 4-羟基-6-甲基 -2-吡喃酮、0.7 g 丙二腈、0.12 g DMAP、3.0 g 2-氯-5-硝基苯甲醛和50 mL无水乙醇,摇动混合,并加入磁子,装上回流冷凝管,盖上塞子,在90℃恒温反应条件下油浴加热搅拌1.0~1.5 h,TLC监测,待反应结束后,静置冷却,产物没有析出,放入旋转蒸发器中,将溶剂蒸发到原来的1/3左右为止,产物逐渐析出,抽滤,用无水乙醇洗涤固体,抽干水分,得到粗产物(纯白色粉末),再用无水乙醇重结晶,在室温下冷却后再抽滤,把产品放在表面皿上置于烘箱干燥,称重,得到1.1 g纯白色粉末,取极少量产品溶于二氯甲烷中,用毛细管蘸取少量进行薄层色谱分析,展开剂V(二氯甲烷)∶V(石油醚)∶V(乙酸)=1∶2∶3,TLC显示一个点(比移值Rf=0.762 5)。熔点:249~250℃,产率:35.28%。1H NMR(DMSO-d6,δ):8.103~8.131(t,2H),7.738~7.760(d,1H),7.422(s,2H),6.343(s,1H),4.994(s,1H),2.248(s,3H)。
1.2.7 2-氨基-4-(4羟基-3-硝基苯基)-7-甲基-5-氧代-4H,5H吡喃[4,3-b]吡喃-3-腈的合成
在干燥的250 mL三颈烧瓶中,放入1.1 g 4-羟基-6-甲基 -2-吡喃酮、0.7 g 丙二腈、0.12 g DMAP、3.3 g 4-羟基-3-硝基苯甲醛和50 mL无水乙醇,摇动混合,并加入磁子,装上回流冷凝管,盖上塞子,在90℃恒温反应条件下油浴加热搅拌1.0~1.5 h,TLC监测,待反应结束后,静置冷却,产物没有析出,放入旋转蒸发器中,将溶剂蒸发到原来的1/3左右为止,产物逐渐析出,抽滤,用无水乙醇洗涤固体,抽干水分,得到粗产物(白色晶体与粉末),再用无水乙醇重结晶,在室温下冷却后再抽滤,把产品放在表面皿上置于烘箱干燥,称重,得到0.9 g白色晶体与粉末,取极少量产品溶于二氯甲烷中,用毛细管蘸取少量进行薄层色谱分析,展开剂 V(二氯甲烷)∶V(石油醚)∶V(乙酸)=1∶2∶3,TLC显示一个点(比移值Rf=0.536 8)。熔点:235~236℃,产率:31.63%。1H NMR(DMSO-d6,δ):10.961(s,1H),7.701~7.707(d,1H),7.401~7.428(q,1H),7.298(s,2H),7.081~7.102(d,1H),6.287(s,1H),4.363(s,1H),2.226(s,3H)。
1.2.8 2-氨基-4-(3,5-二溴-4羟基苯基)-7-甲基-5-氧代-4H,5H吡喃[4,3-b]吡喃-3-腈的合成
在干燥的250 mL三颈烧瓶中,放入1.1 g 4-羟基-6-甲基 -2-吡喃酮、0.7 g 丙二腈、0.12 g DMAP、2.7 g 2-氰基苯甲醛和50 mL无水乙醇,摇动混合,并加入磁子,装上回流冷凝管,盖上塞子,在90℃恒温反应条件下油浴加热搅拌1.0~1.5 h,TLC监测,待反应结束后,静置冷却,产物析出,抽滤,用无水乙醇洗涤固体,抽干水分,得到粗产物(白色粉末),再用无水乙醇重结晶,在室温下冷却后再抽滤,把产品放在表面皿上置于烘箱干燥,称重,得到1.3 g白色粉末,取极少量产品溶于二氯甲烷中,用毛细管蘸取少量进行薄层色谱分析,展开剂V(二氯甲烷)∶V(石油醚)∶V(乙酸)=1∶2∶3,TLC显示一个点(比移值Rf=0.216 5)。熔点:261~262℃,产率:32.66%。1H NMR(DMSO-d6,δ):9.925(s,1H),7.292~7.348(d,4H),6.273(s,1H),4.289(s,1H),2.230(s,3H)。
1.3 薄层色谱分析
薄层色谱法是一种吸附薄层色谱分离法,它利用各成分对同一吸附剂吸附能力不同,使在流动相(溶剂)流过固定相(吸附剂)的过程中,连续地产生吸附、解吸附、再吸附、再解吸附,从而达到各成分的互相分离的目的。依据GB/T 19267.9—2008《刑事技术微量物证的理化检验第9部分:薄层色谱法》。
2 结果与讨论
以1.2.1中合成的产物(2-氨基-7-甲基-5-氧代-4-苯基-4H,5H吡喃[4,3-b]吡喃-3-腈)为例。(1)我们通过对比实验发现,在无水处理条件下的反应产率较高,因此之后的反应我们都采取了无水操作。(2)DMAP的用量我们做了筛选,分别用了12.3、61.1、123、620 和 1 230 mg。发现 123 mg催化剂足以达到催化效果并且效果最好。(3)反应物的投料比,我们以4-羟基-6-甲基-2-吡喃酮∶苯甲醛(摩尔比)分别为 1∶1.0、1∶1.5、1∶2.0和 1∶5.0做了对比实验,发现1∶2.0产物产率最高。因此确定最优条件为反应需要作无水前处理,原料投料比为1∶2.0,催化剂加123 mg。
本文共合成了8种新型吡喃类化合物,均使用“一锅法”合成,加热回流1.0~1.5 h不等,期间不断更换原料中的芳香醛种类,从而制得系列不同的化合物。
8种产物产率都较低,分析原因为实验后处理步骤较多,多次溶解抽滤,转移容器以及取样等操作都会损失产物,且实验本身投药量不大,在本身质量较小的情况下,以上步骤损失的产物产量占比便被放大了。同时产物损失也与后处理操作步骤和产物的溶解性有关,比如产物2和产物6,都是因为溶解性较好导致难以析出,后处理步骤繁琐,损失了很多的产物,导致产率很低。红外光谱、核磁共振氢谱从结构上证明得到的是目标产物。
3 结论
本文采用“一锅法”合成出8种新型的吡喃类化合物,并用红外吸收(IR)光谱与核磁共振氢谱(1H NMR)表征了产物的结构。

