黄芪与淫羊藿多糖硫酸酯混合物对小鼠免疫指标和血液抗氧化性的影响
张运强,周昭彬,张云露,刘自逵*
(1. 湖南农业大学 动物医学院,湖南 长沙 410000;2. 湖南加农正和生物技术有限公司,湖南 长沙 410000)
随着养殖行业的规模化和集约化发展,“防大于治”的管理理念被广大业内人士所认可,在动物疾病预防中,提升免疫功能和抗氧化应激又是动物抗病的基础和关键[1]。中药是中国的国粹,在养殖应用上具有悠久的历史,黄芪和淫羊藿等中药被证实对动物和人的免疫系统具有一定的调节作用,如史同瑞发现使用黄芪饲喂仔猪可以显著提升血液中IgG 和IgA 的含量[2],而胡月琴发现,淫羊藿总黄酮对环磷酰胺致免疫低下的小鼠中枢免疫系统具有调节作用[3]。但由于国内中药资源有限,使用中药原料饲喂动物普遍存在着用量大、见效慢、作用时间长的劣势,中药添加剂能否充分发挥效益成为其实际生产使用的限制因素。
因此,本实验将淫羊藿多糖进行硫酸化后又与黄芪复方混合,旨在探究该复方对动物的免疫调节和抗氧化作用。
1 材料与方法
1.1 主要实验材料及实验动物黄芪和箭叶淫羊藿由湖南加农正和生物技术有限公司提供;酯化修饰剂(氯磺酸与吡啶体积比为1∶8)由湖南农业大学动物医学院提供。各免疫因子的双抗体夹心ELISA试剂盒购自江苏酶免实业有限公司;各抗氧化指标的比色法测定试剂盒购自南京建成生物工程研究所。周龄为7 周龄、体质量为26 g±2 g 的200 只未经产的健康成熟雌性昆明小鼠,购自湖南斯莱克景达实验动物有限公司。
1.2 中药混合物的制备淫羊藿多糖硫酸酯(sEPS)由本实验室参照文献[4]制备。将黄芪原料进行粉碎并过40 目筛子(孔径:0.425 mm),与sEPS 按质量9∶1 混合,得试验所用黄芪与sEPS 混合物(以下简称:混合物),将混合物真空包装后室温保存备用。
1.3 动物分组及处理采用单因子随机区组试验方法,将200 只实验小鼠,预饲养7 d 后随机分为4组,每组50 只,分别为对照组C、处理组T1、T2 和T3,每组5 个重复,每个重复10 只;其中对照组饲喂不含任何饲料添加剂的日粮,T1、T2、T3 分别在基础日粮上按日粮重量比例添加混合物0.100%、0.175%和0.250%。试验期为28 d,分别在试验开始第0、7 d、14 d、21 d、28 d 于各组每个重复随机选取2 只实验小鼠禁食12 h 后称重、采血分离血清,-80 ℃保存待测。迫杀后无菌采取心脏、肝脏、脾脏、肺脏、肾脏和胸腺等脏器,用生理盐水冲洗表面后擦干并称重。分离十二指肠约2 cm,甲醛固定后室温保存待测。
1.4 生长指标和器官指数对各组小鼠投喂混合物后0、7 d、14 d、21 d 和28 d 的体质量和总采食量进行称重,分析小鼠在各个阶段不同处理对其初重、末重、平均日增重、平均日采食量、料重比变化情况;同时,检测上述各时间点采集的肝脏、心脏、脾脏、肺脏、肾脏和胸腺等器官质量,计算器官质量与小鼠体质量的比值,分析器官指数变化情况。
1.5 免疫指标测定利用双抗体夹心ELISA 试剂盒检测各时间点收集血清中溶菌酶、β 防御素2(HBD-2)、十二指肠SIgA、白细胞介素(分别为IL-1β、 IL-4、 IL-6 和IL-8)、 肿 瘤 坏 死 因 子α(TNF-α)以及γ干扰素(IFN-γ),利用标准品测量建立标准曲线,利用四参数Logistic 曲线拟合,公式为:

1.6 抗氧化指标的监测利用抗氧化指标比色法测定试剂盒检测总抗氧化能力水平(T-AOC)、总过氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-PX)和过氧化氢酶(CAT)。利用绘制的标准曲线计算各指标水平。
1.7 统计分析用Excel 2016 软件对测试数据进行初步处理,采用SPSS 22.0 软件ANOVA 方法进行方差分析,结果表示为“平均值±标准差”,采用Duncan 法进行多重比较,p<0.05 为差异显著。
2 结 果
2.1 小鼠生长指标与器官指数对投喂混合物后各个阶段不同处理组小鼠初重、末重、平均日增重、平均日采食量、料重比进行监测分析,结果显示所述各指标数值均无显著变化(p>0.05)。器官指数检测结果显示,各组小鼠肝脏指数、心脏指数、脾脏指数、肾脏指数、肺脏指数和胸腺指数也均无显著变化(p>0.05)。
2.2 各阶段小鼠血清中各免疫指标的变化对各组小鼠在各时间点血清中的溶菌酶、HBD-2 和十二指肠SIgA进行检测,结果显示,(1)溶菌酶:第14 d,T2组显著高于T3组,且T3组显著高于C组;第21 d,T2和T3组显著高于T1和C组(p<0.05);(2)HBD-2:第7 d,T2 组和C 组显著高于T1 组;第21 d,T1、T2 和T3 组均显著高于C 组(p<0.05);(3)十二指肠SIgA:第14 d,T1 和T3 组显著高于T2 和C 组,第21 d,T1、T2 和T3 组均显著高于C 组(p<0.05)(图1)。由于溶菌酶、HBD-2和十二指肠SIgA均为重要的非特异性免疫指标,且根据结果分析,C 组的指标变化不明显,而大部分时间点这3 项指标的处理组较C 组有显著变化,且在21 d变化最明显,表明混合物能够影响小鼠的溶菌酶、HBD-2和十二指肠SIgA的水平变化。利用ELISA 方法检测实验组各阶段的细胞因子表达变化情况,结果显示,(1)IL-1β:第14 d 和21 d,C 组显著高于各处理组;第28 d,C 组显著高于T1 组(p<0.05);(2)IL-4:第7 d 和14 d,T2 和T3组显著高于T1和C组;第21 d,C组、T2组和T3组显著高于T1 组(p<0.05);(3)IL-6:第7 d,C 组显著高于T1组,且T1组显著高于T2和T3组;第14 d,C组显著高于各处理组;第21 d,C 组显著高于T1 和T2 组,且T1和T2组显著高于T3组;第28 d,C组显著高于各处理组,且T1 组显著高于T2 组(p<0.05);(4)IL-8:第7 d,T2 组显著高于T1、T3 和C 组;第14 d,C 和T1 组显著高于T2 和T3 组;第21 d,C、T1 和T2 显著高于T3组(p<0.05);(5)TNF-α:第14 d,C组显著高于T1和T2组;第21 d,C组显著高于各处理组,且T1组显著高于T2和T3组;第28 d,C组和T1组显著高于T2和T3组(p<0.05);(6)IFN-γ:第7 d,T3组显著高于T1、T2和C组;第21 d,C组显著高于T2和T3组;第28 d,C组、T1和T2组显著高于T3组(p<0.05)(图2)。
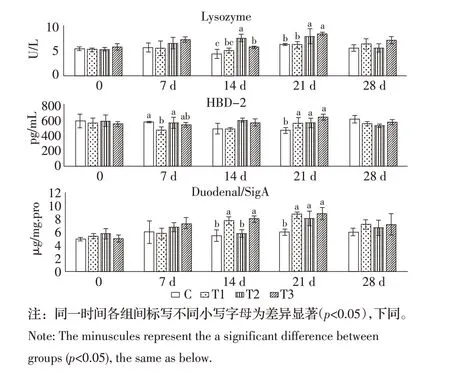
图1 小鼠饲喂中药混合物后血清中溶菌酶、HBD-2 和十二指肠SIgA 的变化Fig.1 Changes of lysozyme,HBD-2 and SIgA in serum of mice fed with traditional Chinese medicine mixture

图2 小鼠血清中IL-1β、IL-4、IL-6、IL-8、TNF-α和IFN-γ的变化Fig.2 The changes of IL-1 β,IL-4,IL-6,IL-8,TNF-α and IFN-γ in the serum of mice
对小鼠血清中IFN-γ和十二指肠SIgA 相关性分析,结果显示,C 组呈不显著正相关(p>0.05);T1组呈不显著负相关(p>0.05),T2 和T3 组呈显著负相关(p<0.05),且T3 组(p=0.011)的显著性大于T2组(p=0.036)(表1)。血清中IFN-γ和十二指肠SIgA的变化折线图显示,C 组变化趋于平稳,而T1、T2和T3 组的指标变化呈“此消彼长”的态势(图3),证明混合物添加日粮能够增加小鼠血清中IFN-γ和十二指肠SIgA 的双向调节作用,且呈剂量依赖性。

表1 小鼠饲喂中药混合物后IFN-γ和十二指肠SIgA相关性分析Table 1 Correlation analysis of IFN-γ and duodenal sIgA in mice fed with traditional Chinese medicine mixture

图3 饲喂中药混合物后小鼠血清中IFN-γ和十二指肠SIgA 的关系变化Fig.3 Relationship between IFN-γ and duodenal SIgA in serum of mice fed with traditional Chinese medicine mixture
2.3 血清中抗氧化水平的变化利用比色法检测饲喂混合物日粮后小鼠血清中的抗氧化指标变化,结果显示:(1)T-AOC:第7 d,各处理组均显著高于C 组;第14 d,T1 和T3 组显著高于C 组;第21 d,T2 和T3 组显著高于T1 和C 组(p<0.05);(2)GSHPX:第21 d,T1 和T2 组显著高于T3 组(p<0.05);(3)CAT:第7 d,T3 组显著高于C、T1 和T2 组;第14 d,T3 组显著高于C、T1 和T2 组,且C 和T1 组显著高于T2 组(p<0.05)(图4)。综上结果分析,对于小鼠血清中的总抗氧化水平,除第28 d 因C 组离散度过高导致显著性不明显,其余各个时间点各处理组均较C 组有显著或不显著提高,小鼠血清中的T-AOC 代表着其总抗氧化水平,因此结果表明混合物饲喂小鼠能够改善其抗氧化水平。
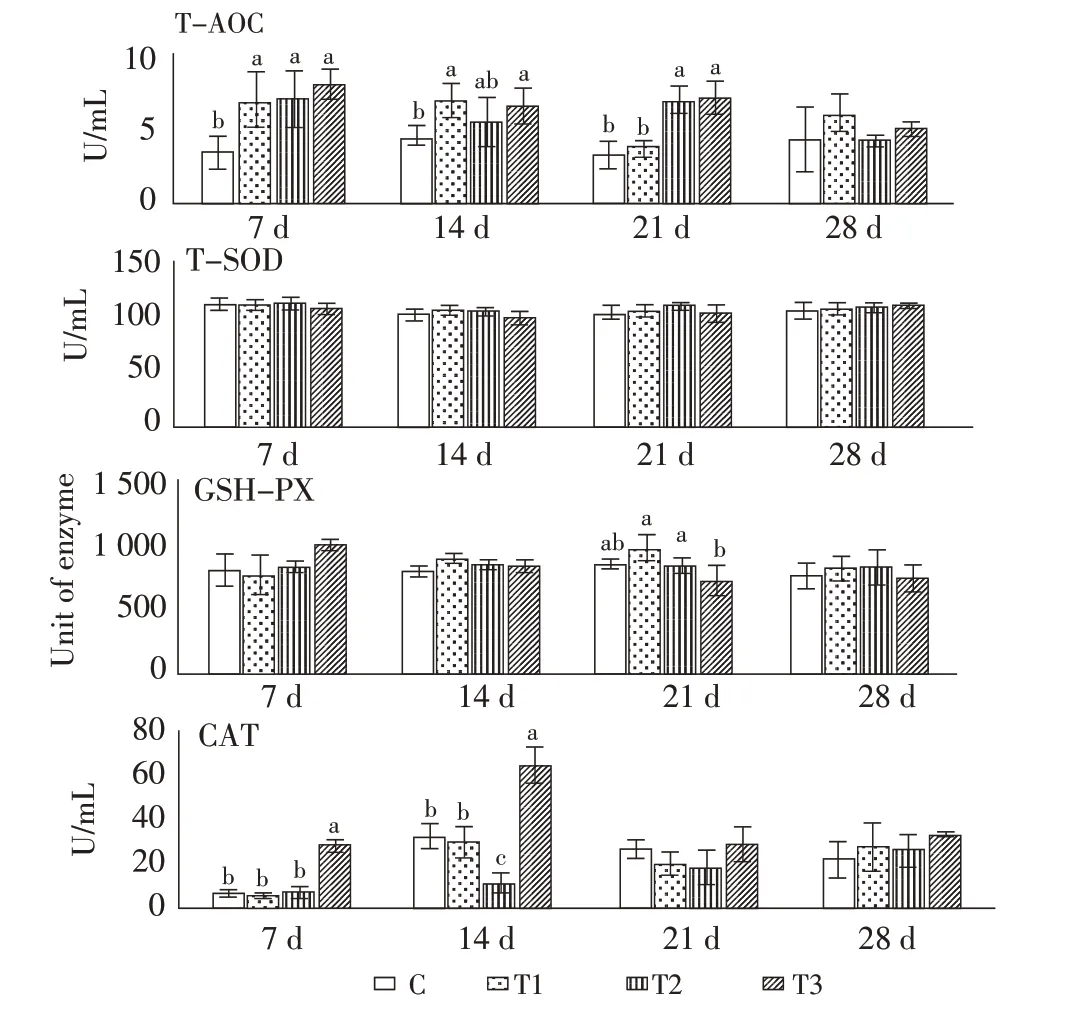
图4 饲喂中药混合物后小鼠血清中T-AOC、T-SOD、GSH-PX 和CAT 的变化Fig.4 The changes of T-AOC,T-SOD,GSH-PX and CAT in the serum of mice fed with traditional Chinese medicine mixture
3 讨 论
溶菌酶是一种广泛存在于生物体内的抗菌蛋白。它通常以分解细菌的细胞壁肽聚糖(Peptidoglycan,PG)来获得对细菌的抵抗。溶菌酶作为一种先天性免疫因子,在动物机体的免疫功能中起着至关重要的作用[5]。根据图1 结果可知,T2 和T3 组小鼠血清的溶菌酶含量在第14 d 和第21 d 显著高于对照组(p<0.05)。证明混合物饲喂小鼠可在一定剂量和时间诱导小鼠溶菌酶表达。其可能的原因是混合物的主要成分黄芪中含有黄芪多糖,汤菊芬等人用黄芪多糖注射液注射罗非鱼,发现黄芪多糖能诱导罗非鱼肝、脾等组织溶菌酶的表达,增强罗非鱼的机体免疫力[6],溶菌酶具有分解仅由细菌产生的PG 的能力,因此PG 成为了溶菌酶很好的靶向目标[7]。当细菌侵入机体时,溶菌酶可诱导产生IL-8 等促炎因子来调节机体免疫功能,进而实现杀灭细菌的功能[8]。Wolf 在研究中发现,机体会通过细菌源性脂蛋白和DNA 受体增加炎症因子IL-6 和TNF-α的释放[9]。但与上述结果相反,在本实验中,T2 组和T3组小鼠的溶菌酶在14 d 和21 d 显著高于对照组,但T2 组和T3 组小鼠的IL-6、IL-8 和TNF-α显著低于对照组(p<0.05)或无显著性差异(p>0.05)。其可能原因为,由于小鼠试验不是病原接种试验,而是让小鼠在室内自然环境中进行的试验,因此该结果提示:在自然环境中黄芪和sEPS 混合物饲喂健康小鼠对其具有免疫调节作用,并能够诱导溶菌酶的表达,但不增加IL-6、IL-8 以及TNF-α等促炎因子的释放。
防御素是富含二硫键的阳离子多肽,广泛分布于真菌、植物和动物体内,是生物免疫系统中的重要调节因子[10]。HBD-2 广泛分布于具有直接杀菌作用的动物皮肤、黏膜及其他上皮组织中,是一类重要的抗菌肽[11]。虽然HBD-2 是一种重要的非特异性免疫因子,但据报道称,HBD-2 具有诱导表达的特性,其含量主要受局部炎症和微生物刺激的调节,如革兰氏阴性菌、革兰氏阳性菌、真菌、体内共生菌、TNF-α和IL-1β等均可上调HBD-2 的表达,继而导致炎症区HBD-2 含量增加[12]。因此,推测HBD-2与TNF-α、IL-1β等促炎因子的相互作用可能与含量变化效应呈正相关。根据本实验结果,T1、T2 组小鼠血清HBD-2 含量在7 d 显著低于对照组,21 d各治疗组均显著高于对照组(p<0.05),但TNF-α和IL-1β的检测结果与上述研究结果不同,第7 d 和21 d时,两种细胞因子水平并不高于对照组,部分细胞因子水平甚至呈现出显著低于对照组的状况(p<0.05)。可见混合物可在一定时间和一定程度上增加小鼠血清中HBD-2 的含量,但血清中HBD-2 和TNF-α、IL-1β的表达特点与局部组织不同。
动物机体的抗氧化能力与抵御疾病、维持健康存在着密切的联系,动物血清含多种有益于机体健康的抗氧化因子,包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、GSH-PX、维生素C、维生素E 以及β-胡萝卜素等。它们具有分解自由基、除去起催化作用的金属离子等作用,当机体的抗氧化能力降低时,动物机体容易引起免疫力低下、炎症等问题,此时机体更容易受到外界病原入侵,动物的病死几率也随之升高[13]。如图4 结果显示,饲喂高剂量复合物添加日粮的T3 小鼠血清中总抗氧化水平在7 d、14 d 和21 d 均显著高于对照组C 升(p<0.05),T1、T2 组在某些时间段也较对照组有显著提升,这个结果证明,黄芪与sEPS 可在一定程度上提升小鼠血清的抗氧化性。其原因可能是复合物中含有黄酮类物质(如黄芪黄酮)和淫羊藿多糖,黄文静通过研究发现,黄芪茎叶提取的总黄酮对DPPH 自由基、羟基自由基和超氧阴离子自由基均有较高的清除能力,从而实现抗氧化的功能[14]。但在本实验中饲喂中药混合物的小鼠血清中仅CAT 水平在T3 组7 d 和14 d 较对照组有显著提升(p<0.05),而处理组的T-SOD 水平和GSH-PX 活性虽然在大部分时间节点上高于对照组,但差异不显著(p>0.05),其原因可能为,动物机体的抗氧化酶仅起到一定的抗氧化效果,而总体抗氧化水平是各抗氧化因子与清除氧自由基共同作用的结果[15],因此推测,混合物虽然对一些酶的水平和活性提升不显著,但可以显著提升综合抗氧化水平。
免疫调节功能对于动物的抗病能力具有重要意义,但很少有关于健康动物免疫调节能力的评价与报道,本实验以小鼠IFN-γ和十二指肠SIgA 的变化指标进行分析,探究了这两种免疫指标的变化关系和调节特点。IFN-γ是Ⅱ型干扰素,主要由活化的NK 细胞和T 细胞产生,最近的研究表明,调节性T细胞(Treg)在接触抗原的早期快速而短暂地分泌IFN-γ,这些早期产生的IFN-γ可以通过抑制初始T细胞的凋亡来阻止过度免疫反应的启动[16]。在本实验中IFN-γ和十二指肠SIgA 的水平呈“此消彼长”的趋势。由于本研究中的小鼠暴露于抗原中,并没有在无菌环境中进行试验,可以推断,随着SIgA 含量的增加,对黏膜的保护作用增强,小鼠体内抗原含量降低,IFN-γ的分泌将启动相应的机制,导致IFN-γ含量下降到一定水平。本研究中随着混合物的剂量提升,两种免疫指标的负相关性也逐步提升,证明了黄芪与sEPS 混合物饲喂小鼠能够增强IFN-γ和十二指肠SIgA 的双向调节能力,且剂量越高其调节能力越强。本实验结果佐证了中药对动物免疫的双向调节作用[17],为健康动物的免疫调节评价提供了依据。

