植物内生真菌生物活性成分研究进展
黄 燕,曾东强,唐文伟*,杜良伟
1广西大学农学院广西农业环境与农产品安全重点实验室;2广西大学化学化工学院,南宁 530004
植物内生真菌是指寄居在健康植物的组织内,同时对宿主植物无明显感染迹象的一类真菌[1]。1993年,Stierle等[2]从短叶红豆杉(Taxusbrevifolia)韧皮部中分离得到一株活性菌株Taxomycesandreanae,然后从中分离得到一种重要的抗癌药物紫杉醇(taxol)。自此,从内生真菌中寻找和发现新的生物活性物质的研究得到了越来越多的科研工作者的青睐。植物内生真菌的次生代谢产物结构类型丰富,有生物碱、聚酮、萜类、甾醇、蒽醌、黄酮、黄嘌呤、酚类、苝烯衍生物、呋喃二酮及环肽等多种结构类型,同时这些代谢产物的生物功能活性也多样,有抗菌、抗病毒、抗癌、抗氧化、杀虫、抗糖尿病和免疫抑制等[3-7]。此外,多数植物的内生真菌能够产生与宿主植物相同或相似的生物活性代谢物[8],有些内生真菌还能够促使宿主植物特别是药用植物的有效活性成分的合成[9]。因此,植物内生真菌活性代谢物质是抗生素、抗癌药物或农药的潜在先导,具有重大的研究意义和经济价值。
近年来,有关内生真菌次级代谢物的综述报道多集中在总结药用植物内生真菌的活性物质[10]、抗肿瘤代谢物[11]或者某一属种的植物(多为红树林植物)内生真菌活性成分[12-14],而综述植物内生真菌生物活性成分的文献较少。因此,本文以化合物的结构类型为主线,对近三年来(2017~2019年)报道的从植物内生真菌中分离得到的具有生物活性的主要次级代谢产物做一评述。
1 植物内生真菌次级代谢物的结构类型及生物活性
近三年来,从植物内生真菌中分离得到的次级代谢产物主要包括生物碱、聚酮、萜类、甾体、蒽醌、(异)香豆素、吡喃酮、缩酚酸环醚和内酯等,其活性主要包括细胞毒活性、抗病毒、抗炎、抗氧化、抗病原菌和植物毒性等。
1.1 生物碱
生物碱是植物内生真菌次级代谢物中重要的一类化合物。大多数生物碱物质具有复杂的环状结构,环内多包含氮元素,有显著的生物活性。近三年,已从植物内生真菌代谢产物中分离鉴定出的有活性的生物碱类化合物见图1,其生物活性主要包括抗肿瘤、生物酶抑制、抗炎、杀线虫和抗菌活性等。
植物内生真菌中不少生物碱类化合物具有抗肿瘤细胞活性。半红树林植物苦槛蓝(Myoporumbontioides(Sieb.et Zucc.) A.Gray)叶脉内生真菌PenicilliumchrysogenumV11中的penochalasin K(1)具有广谱的细胞活性,对3种人的肿瘤细胞株(MDA-MB-435,SGC-7901和A549)均有较强的细胞活性,其IC50值分别达到4.65±0.45、5.32±0.58和8.73±0.62 μM[15];半夏(Pinelliaternata(Thunb.) Breit.)根茎内生真菌PenicilliumbrefeldianumXMK-2中的生物碱成分同样具有细胞活性,其中6,7-dehydropaxilline(2)、F(3)和N-demethylmelearoride A(4)对HepG2和MDA-MB-231细胞均有不同程度的抑制作用[16];霍山石斛(DendrobiumhuoshanenseC.Z.Tang et S.J.Cheng)根茎内生真菌Stagonosporopsisoculihominis发酵液乙酸乙酯萃取物中的stagonoculiepine(5)和stagonoculiazin(6)在浓度为40 μmol时,均对肝癌细胞株SMMC-7721表现出较强的抑制作用,而对肺癌细胞株A549的抑制作用相对较弱[17];一种不明植物的叶表面分离出来的内生真菌Aspergillustennesseensis的固体发酵产物乙酸乙酯萃取物中的versicoamide F(7)和G(8)能微弱地抑制肿瘤细胞株H460的增殖,IC50值分别为83.4和95.5 μM[18];地衣(Cladoniasp.)内生真菌Apiosporamontagnei的大米固体发酵产物中的N-hydroxyapiosporamide(9)和apiosporamide(10)对小鼠淋巴瘤细胞L5178Y表现出较强的抑制作用,其IC50值分别为0.2和2.1 μM,效果显著优于阳性对照kahalalide F(IC50=4.3 μM)[19];而从埃及水葫芦(Eichhorniacrassipes(Mart.) Solms)新鲜叶片中的内生真菌AspergillusversicolorKU258497的大米固体发酵产物中分离得到的aflaquinolone H(11)对L5178Y细胞增殖只有中等程度的抑制作用[20];小麦(TriticumaestivumL.)内生真菌Microdochiummajus99049的发酵液乙酸乙酯萃取物中的brocaeloid A(12)、B(13)和D(14)则对人肝癌细胞HUH-7表现出抑制活性,IC50值均为80 μg/mL[21]。
一些内生真菌中的生物碱类化合物具有酶抑制活性。红树植物角果木(Ceriopstagal(perr.) C.B.Rob.)根部内生真菌CladosporiumcladosporioidesJG-12发酵产物乙酸乙酯提取物中的ilicicolin H(15),(7R)-methoxypurpuride(16)和purpuride(17),在浓度为1 g/L时均可以显著抑制乙酰胆碱酯酶活性,抑制率分别为37.20%,26.94%和26.35%[22];而另一种红树林植物海漆(ExcoecariaagallochaLinn.)新鲜枝条中的内生真菌Diaporthesp.SYSU-HQ3的发酵液的二氯甲烷萃取物中的diaporisoindole A(18)则对结核分枝杆菌(Mycobacteriumtuberculosis)蛋白酪氨酸磷酸酶B具有较强的抑制活性,IC50值为4.2 μM,效果比阳性对照齐墩果酸(IC50= 22.1 μM)更为显著[23];同样地,来自自海洋红树林植物秋茄(Kandeliaobovata)叶片中的内生真菌Talaromycessp.(HZ-YX1)的大米固体发酵物乙酸乙酯提取物的talaramide A(19),对分枝杆菌蛋白激酶(PknG)有很好的抑制作用,其IC50值为55 μM,其效果优于阳性对照AX20017(IC50=98 μM)[24];从红海褐藻(Padinapavonica)内生真菌Fusariumequiseti的发酵液的乙酸乙酯萃取部分中分离得到的cyclo(L-Tyr-L-Pro)(20)、cordycepin(21)和adenosine(22)均具有抗丙型肝炎病毒(HCV)蛋白酶的活性,其中化合物20对HCV NS3-NS4A蛋白酶的抑制作用最强,而21和22的抑制活性一般,IC50值分别为8.20±1.7、25.4±2.3和21.3±4.12 μg/mL[25]。
生物碱类化合物除了具有细胞毒活性、酶抑制活性外,还具有抗炎、杀线虫活性。从三七(Panaxnotoginseng(Burk.) F.H.Chen)根部内生真菌FusariumtricinctumSYPF 7082的菌丝乙酸乙酯提取物中分离得到的[-(α-oxyisohexanoyl-N-methyl-leucyl)2-](23),在浓度为25 μM时,显著地抑制了小鼠巨噬细胞株RAW264.7中一氧化氮的生成,表现出很强的抗炎活性,其IC50值为18.10±0.16 μM[26];而(7R)-methoxypurpuride(16)和purpuride(17)还具有全齿复活线虫抑制活性,在浓度为2.5 g/L时,抑制率分别达78.2%和80.7%,效果强于阳性对照阿苯达唑(抑制率37.2%)[22]。
部分植物内生真菌中的生物碱类化合物具有抑菌活性,包括对一些植物病原菌也具有抑菌活性。Penochalasin K(1)对植物病原真菌Colletotrichumgloeosporioides和Rhizoctoniasolani的抑制作用较强,MIC值分别为6.13和12.26 μM,抑菌效果优于多菌灵(MIC值分别为65.38和32.69 μM)[15];从夹竹桃(NeriumindicumMill.)根内生真菌Penicilliumsp.R22的大米固体发酵物的乙酸乙酯萃取物中分离得到的3-O-methylviridicatinviridicatol(24),viridicatol(25)和5-hydroxy-8-methoxy-4-phenylisoquinolin-1(2H)-one(26),在抗真菌活性测试中,均对供试病原真菌表现出很强的抑制作用,其中24对Alternariabrassicae、Alternariaalternata及Valsamali,25对Alternariabrassicae、Botrytiscinerea及Valsamali,26对Alternariabrassicae、Alternariaalternata及Botrytiscinerea均表现出抑制作用,其MIC值均为31.2 μg/mL,而在抗细菌活性测试中,25对Staphylococcusaureus的抑制作用显著,MIC值为15.6 μg/mL,但24和26的抗细菌活性则较弱[27]。

图1 生物碱类化合物(1~26)的化学结构Fig.1 The chemical structures of alkaloids (1-26)
1.2 聚酮
聚酮类化合物是乙酰基与丙酰基的聚合而成的天然产物,2017~2019年报道的该类化合物主要生物活性有抑制α-葡萄糖苷酶活性、细胞毒作用和抑菌等。近三年,从植物内生真菌代谢产物中分离鉴定出的有活性的聚酮类化合物见图2。
对α-葡萄糖苷酶具有抑制活性的聚酮类化合物的报道有:红树植物木榄(Bruguieragymnorrhiza(L.) Poir.)的新鲜果实内生真菌AspergillusversicolorZJ-ML1的发酵产物乙酸乙酯提取物中的dehydropalitantin(27)和3-hydroxy-2-oxo-2H-chromene-6-carboxylic acid(28),在药理活性测试中,它们均表现出中等强度的α-葡萄糖苷酶抑制活性,其IC50值分别为410.8和465.3 μM,优于阳性对照阿卡波糖的活性(IC50=840.2 μM)[28]。
聚酮衍生物中具有细胞毒活性的化合物的主要报道有:红树植物银叶树(HertieralittoralisDryand.)的根部内生真菌Penicilliumchermesinum中的2-chloro-3,4,7-trihydroxy-9-methoxy-1-methyl-6H-benzo[c]chromen-6-one(29),对4种癌细胞株(HuCCA-1、HepG2、A549和MOLT-3)均表现出微弱的细胞毒活性,其IC50值范围为14.94~115.71 μM[29];南欧球花(Globulariaalypum)中的内生真菌PreussiasimilisDSM 104666的发酵液中的双环聚酮化合物preussilides A-F(30~35),对不同哺乳动物细胞株表现出不同程度的细胞毒性,引起L929细胞的核酸断裂,IC50值范围为2.5~80.0 μM,同时30和32对小鼠成纤维细胞(L929)和癌细胞株(HeLa KB.3.1、U2OS以及仅限于32的MCF-7)的IC50值均低于10 μM,说明这两个化合物具有典型的构效关系[30];从埃及水葫芦内生真菌Aspergillusversicolor的发酵产物中分离得到的sterigmatocystin(36)和alternariol(37),与标准抗增殖剂kahalalide F(IC50=4.3 μM)相比,均对小鼠淋巴瘤细胞L5178Y显示出中等的细胞毒性,IC50值分别为2.2和16.3 μM[20];dothiorelone M(38)、K(39)和cytosporone B(40)从广藿香(Pogostemoncablin(Blanco) Benth.)的内生真菌PhomopsisphyllanthicolaA658中分离得到,在体外细胞毒测试中均对4种肿瘤细胞株(SF-268、MCF-7、HepG-2和A549)表现出微弱的抑制作用[31]。
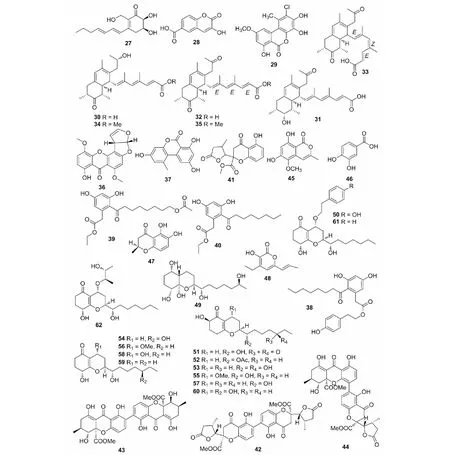
图2 聚酮类化合物(27~62)的化学结构Fig.2 The chemical structures of polyketides (27-62)
部分聚酮类化合物还具有抑菌活性,从而使内生菌也表现出抑菌的活性。Preussilides A(30)和C(32)来源于南欧球花内生真菌PreussiasimilisDSM 104666,抑菌活性测定表明对Mucorplumbeus仅表现出轻微的抗真菌活性,32对Aspergillusfumigatus表现出很强的抑制作用,MIC值为8.3 μg/mL,比阳性对照环己酰亚胺(MIC=33.3 μg/mL)强,而30的抑制效果(MIC=35.5 μg/mL)与环己酰亚胺相当[30];番荔枝科端心本属植物(Duguetiastelechantha)根内生真菌TalaromycesstipitatusDgCr2 2.1b的发酵液中的paecillin B(41)和D(42)、secalonic acid A(43)和versixanthone A(44),微泡稀释法测定表明对C.tropicalis显示出不同程度的抗真菌活性,与阳性对照氟康唑(MIC=5 μg/mL)相比,化合物42(MIC=15.6 μg/mL)、44(MIC=31.3 μg/mL)、41(MIC=62.6 μg/mL)和43(MIC=125 μg/mL)的抑制作用依次降低[32];红树林植物海莲(Bruguierasexangula)下胚轴中的内生真菌Phyllostictacapitalensis中的6,8-dihydroxy-5-methoxy-3-methyl-1H-isochromen-1-one(45)对P.aeruginosa和S.aureus均表现出微弱的抑制作用,而3,4-dihydroxybenzoic acid(46)的抑菌活性更具有广谱性,对5种供试病原菌(Pseudomonasaeruginosa、Enterococcusfaecalis、Staphylococcusaureus、Escherichiacoli和Candidaalbicans)均有抑制作用[33];而(2S)-2,3-dihydro-5,6-dihydroxy-2-methyl-4H-1-benzopyran-4-one(47)和4-ethyl-3-hydroxy-6-propenyl-2H-pyran-2-one(48)分离自另一种红树林植物角果木(Ceriopstagal)内生真菌Colletotrichumgloeosporioides的发酵液,在抗植物病原细菌的活性测试中,47仅对Bacilluscereus具有抑制活性,而48对Bacillussubtilis、Staphylococcusaureus和Streptomycesalbus均表现出抑制作用[34];艾蒿(ArtemisiaargyiH.Lév.& Vaniot)的根内生真菌TrichodermakoningiopsisQA-3的发酵产物中的14个高氧聚酮化合物15-hydroxy-1,4,5,6-tetra-epi-koninginin G(49)、4′-hydroxykoninginin U(50)、14-ketokoninginin B(51)、koningiopisin E(52)、14-hydroxykoninginin B(53)及E(54)、7-O-methylkoninginin B(55)及D(56)、koninginin B(57)、D(58)、E(59)、F(60)、U(61)及V(62),均对人类病原菌EscherichiacoliEMBLC-1和水生病原菌EdwardsiellamegiQDIO-10及VibrioalginolyticusQDIO-5有抑制作用,其中49对Vibrioalginolyticus的MIC值为1 μg/mL,活性与阳性对照氯霉素相当;此外,61和51还分别对V.harveyiQDIO-7和E.tardaQDIO-2表现出抑菌活性,而且化合物51、54和61均对植物病原真菌CeratobasidiumcornigerumQDAU-8有较强的抑制作用[35]。
1.3 萜类
萜类化合物广泛分布于植物体内和内生真菌次级代谢物中,是由异戊二烯或异戊烷基团形成的一类天然化合物。2017~2019年从植物内生真菌中分离得到的具有生物活性的萜类化合物见图3。
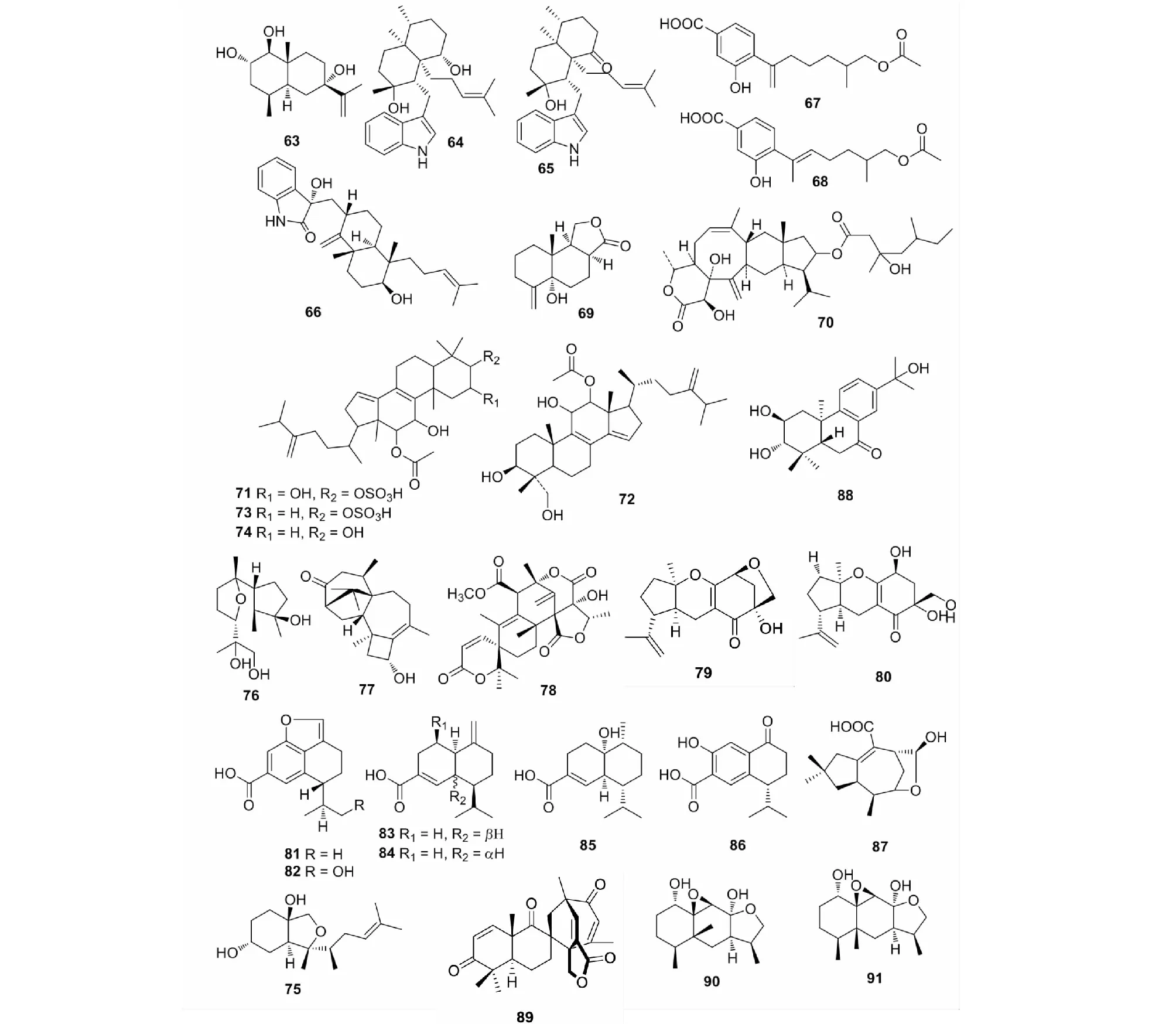
图3 萜类化合物(63~91)的化学结构Fig.3 The chemical structures of terpenes (63-91)
植物中的部分萜类化合物具有细胞毒作用及抗病毒活性,而内生真菌中同样拥有细胞毒作用及抗病毒活性的化合物。红树植物角果木(Ceriopstagal)鲜叶中的内生真菌Penicilliumsp.J-54中的eudesmane-型倍半萜类化合物penicieudesmol B(63),在体外细胞毒活性测试中对白血病细胞株K562表现出微弱的抑制作用,其IC50值为90.1 μM,效果远不及阳性对照紫杉醇(IC50=9.5 μM)[36];另一红树植物木果楝(XylocarpusgranatumKoenig)中的内生真菌Eupenicilliumsp.HJ002的发酵液中的吲哚二萜类化合物penicilindole A(64)和B(65),在细胞毒活性测试中均对A549、HeLa和HepG2表现出不同程度的细胞毒性,与阳性对照5-氟烷(IC50=36.8,76.9 μM)相比,其中64对A549和HepG2的抑制效果最好,其IC50值分别为5.5和1.5 μM[37];同样地,红树林植物白骨壤(Avicenniamarina(Forsk.) Vierh.Hailanci)果实中的内生真菌Aspergillusversicolor大米固体发酵产物中的氧吲哚二萜anthcolorin H(66)和甲氧萜7-deoxy-7,14-didehydro-12-acetoxy-sydonic acid(67)和(E)-7-deoxy-7,8-didehydro-12-acetoxy-sydonic acid(68),均对人恶性上皮细胞HeLa表现出微弱的细胞毒活性[38];由此可以看出,红树林植物内生真菌是抗肿瘤代谢成分的重要来源之一。从黄草乌(AconitumvilmorinianumKom.)根内生真菌Phomasp.YE3135发酵液乙酸乙酯萃取物中分离得到的14-正十二烷型倍半萜phomanolide(69),对甲型流感病毒(H1N1)表现出抗病毒活性,其效果(IC50=2.96±0.64 μg/mL)比阳性药剂阿比朵尔(IC50=0.15±0.04 μg/mL)稍弱[39]。
部分萜类化合物还对一些生物酶系具有活性。从黄瓜(CucumissativusLinn)的根内生真菌PaecilomycesformosusLHL10中分离得到的倍萜化合物YW3548(70),对α-葡萄糖苷酶和脲酶均表现出显著的抑制作用(IC50值分别为61.80±5.7和75.68±6.2 μg/mL)[40];4个四环三萜化合物integracide A(71)、E(72)和2-deoxyintegracide A(73)、B(74)从青蒿(ArtemisiaannusL.)的内生真菌Hypoxylonsp.6269的菌丝体的乙醇提取物中分离得到,在耦合和链转移(ST)试验中,均具有抗HIV-1整合酶的活性,其中71、73和74在耦合反应和ST反应中表现出较强的活性,IC50值范围分别为4.95~7.62 μM和6.51~10.82 μM,而72在两种试验中的活性均较弱,此外构效分析表明化合物结构中完整的4,4-二甲基麦角甾烷骨架是必不可少的,而C-3位的硫酸酯基(71、73和74)和C-2位的羟基消失(73和74)分别在ST反应和耦合反应中发挥着重要作用[41];钩藤(Uncariarhynchophylla(Miq.) Miq.ex Havil.)健康组织中的内生真菌ColletotrichumgloeosporioidesGT-7中的倍半萜colletotrichine B(75),在酶(单胺氧化酶MAO、乙酰胆碱酯酶AChE和磷酸肌醇3-激酶PI3Kα)抑制活性测试中,仅对AChE具有抑制作用,IC50值为38.0±2.67 μg/mL[42]。
植物内生真菌中的萜类化合物亦有不少被发现具有抑菌作用的。从海洋褐藻(Sargassumsp.)表面酯化的新鲜组织中的内生真菌Trichodermaasperellumcf44-2中分离得到的环戊烷倍半萜7,10-epoxycycloneran-3,11,12-triol(76)和邻二萜11-hydroxy-9-harzien-3-one(77),在浓度为20 μg/disk时,均对海洋病原细菌Vibrioparahaemolyticus表现出抑制作用,效果优于阳性对照氯霉素[43];从三七(Panaxnotoginseng)内生真菌PenicilliumjanthinellumSYPF 7899中分离得到的austin(78),对Bacillussubtilis和Staphylococcusaureus表现出中等的抗细菌活性,MIC值分别为50和60 μg/mL[44];海莲的内生真菌Phyllostictacapitalensis中的甲氧萜guignardone A(79)和J(80),在抑菌活性测试中,均对Pseudomonasaeruginosa和Staphylococcusaureus表现出微弱的抑菌活性[33];trichocadinins B-G(81~83)是从艾蒿根内部组织的内生真菌TrichodermavirensQA-8中分离得到,在抑菌生物测定中,81~86均表现出广谱的抑细菌活性,其中86对水生病原菌Edwardsiellatarda和Vibrioanguillarum的抑制效果与氯霉素相当,此外81对13种病原真菌都具有抑制作用,而化合物81~86均对黄瓜枯萎病菌表现出抑菌活性,MIC值在1到64 μg/mL之间[45];从耐涝植物中华蚊母树(Distyliumchinense)的内生真菌IrpexlacteusDR10-1的无性菌丝培养基中分离得到的海藻糖倍半萜irpexlacte A(87),在抗细菌活性测试中,与阳性对照庆大霉素(MIC=0.18 μM)相比,对P.aeruginosa表现出中等的抑制作用,MIC值为24.1 μM[46]。
近年来,从植物内生真菌中寻找新的植物源除草剂也渐渐引起人们的关注。例如,冷杉烷型二萜hydroxyldecandrin G(88)从落叶树香椿(Toonasinensis(A.Juss.) Roem.)内生真菌Xylariasp.XC-16的发酵产物中分离得到,在化感作用生物测定中,与草甘膦(IC50=42.31±0.66 μM)相比,对小麦(T.aestivum)的芽伸长表现出强烈的抑制作用(IC50=23.58±0.43 μM)[47],这说明该化合物具有非常优越的除草剂先导结构的开发价值。
除上述常见的生物活性外,植物内生真菌中的萜类化合物还具有一些其他功能作用。例如,从贯叶连翘(HypericumperforatumL.)叶片中的内生真菌Aspergillussp.TJ23中分离得到的桥联螺环杂萜类化合物spiroaspertrione A(89)是苯唑西林的有效增强剂,在增效试验中将苯唑西林抑菌的MIC值降低32倍来抑制耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA)的生长[48];而从茭白(Zizaniacaduciflora)叶子内生真菌Annulohypoxylontruncatum的发酵产物乙酸乙酯提取部分中分离得到的annulohpoxylotol A(90),在核转录因子(NF-κB)活性测试中以剂量依赖的方式显著地抑制NF-κB的活性,IC50值为7.11 μM,而annulohpoxylotol B(91)只适度地抑制了NF-κB的转录活性,IC50值为19.24 μM,此外构效分析表明C-8上的羟基起着重要作用,这为开发新型抗炎药提供了科学依据[49]。
1.4 甾醇类
甾醇类化合物是一类由三个己烷环及一个环戊烷稠合而成的环戊烷多氢菲衍生物,广泛存在于生物体内。2017~2019年从植物内生真菌代谢产物中分离鉴定出的有生物活性的甾醇类化合物见图4。
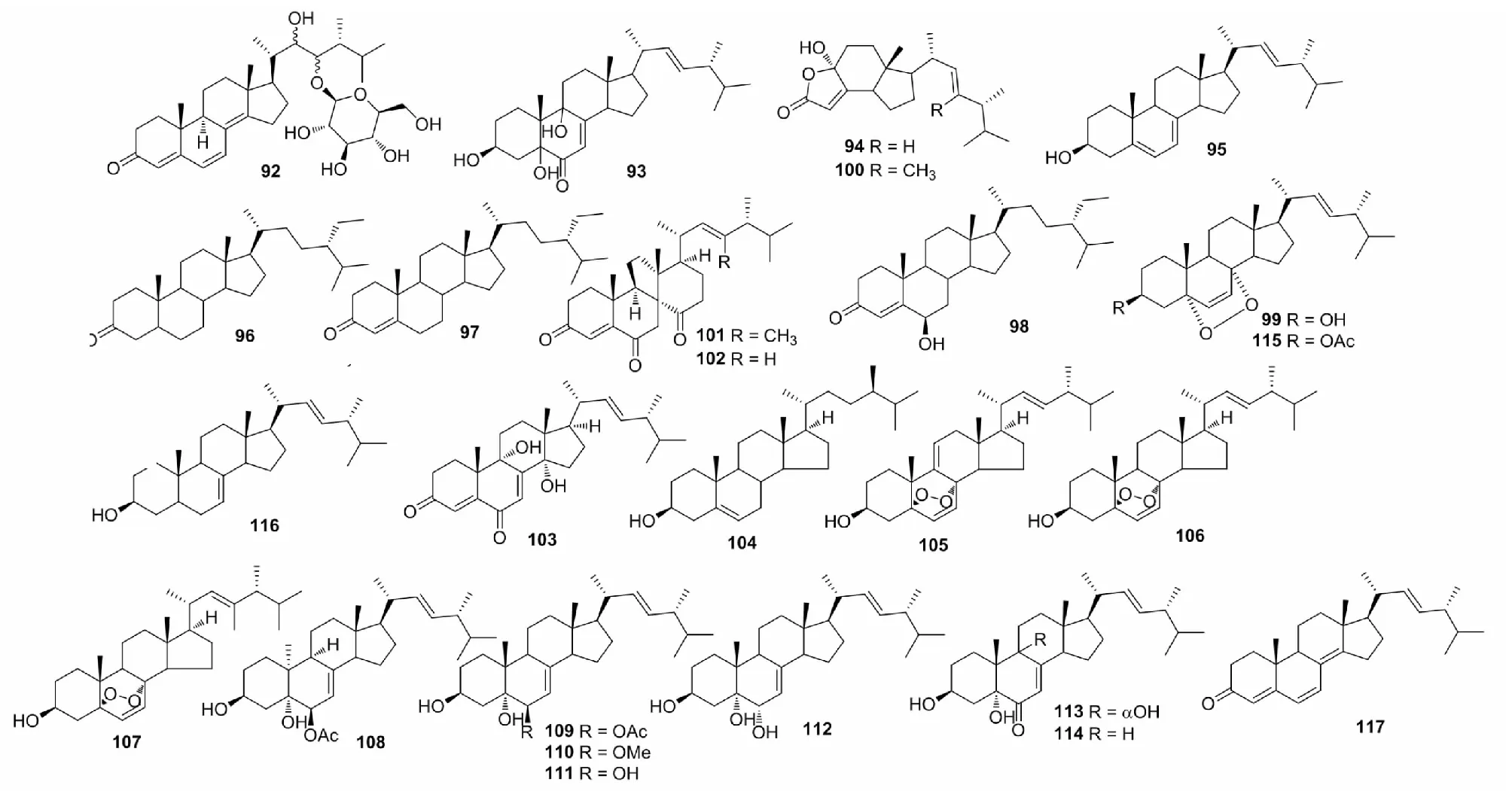
图4 甾醇类化合物(92~117)的化学结构Fig.4 The chemical structures of sterols (92-117)
植物内生真菌中的部分甾醇类化合物同样具有细胞毒活性。从三七(Panaxnotoginseng)叶片中的内生真菌Xylariasp.PH30434的固体发酵产物中分离得到的甾醇衍生物(24R)-22,23-dihydroxy-ergosta-4,6,8(14)-trien-3-one 23-β-D-glucopyranoside(92)在浓度为40 μM时,对乳腺癌细胞株MCF-7表现出明显的抑制作用,抑制率为72%[50];翅荚决明(CassiaalataLinn.)叶片中的内生真菌Fusariumsolani的发酵产物中的3,5,9-trihydroxyergosta-7,22-diene-6-one(93),在抗细胞增殖活性测试中,对非洲绿猴肾细胞株表现出显著的细胞毒作用,致死率接近35%[51];5个甾体化合物demethylincisterol A3(94)、ergosta-5,7,22-trien-3-ol(95)、stigmastan-3-one(96)、stigmast-4-en-3-one(97)和stigmast-4-en-6-ol-3-one(98)从红树植物红茄苳(RhizophoramucronataPoir.)内生真菌Pestalotiopsissp.中分离得到,在体外细胞毒活性测试中,均对3种供试癌细胞株(Hela、A549和HepG2)表现出显著的细胞毒性,其中94的活性最好,此外,研究表明94主要以剂量依赖的方式抑制了G0/G1期的细胞周期,显著诱导了晚期细胞凋亡或坏死,并对3种供试细胞均同时产生了严重损害,说明94是一个潜在的抗癌药物[52];(22E,24R)-5α,8α-epidioxyergosta-6,22-dien-3β-ol(99)是从烟草(NicotianatabacumL.)内生真菌FusariumsambucinumTE-6的发酵产物中分离得到的,对人肾癌细胞Caki-1表现出较好的细胞毒活性,其在24 h和48 h的IC50值分别为7.81和0.83 μg/mL[53];demethylincisterol A3(94)和A5(100)从云南红豆杉(TaxusyunnanensisCheng et L.K.Fu)树皮中的内生真菌AspergillustubingensisYP-2中分离得到,体外细胞毒活性结果表明,以阿霉素(0.94和1.16 μM)为参考,94对A549和HepG2的抑制作用较强,其IC50值分别为5.34和12.03 μM,而100对供试细胞株的活性较弱,IC50值分别为11.05和19.15 μM[54]。
植物内生真菌中的甾体化合物常见的活性还有抗炎作用。从青灰叶下珠(PhyllanthusglaucusWall.ex Muell.Arg)内生真菌Phomopsissp.TJ507A中分离得到的3个麦角甾烷型甾体化合物phomopsterone B(101)、dankasterone A(102)和calvasterol B(103)体外抗炎活性结果表明,在小鼠巨噬细胞RAW264.7中,均对脂多糖(LPS)诱导一氧化氮(NO)产生表现出较强的抑制作用,其IC50值分别为4.65、13.04和8.7 μM[55,56];而海洋盐生植物芦苇(Phragmitescommunis)根茎中的内生真菌Gaeumannomycessp.JS0464中的β-sitosterol(104)、5α,8α-epidioxyergosta-6,9(11),22-trien-3-ol(105)、ergosterol peroxide(106)和5α,8α-epidioxy-(22E,24R)-23-methylergosta-6,22-dien-3β-ol(107),在体外抗炎活性测试中,均能使脂多糖刺激BV-2小胶质细胞产生的一氧化氮减少,但106对细胞具有毒性作用,而104、105和107却不会使细胞失活[57]。
此外,植物内生真菌中的甾体化合物还有乙酰胆碱酯酶抑制作用和抑菌活性。从海洋刺松藻(Codiumfragile)内生真菌Eurotiumrubrum中分离得到的11个甾醇类化合物3β,5α-dihydroxy-10α-methyl-6β-acetoxy-ergosta-7,22-diene(108)、3β,5α-dihydroxy-6β-acetoxyergosta-7,22-diene(109)、(22E,24R)-ergosta-7,22-dien-6β-methoxy-3β,5α-diol(110)、(22E,24R)-ergosta-7,22-dien-3β,5α,6α-triol(111)、(22E,24R)-ergosta-7,22-dien-3β,5α,6α-triol(112)、(22E,24R)-3β,5α,9α-trihydroxyergosta-7,22-dien-6-one(113)、(22E,24R)-3β,5α-dihydroxyergosta-7,22-dien-6-one(114)、(22E,24R)-5α,8α-epidioxyergosta-6,22-dien-3β-ol(99)、(22E,24R)-5α,8α-epidioxyergosta-6,22-dien-3β-acetate(115)、(22E,24R)-ergosta-7,22-dien-3β-ol(116)和(22E,24R)-ergosta-4,6,8(14),22-tetraen-3-one(117),在乙酰胆碱酯酶抑制活性测试中,均对AChE表现出微弱的抑制作用[58];从碱蓬(Suaedaglauce)根茎中的内生真菌TalaromycespinophilusGMF19中分离得到的ergosterol(95),在抗真菌活性测定中,对4种植物病原真菌(V.mali,P.piricola,C.gloeosporioides和R.cerealis)均具有抑制活性,尤其对C.gloeosporioides的MIC值为32 μg/mL,略高于多菌灵(MIC=16 μg/mL)[59]。
1.5 蒽醌类
在天然产物中,蒽醌常存在于高等植物和低等植物地衣类和菌类的代谢产物中。2017~2019年从植物内生真菌代谢产物中分离鉴定出的有活性的蒽醌类化合物见图5。

图5 蒽醌类化合物(118~143)的化学结构Fig.5 The chemical structures of anthraquinones (118-143)
蒽醌类化合物的生物活性多样,细胞毒活性是主要活性之一。从水蕹科植物(Aponogetonundulatus)根内生真菌Fusariumsolani中分离得到的氮杂蒽醌7-desmethylscorpinone(118)和7-desmethyl-6-methylbostrycoidin(119),均对4种人类肿瘤细胞系(HeLa、MDA MB 231、MIA PaCa2和NCI H1975)表现出一定的细胞毒活性,IC50值在低微摩尔至亚微摩尔之间[60];而翅荚决明叶片中的内生真菌Fusariumsolani中的bostrycoidin(120)对非洲绿猴肾细胞显示出明显的抑制作用,细胞致死率接近25%[51];nigrosporone A(121)、B(122)和fusaquinon A(123)是从酸枣(Choerospondiasaxillaris(Roxb.) B.L.Burtt & A.W.Hill)叶子中的内生真菌Nigrosporasp.BCC 47789的发酵液的乙酸乙酯萃取物中分离得到的,在体外细胞毒测试中,122对NCI-H187(IC50=0.25 μM)和Vero细胞(IC50=0.72 μM)具有选择性细胞毒作用,而121和123则对MCF-7和NCI-H187显示出中度至弱的细胞毒活性(IC50=7.32~110.36 μM)[61];从木菠萝(ArtocarpusheterophyllusLam.)叶片中的内生真菌Diaporthelithocarpus的发酵产物中分离得到的emodin(124)对小鼠白血病P-388细胞表现出显著的抑制作用,IC50值为0.41 μg/mL[62]。
蒽醌类化合物的医学活性除抗肿瘤细胞活性外,还有抗炎、抗氧化作用。分离自喜马拉雅红豆杉(Taxusfauna)中的内生真菌PenicilliumpolonicumNFW9的二聚蒽醌(R)-1,1′,3,3′,5,5′-hexahydroxy-7,7′-dimethyl[2,2′-bianthracene]-9,9′,10,10′-tetraone(125),以楝酰胺(IC50=0.08 μM)作对照,对NF-κB表现出中等的抑制作用,抑制率是68.91%,IC50值为4.09 μM[63];1-O-methyl-6-O-(α-D-ribofuranosyl)-emodin(126)和1-O-methylemodin(127)从芦苇的内生真菌Gaeumannomycessp.JS0464中分离得到,在抗炎活性测试中,在不引起细胞死亡的情况下,均能使脂多糖刺激的小胶质细胞BV-2各自产生31%和43%的一氧化氮[57];而bostrycoidin(120)除具有细胞毒活性外,还具有显著的抗氧化活性,其IC50值为1.6 μg/mL,活性与抗氧化剂丁基羟基茴香醚(1.2)、水溶性维生素E(1.3)和维生素C(1.5)相当[51]。
此外,蒽醌化合物还对一些重要的生物酶具有抑制作用。红海褐藻内生真菌Fusariumequiseti中的ω-hydroxyemodin(128),在丙型肝炎病毒蛋白酶(hepatitis C virus protease,HCV PR)抑制活性试验中,对HCV NS3-NS4A蛋白酶具有明显的抑制作用,IC50值为10.7 μg/mL,此外其作为人胰蛋白酶抑制剂的选择性大约是HCV PR的4倍[25];从盐地碱蓬(Suaedasalsa(L.) Pall.)中的内生真菌Eurotiumrubrum的固体发酵产物中分离得到的rubrumol(129),在浓度为100 μM时,其松弛活性强于喜树碱,对拓扑异构酶I(Topo I)的弛豫作用也具有抑制活性,其IC50值为23 μM[64]。
蒽醌类化合物由于多羟基的存在,有抑菌活性的化合物较多。3个蒽醌化合物7-(γ,γ)-dimethylallyloxymacrosporin(130)、macrosporin(131)及7-methoxymacrosporin(132)和2个氢蒽醌tetrahydroaltersolanol B(133)及altersolanol L(134)从红树植物苦槛蓝(Myoporumbontioides)叶片中的内生真菌Phomasp.L28的发酵物中分离得到,在植物病原真菌抑制活性测试中,131显示广谱的抗真菌活性,值得注意的是,其对F.oxysporum(MIC=3.75 μg/mL)的抑制活性甚至优于多菌灵(MIC=6.25 μg/mL),相比之下,130和132对6种供试真菌表现出中等至弱的活性,表明130~132这三个化合物具有典型的构效关系,此外134对P.italicum(MIC=35 μg/mL)和R.solani(MIC=50 μg/mL)具有中等的抗真菌活性,而133对除P.italicum(MIC=80 μg/mL)以外的所有供试病原真菌均没有活性[65];bostrycoidin(120)在100 μg/disc的剂量下,对B.megaterium,S.aureus,P.aeruginosa和E.coli这四种植物病原细菌均表现出明显的抑制作用[51];nigrosporone B(122)对M.tuberculosis(MIC=172.25 μM)、B.cereus(MIC=21.53 μM)和E.faecium(MIC=10.78 μM)均显示出抗细菌活性[61];兵豆(LensculinarisMedic.)中的内生真菌Ascochytalentis中的lentiquinones A(135)、B(136)、C(137)和lentisone(138)对Bacillussubtilis均表现出抗细菌活性,而在抗真菌活性测试中,只有135对真菌Verticilliumdahlia、Penicilliumallii、Rhizoctoniasp.和Phomaexigua具有抑制作用[66];emodin(124)和1,2,8-trihydroxyanthraquinone(139)分离自木菠萝叶片中的内生真菌Diaporthelithocarpus,在抗菌活性测试中,124对M.luteus、B.subtilis、E.coli、P.fluorescences和S.cerevisiae这5种细菌均表现出显著的抑制作用,而139则对B.subtilis、E.coli和S.cerevisiae具有抗细菌活性[62];从印楝(AzadirachtaindicaA.Juss)果实中的内生真菌Paraconionthyriumsp.YM 311593的发酵液的乙酸乙酯萃取物中分离得到danthron(140),对Pyriculariaoryzae表现出微弱的抗真菌活性,MIC值为128 μg/mL,弱于多菌灵(MIC=4 μg/mL)[67];pachybasin(141)、1-hydroxy-3hydroxymethyl-9,10-anthraquinone(142)和aloe emodin(143)分离自大叶落地生根(Kalanchoedaigremontiana)的内生真菌菌株KIB-H11595,在抗菌活性评价中,141和143对青霉菌有抑菌效果,而142则对棉花枯萎病菌具有一定抑制作用[68]。
此外,有的蒽醌化合物还具有除草活性。例如,在叶片穿刺试验中,lentisone(138)对所有供试植物的叶片造成最大程度的坏死;而lentiquinone A(135)对家独行菜(Lepidiumsativum)的根长的抑制活性最高,与对照相比,抑制了近70%的根生长;另外在对寄生杂草Phelipancheramosa种子萌发的抑制活性测试中,与对照组相比,138完全抑制了种子萌发,而135则使杂草种子的发芽率降低了60%[66]。
1.6 其他类化合物
植物内生真菌次级代谢产物结构多样,除以上几种主要的结构类型的化合物具有生物活性以外,其他一些非常见的特征化合物类型也具有生物活性,化合物来源及活性见表1,化合物的结构见图6~图10。

表1 植物内生真菌中具有活性的其他类化合物

续表1(Continued Tab.1)

续表1(Continued Tab.1)
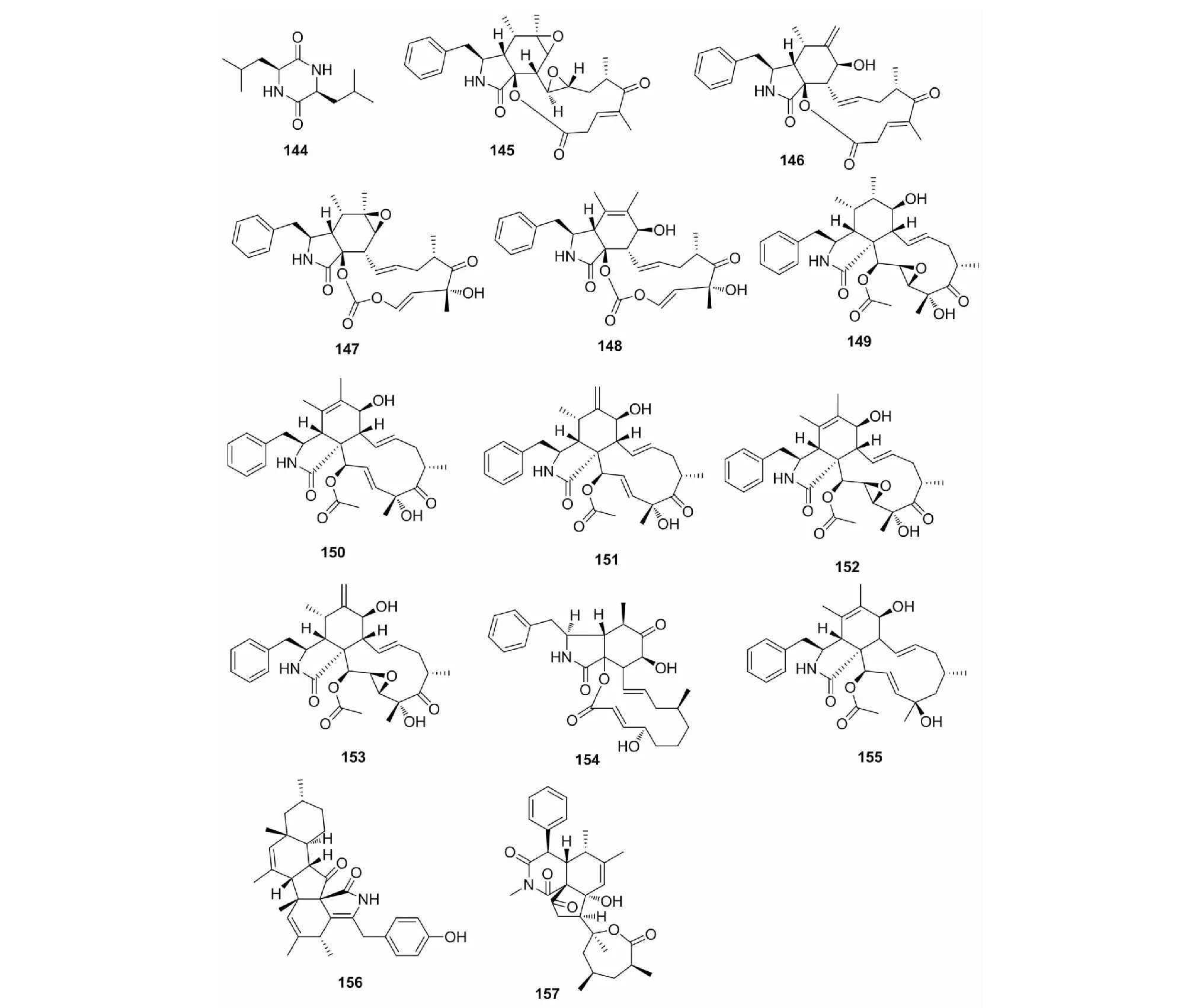
图6 细胞松弛素类化合物(144~157)的化学结构Fig.6 The chemical structures of cytochalasins (144-157)

图7 (异)香豆素类化合物(158~172)的化学结构Fig.7 The chemical structures of (iso-)coumarins (158-172)
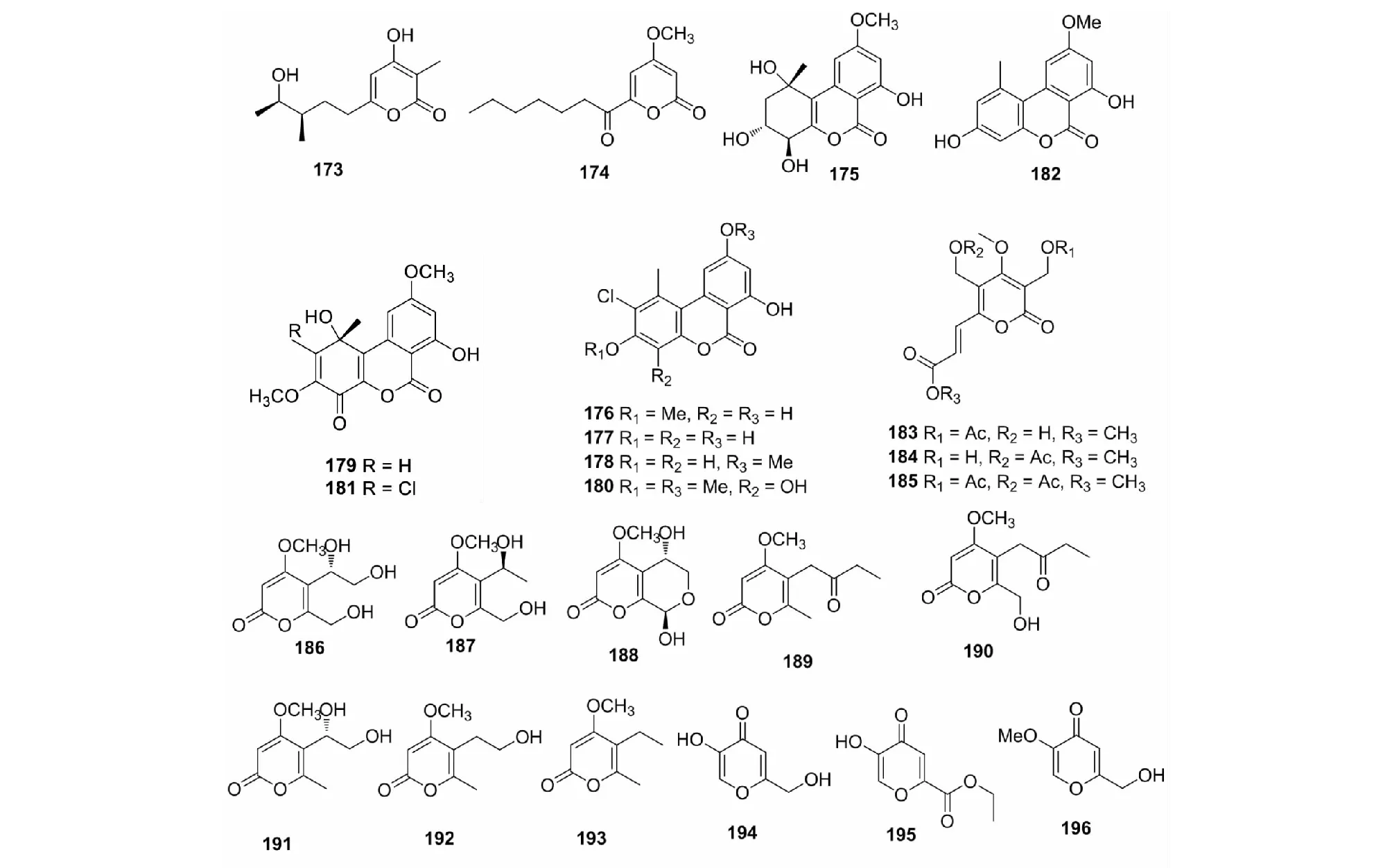
图8 吡喃酮类化合物(173~196)的化学结构Fig.8 The chemical structures of pyrones (173-196)

图9 缩酚酸环醚类化合物(197~209)的化学结构Fig.9 The chemical structures of depsidones (197-209)
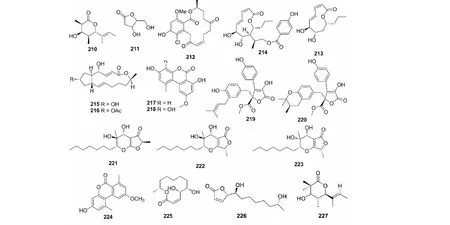
图10 内酯类化合物(210~227)的化学结构Fig.10 The chemical structures of lactones (210-227)
2 结论和展望
综上所述,我们知道植物内生真菌次级代谢物结构类型多样,有生物碱、聚酮、萜类、甾体和蒽醌等,此外这些代谢物也富含多种生物活性,如抗肿瘤、生物酶抑制、抑菌、抗炎和除草等活性,因而在医药研发和农业生产等[100-102]方面显现出巨大的应用潜力,成为各界研究的热点。
目前,在植物内生真菌生物活性代谢产物方面的研究虽取得了一定的成果,但是仍然存在诸多问题:(1)植物内生真菌发酵与培养大部分仅停留在实验室研究水平,导致其生物活性成分产量很低,很难大批量地将其商业化生产;(2)内生真菌在植物体内以及体外单独培养两种情况下的次级代谢产物合成途径及其代谢调控机制尚不明确,其作为微生物制剂在相关领域中的大规模实际应用鲜有报道;(3)从分子水平上探索内生真菌次级代谢产物的产生机制的相关研究较少;(4)从组学(基因、蛋白、代谢等)水平研究内生真菌活性代谢物的研究有待深入研究。因此,如能够解决上述问题,便为植物内生真菌活性成分的开发与利用提供了更多的参考依据。

