壳寡糖对葡聚糖硫酸钠诱导结肠炎小鼠的保护作用
陈 爽,王 斌,徐 颖,夏文水*
1江南大学食品学院 食品科学与技术国家重点实验室;2江苏省食品安全与质量控制协同创新中心,无锡 214122
炎症性肠病(inflammatory bowel disease,IBD)包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩症(Crohn’s disease,CD)。溃疡性结肠炎,于1875年由Wilk和Moxon发现,1903年由Boas和Wilk定义,1905年被WHO正式定为一种特殊的临床病症[1]。溃疡性结肠炎,是一种非特异性结肠炎,主要位于大肠中的乙状结肠和直肠,病灶连续性分布于黏膜及黏膜下层,并缓慢反复发作,也有少数急性发病,主要表现为腹痛、腹泻和粪便粘稠带脓血[2],还伴随有多种肠外症状[3]。溃疡性结肠炎确切的病因和发病机制目前仍不明确,普遍认为与感染、免疫系统失常、遗传敏感性、环境、精神、菌群失调等多种因素有关[4,5]。其在西方国家十分常见,每105人中就有10~20人患病,其中北美和西欧发病率更高[6]。而近年来我国的UC患病率也呈上升趋势。目前,治疗结肠炎已有5-氨基水杨酸类(柳氮磺吡啶)、免疫抑制剂等对症药物,但具有一定副作用,因此寻找安全药物成为研究热点[7]。
壳寡糖(chitooligosaccharides,COS),由壳聚糖(chitosan,CS)水解产生,聚合度2~20,且平均分子量小于3 900 Da[8-10]。其分子量小、易溶于水,可被生物机体直接吸收,具有减脂、降糖、抑菌、抗癌、抗炎等生物活性,且无毒副作用,可广泛应用于医药、化妆品、食品和农业等多个领域[11,12]。其中壳聚糖可由世界上含量仅次于纤维素的第二丰富的聚合物——甲壳素(常见于甲壳类动物壳,昆虫表皮和真菌细胞壁[10,13])脱乙酰化获得。目前,已有一些壳寡糖作用肠炎的研究,如Yang等[14]发现壳寡糖可通过AMPK、NF-κB实现对结肠炎的保护作用。但是在应用浓度上明显偏高(一般为500 mg/kg,换算为人体剂量约3.6 g),远远超过国家推荐摄入剂量0.5 g/天(参见《关于批准壳寡糖等6种新食品原料的公告(2014年第6号)》,换算成小鼠剂量为70 mg/kg)。而Yousef[15]利用乙酸滴注结肠炎模型、肠上皮细胞试验等发现20 mg/kg剂量下的壳寡糖也能对肠炎起到保护作用。因此本文主要通过 3% DSS 饮用水诱导结肠炎小鼠模型,验证壳寡糖在不同剂量下(70和140 mg/kg)对结肠炎的干预情况,探究壳寡糖在调节小鼠结肠炎症和生理状态上的作用,为进一步研究壳寡糖对DSS诱导结肠炎小鼠的保护作用提供数据支持。
1 材料与方法
1.1 试剂和仪器
葡聚糖硫酸钠(DSS,相对分子量36 000~50 000 Da,美国MP生物医学公司);壳寡糖(相对分子量约为1 299 Da,脱乙酰度85%,浙江金壳生物化学有限公司);柳氮磺吡啶(美国Sigma公司,批号S0883-10G);隐血测试盒、髓过氧化物酶(MPO)试剂盒(南京建成生物工程研究所);IL-6、TNF-αELISA检测试剂盒(美国R&D公司);苏木素伊红(HE染色)试剂盒(北京索莱宝科技有限公司)。
WTL-6K迷你离心机(湖南湘仪离心机仪器有限公司);4K15冷冻型大容量离心机(德国Sigma公司);UV-1800型紫外可见分光光度计(日本岛津公司);M5酶标仪(美国Molecular Devices公司);PM2245徕卡手动转轮切片机(德国徕卡公司);ECLIPSE尼康显微镜(日本尼康公司);DK0-8D恒温水浴锅(金坛市新航仪器厂);超低温冷冻冰箱(日本三洋电机公司)。
1.2 实验方法
1.2.1 实验设计
野生型SPF级的6~8周龄雄性C57BL/6小鼠50只,体重在18~20 g,购买于斯贝福(北京)实验动物科技有限公司,实验动物生产许可证号:SCXK(京)2019-0010,饲养于江南大学实验动物研究中心,动物使用许可证号:SYXK(苏)2016-0045。保持室温20~24 ℃,湿度60%~70%,人工光照12 h/天,实验开始前适应性喂养1周,自由饮食。
将小鼠随机分为5组,10只/组,除空白组外,各组连续饮用3% DSS 7天建立溃疡性结肠炎模型,同时给予相应药物治疗:DSS组(无菌水,0.2 mL,灌胃);阳性组(柳氮磺吡啶50 mg/kg,0.2 mL,灌胃);壳寡糖低剂量组(壳寡糖70 mg/kg,0.2 mL,灌胃);壳寡糖高剂量组(壳寡糖140 mg/kg,0.2 mL,灌胃)。所有药物现配现用,小鼠自由采食。第8天,所有小鼠眼球取血,3 000 rpm离心10 min取血清-80 ℃保存。断颈处死小鼠,迅速剪开腹腔,取出整段结肠,测定长度,纵向剪开,分离结肠内容物,用预冷PBS清洗,定性滤纸干燥,称重。留取相同部位用4%多聚甲醛固定,做病理组织学,剩下部分液氮速冻,转存-80 ℃冰箱待用。
1.2.2 疾病活动指数(disease activity index,DAI)和组织病理学评分
每日观察小鼠进食饮水、毛发等生理状态和体重、粪便、隐血等情况,计算体重变化率和DAI总分。参考Cooper[16]的DAI评分标准,见表1。
体重变化率=实验当天体重/起始体重×100%
DAI=大便性状+体重丢失+便血情况
结肠经4%多聚甲醛固定,脱水透明,石蜡包埋后,切片、脱蜡和HE染色,透明并封片,镜检观察。病理组织学评分标准则参照Cooper标准[16],具体评分标准为:0正常肠黏膜;1黏膜层轻度炎症和水肿,基底部1/3隐窝消失;2黏膜层中度炎症,基底部2/3隐窝消失;3黏膜层中度炎症,隐窝完全消失,但上皮层尚完整;4粘膜层、粘膜下层、肌层重度炎症,隐窝和上皮层消失。
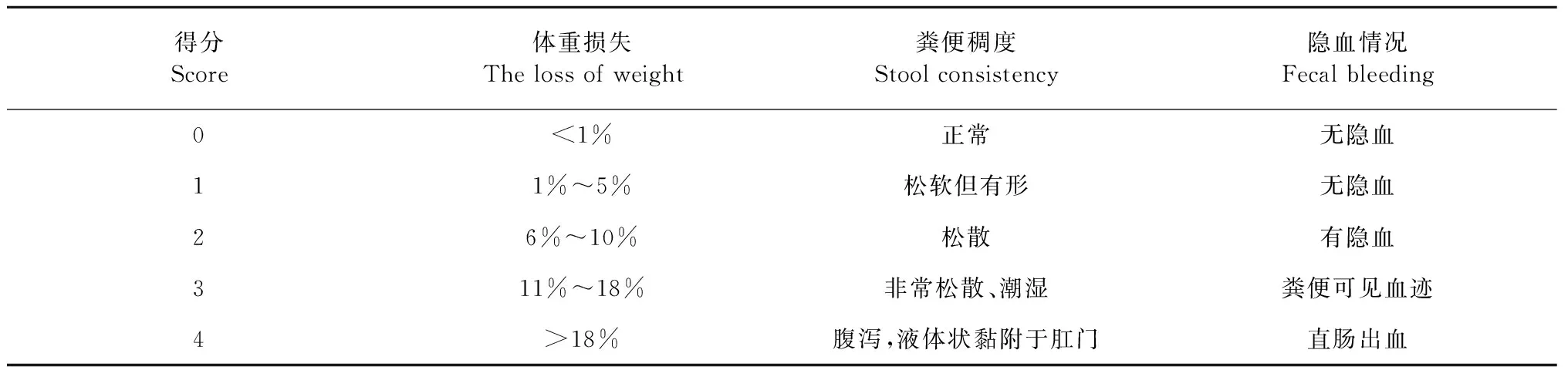
表1 DAI评分标准
1.2.3 结肠髓过氧化物酶(MPO)活性及IL-6和TNF-α含量的检测
结肠MPO活性按照南京建成试剂盒说明书进行测定。结肠IL-6和TNF-α含量检测按照R&D试剂盒说明书进行测定。
1.3 统计学处理

2 结果
2.1 小鼠体重和DAI变化
如图1所示,实验前各组间小鼠体重无显著差异(P>0.05),随着DSS的饮用,除空白组体重每天缓慢增长外,所有饮用DSS水的小鼠体重呈现下降趋势,模型组小鼠从第6天开始体重变化率与空白组相比具有显著的统计学差异(P<0.05),第7天开始较空白组具有极显著差异(P<0.01)。壳寡糖低、高剂量组和阳性药柳氮磺吡啶组,相比模型组,体重下降程度有所减小,但无显著性差异(P>0.05)。其中壳寡糖低、高剂量组后期趋势近乎重合,且相比阳性组,体重下降趋势减缓。
除体重外,自由饮用DSS水的各组小鼠也出现饮食减少的症状,且第4天开始出现不同程度的腹泻,第6天开始逐渐出现便血等症状。第5天开始,模型组小鼠的DAI评分显著增加,与空白组具有极显著差异(P<0.01)。至第8天,模型组的DAI评分达到最高。其中壳寡糖各剂量组和阳性组,相比模型组,DAI评分均有下降趋势,与模型组无显著区别(P>0.05),其中壳寡糖各剂量组评分低于阳性组。
图1 壳寡糖对结肠炎小鼠体重变化率和DAI评分的影响Fig.1 Effects of COS on the weight change and DAI score of colitis in mice注:模型组与空白组比较,#P<0.05,##P<0.01。Note:Model group compared with control group,#P<0.05,##P<0.01.
2.2 结肠长度、病理组织学评分
结肠长度是衡量小鼠结肠炎的一个重要指标,随着炎症的加重,结肠会肿胀缩短。
如图2和表2所示,空白组小鼠结肠表面光滑,未见水肿充血症状,肠内粪便成型,长度最长,而模型组小鼠的结肠相比空白组长度极显著缩短(P< 0.01),且伴有明显水肿,肠道内粪便呈血水样脓液。干预后,小鼠结肠长度缩短情况有所缓解,其中壳寡糖低剂量组的结肠缩短程度相比模型组具有极显著差异(P< 0.01),说明壳寡糖70 mg/kg剂量下能显著缓解DSS诱导的结肠缩短症状。而阳性组与模型组没有明显变化(P> 0.05)。
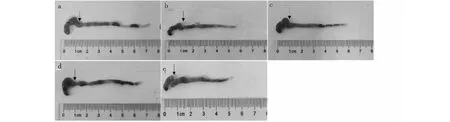
图2 壳寡糖对结肠炎小鼠结肠长度的影响 Fig.2 Effects of COS on the colon length of colitis in mice注:箭头右边肠道为结肠。a:空白组;b:模型组;c:阳性组;d:壳寡糖低剂量组;e:壳寡糖高剂量组,下同。Note:The right part of the arrow is the colon.a:Control group;b:Model group;c:SASP;d:COSL;e:COSH,the same below.
表2 壳寡糖对结肠炎小鼠结肠长度和重量/长度比值的影响

图3 小鼠结肠组织HE染色病理图(×100)及评分图Fig.3 Histopathological microphotographs and scores of colonic mucosa of mice stained with hematoxylin and eosin (×100)注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01,下同。Note:Compared with control,##P<0.01;Compared with model, *P<0.05,**P<0.01,the same below.
经过石蜡包埋H&E染色后,镜检观察,如图3所示:空白组小鼠的结肠粘膜层完整,腺体排列整齐,未见明显炎症细胞浸润。而模型组的结肠粘膜明显水肿,腺体明显缺失,隐窝和杯状细胞消失大半,炎症细胞浸润情况严重,病理评分与空白组相比极显著增加(P<0.01)。而结肠炎小鼠给药(阳性药和壳寡糖)后,结肠粘膜的上皮细胞较模型组完整,炎症细胞浸润虽至粘膜下层,但程度较轻,显示损伤有所改善。其中阳性组和壳寡糖高剂量组病理评分与模型组相比,显著下降(P<0.05)。壳寡糖低剂量组的杯状细胞隐窝等结构是所有饮用DSS水小鼠中最完整的,与模型组具有极显著差异(P<0.01)。
2.3 髓过氧化物酶
如图4所示,饮用DSS水后,模型组小鼠的结肠髓过氧化物酶活性(MPO)较空白组升高,且具有显著差异(P<0.05)。给药干预后,阳性组的MPO活性显著下降,与模型组有显著差异(P<0.05),而壳寡糖低、高剂量组的MPO活性相对模型组有一定下降,但没有显著差异(P>0.05)。
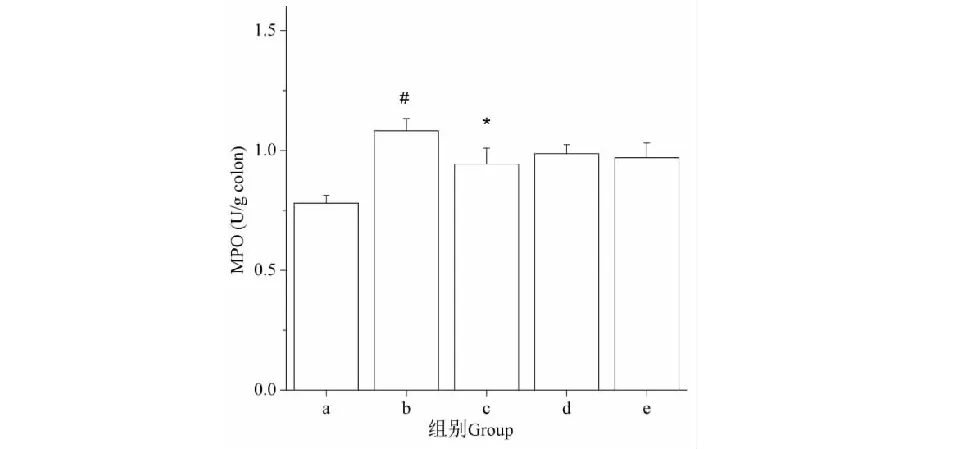
图4 壳寡糖对结肠炎小鼠结肠组织MPO活性的影响Fig.4 Effects of COS on the MPO activity of colitis in mice
2.4 结肠炎症因子
ELISA检测结果所示图5,与空白组相比,模型组小鼠中结肠组织的促炎因子IL-6和TNF-α水平升高,且具有极显著差异(P<0.01),表明DSS引起明显结肠炎症;给药后,与模型组相比,壳寡糖低、高剂量组的小鼠能显著下调结肠组织中的促炎因子(P<0.05),其中阳性组与模型组具有极显著差异(P<0.01),水平接近空白组。

图5 壳寡糖对结肠炎小鼠结肠组织IL-6和TNF-α浓度的影响Fig.5 Effects of COS on the concentrations of IL-6 and TNF-α in colonic homogenates of colitis in mice
3 讨论
DSS结肠炎模型是1990年建立的国际公认并被广泛应用的实验性UC动物模型,其病理改变为溃疡形成、隐窝脓肿、小血管炎症、杯状细胞减少以及各种炎性细胞的浸润,和人体结肠炎临床症状及其相似。国家推荐壳寡糖的人体剂量为0.5 g/人,换算成小鼠剂量为70 mg/kg,因此,利用此模型,我们选用70 mg/kg和140 mg/kg两种壳寡糖剂量探究其对DSS诱导结肠炎的干预效果。韩国一篇文献对壳寡糖进行了急性毒性实验,认为壳寡糖在小鼠体内的LD50超过5.0 g/kg[17]。Zhao等[18]对壳寡糖功能食品进行的安全性评价显示,通过对小鼠(1.25 g/kg/天)、大鼠(1.47 g/kg/天)给药(约临床推荐剂量的312~368倍),10天内未观察到急性毒性反应。本实验通过让小鼠自由饮用3% DSS 7天,建立溃疡性结肠炎模型。在实验第6天可观察到模型组小鼠出现典型的结肠炎生理症状,如体重减轻,食欲不振,毛发不光滑、腹泻、粪便粘稠带血甚至肛门带血等。第八天解剖发现模型组小鼠结肠缩短、结肠组织充血、水肿,HE染色发现结肠粘膜水肿,上皮细胞不完整、隐窝腺体结构消失、炎症浸润严重等。而通过壳寡糖低剂量(70 mg/kg)、高剂量(140 mg/kg)干预的小鼠,上述症状均有所改善。和Yousef等[15]的结果一致,他指出的壳寡糖能减少肠道上皮细胞的凋亡,抑制炎症,保护肠上皮屏障的结构和功能完好。有研究认为炎性肠病是由肠上皮屏障缺陷和粘膜免疫应答失调引起的[2],壳寡糖能保护肠上皮细胞,说明其在肠炎中起到了重要的保护作用。本实验中,壳寡糖70 mg/kg剂量组在改善结肠缩短程度、缓解结肠粘膜水肿、保护杯状细胞和隐窝结构等方面,与模型组相比具有显著性差异,而140 mg/kg剂量组在改善结肠缩短程度方面,相比模型组没有显著性差异,在改善病理组织评分上仅有显著差异,显示壳寡糖低剂量组对DSS诱导结肠炎小鼠的保护作用更好。结果表明70 mg/kg剂量壳寡糖有一定缓解小鼠结肠缩短,保护结肠结构的作用,有助于壳寡糖在国家推荐的剂量下进行开发应用。
目前IBD的治疗方向主要有氧化应激和炎症。其中认为氧化应激是IBD的致病基础,其中过量的氧自由基是溃疡性炎症组织损伤和结肠炎形成的关键因素[19]。随着MDA的产生,过量的NO 产生氧自由基,引起氧化损伤,从而导致组织中大量炎性细胞的浸润[20]。中性粒细胞在UC早期是最快募集到炎症部位的免疫细胞。其具有双重作用,一方面在上皮隐窝和肠腔内聚集,通过释放活性氧(ROS)分泌IL-1、IL-6、MPO等,诱导进一步的组织损伤,另一方面通过分泌抗炎因子积极维持组织环境稳态,并可限制微生物侵袭[21]。Qiao等[22]研究发现壳寡糖在LPS诱导的败血症小鼠模型中能降低受损器官中性粒细胞的浸润和脂质过氧化反应。Dou等[23]在兔体内发现壳寡糖能抑制已活化的中性粒细胞产生活性氧、抑制其脱颗粒和黏附,从而起到抗炎作用。髓过氧化物酶值(MPO)是组织损伤和中性粒细胞(PMN)浸润的标志,可导致粘膜破裂和溃疡,且与IBD有重要关系[24,25]。
实验中结肠炎模型组小鼠MPO活性相比空白组显著上升,表明中性粒细胞在肠道组织内明显增多,浸润严重。壳寡糖干预后,结肠组织MPO活性有所下降,虽然未与模型组具有显著差异,但也有减缓中性粒细胞在肠道聚集,减少进一步组织损伤的趋势。这和Dou等[11]在糖原性腹膜炎小鼠中发现的壳寡糖能促进中性粒细胞的凋亡,减少MPO的释放一致,猜测其可能通过活化PLD和PI3K,诱导中性粒细胞产生超氧化物等物质有关。
而UC是多种因素共同作用的结果,其中细胞因子在其中也发挥着重要作用。IL-6在低浓度时可刺激T细胞的增殖,活化B细胞的增殖,分泌抗体,高浓度时参与机体炎症反应。TNF-α,又称肿瘤坏死因子-α,由活化后的巨噬细胞Ⅱ单核细胞活化产生,促进凋亡。IL-6和TNF-α作为两种重要的炎症细胞因子,是机体受到致病刺激后,反应最快速且显著的炎症因子,常见于各种免疫病、炎症反应、肿瘤免疫等病理过程[26]。在UC患者结肠粘膜组织中,IL-6和TNF-α在活动期的表达远高于缓解期,在肠道粘膜的炎症和免疫反应中也起到重要作用,被认为是介导IBD的关键细胞因子[27]。核因子-κB(NF-κB)是一种有关炎症细胞因子表达的重要转录因子,机体受到刺激后,IκB可被激活降解,激活胞浆内NF-κB并进入细胞核,诱导基因转录,生成各种炎症因子或趋化因子,如 IL-1β、IL-6、IL-12和TNF-α等,通过反馈放大进一步加剧。Youself等[15]认为壳寡糖通过抑制NF-κB通路缓解机体炎性反应。本实验中溃疡性结肠炎小鼠结肠组织中的IL-6和TNF-α表达显著升高,而壳寡糖低、高剂量组干预后能显著降低其表达水平,与Yang[14]和Youself等[15]结果一致。表明壳寡糖可通过缓解炎性反应有效改善结肠炎症状。
通过壳寡糖两个剂量的实验结果比较发现,两组剂量的壳寡糖均有减缓DSS诱导的体重损失、结肠缩短和抑制疾病活动指数、MPO活性上升的趋势,能显著改善病理组织学变化、组织TNF-α、IL-6含量的增加,其中低剂量组较高剂量组在缓解结肠长度、病理组织学变化中具有更优作用。表明低剂量组COS在缓解结肠炎症上具有更好的效果。Yousef等[15]用1、5、10、20、50、100 mg/kg剂量COS处理结肠炎小鼠,发现10和20 mg/kg COS具有最好效果,在之后的LPS、TNF-α诱导的T84细胞中,也发现了类似的COS剂量-效果之间的钟形关系,猜测可能与COS能刺激两种不同的信号通路,产生相反效应,引起功能拮抗有关。此剂量-效果之间的联系在本实验室之前的研究中也有发现,Ding[28]将35、70、140、210 mg/kg剂量COS应用于酒精性脂肪肝小鼠,发现70和140 mg/kg组的保护效果较好。本文所选70和140 mg/kg COS可能正好处于钟形的中后部分,实验结果显示低剂量组效果略好于高剂量组。
综上所述,壳寡糖能有效缓解DSS诱导的结肠炎症状,其中70 mg/kg的壳寡糖在缓解结肠长度、结肠病理组织学变化上,相比140 mg/kg更有效,且在人体推荐剂量内,更适合作为应用剂量。同时,壳寡糖可能通过缓解中性粒浸润程度和抑制促炎因子的释放,起到降低炎症、缓解IBD症状的作用。然而,壳寡糖在抑制炎性细胞因子释放中的具体作用机制还有待进一步验证。

