补充丙氨酰谷氨酰胺对老年食管癌患者同步放化疗治疗顺应性的影响
曹 亮 张士庚 李瑞卿
泰安市肿瘤防治院放疗科 山东 泰安 271000
同步放化疗是食管癌的重要治疗手段[1]。早期食管癌经手术治疗效果尚佳[2],多数食管癌患者就诊时属于中晚期,因吞咽困难而呈营养不良状态,特别是年老体弱患者,治疗顺应性差,其化疗过程中往往会出现恶心、消瘦、骨髓抑制等不良反应[3],加之放疗不可避免会引起食管黏膜急性炎症,吞咽疼痛,从而进一步加重营养不良。营养不良可以引起患者机体抵抗力降低,造成治疗的延后,甚至中断,严重影响患者的预后[4]。谷氨酰胺能够增强肿瘤病人的免疫功能,激活宿主产生抗肿瘤免疫应答,也是近年来比较热门的“免疫营养”研究[5]。丙氨酰谷氨酰胺能够改善肿瘤的蛋白质营养水平,提高免疫功能,降低感染发病率,减轻机体炎症反应,降低化疗的不良反应[6]。目前肿瘤治疗过程中营养支持大多选择全营养素补充,因而缺乏针对食管癌患者放化疗期间代谢特点进行的营养干预措施。本研究旨在探讨添加丙氨酰谷氨酰胺的营养素治疗对老年食管癌患者同步放化疗治疗顺应性的影响。
1 资料与方法
1.1 一般资料 选取2015年11月至2018年11月在泰安市肿瘤防治院(泰安市癌症中心)进行同步放化疗的老年食管癌患者60例。采用随机数字表法分为试验组和对照组,两组均进行常规营养支持和膳食指导,试验组放化疗日每日补充丙氨酰谷氨酰胺20 g,对照组仅行常规营养支持及膳食指导。入选标准:①患者年龄≥60岁,性别不限;②经胃镜病理学证实为食管鳞状细胞癌;③未接受化疗及手术治疗,具备同步放化疗指证的患者。④体重虽有下降,但小于10%;⑤饮食量虽有下降,但大于目标喂养量的60%;⑥患者主观整体评估 (patient-generated subjective global assessment,PG-SGA)评分≥4分;⑦器官功能良好,无其它脏器转移。⑧预期寿命≥12周;⑨能理解本研究的目的和不良反应,患者和亲属知情同意参加本研究。本研究得到我院医院伦理委员会批准。剔除标准:①严重营养不良的患者[体重丢失>10%或血白蛋白<30 g/L或体质指数(BMI)<18.5 Kg/m2];②同时合并严重的心、脑和肺等疾病;③伴有慢性肝炎及肝硬化、慢性肾炎、肾功能不全及未控的糖尿病患者;④同时伴有感染相关性发热;⑤既往对肠外、肠内营养成分过敏或不能耐受该制剂。
1.2 研究分组 根据营养干预方式,采用随机数字表法分为试验组和对照组,进行随机对照临床研究。两组患者肿瘤治疗方案相同,为调强放疗50~60 Gy /25~30 f,化疗方案为:紫杉醇60~90 mg d1,每周1次,连用4~6周。观察终点时间:食管癌为放疗疗程结束,两组的基础营养支持方案相同。确立目标喂养量:总供能为125.5~146.4 J/Kg;各营养素供给量分别为:碳水化合物3~5 g/(Kg·d),脂肪1~1.3 g/(Kg·d),蛋白质1.2~1.5 g/(Kg·d)。营养干预方式包括膳食指导和口服营养素补充。试验组在此基础上补充谷氨酰胺20 g/d,放疗日应用。
1.3 观察指标 ①患者体重变化;②营养相关血液检查指标:治疗前后检测白蛋白、前白蛋白、转铁蛋白、血红蛋白、白细胞、血小板水平;③严重放射性食管炎、放射性肺炎及骨髓抑制情况;④治疗计划完成率评价:是否按计划完成放化疗;⑤免疫功能:血液中 CD4+、CD8+、CD4+/CD8+T淋巴细胞,采用流式细胞仪分析法测定。

2 结果
2.1 人口学数据基线 60例食管癌同步放化疗患者,分别随机入组。试验组30例(男20例,女10例),对照组30例(男16例,女14例)。两组治疗前的年龄、性别、营养状况、体重、血液学等指标比较,差异无统计学意义,具有可比性(见表1)。
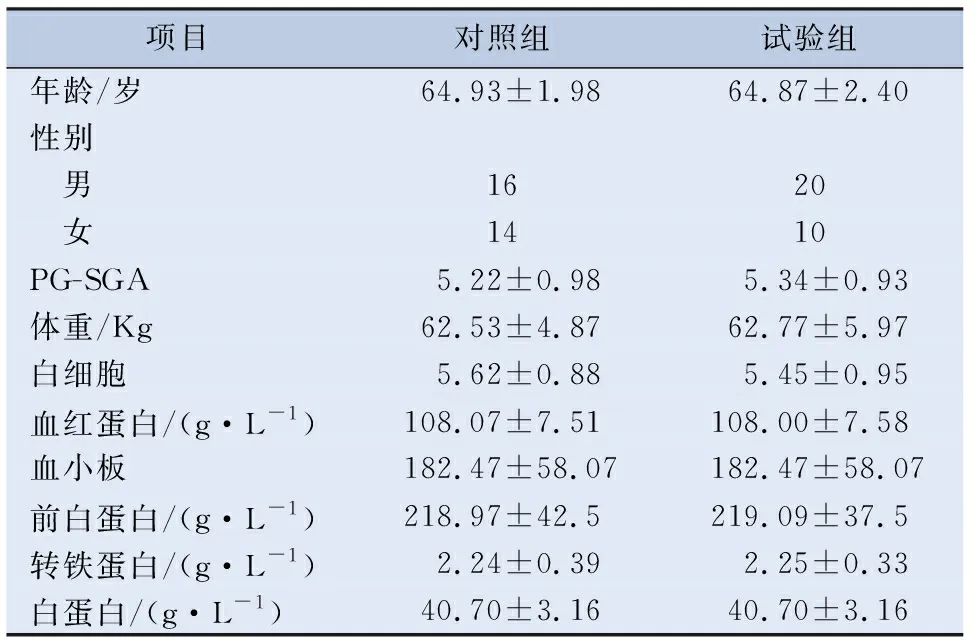
表1 患者治疗前一般资料
2.2 两组相关营养指标变化 所有治疗前相关指标两组差异无统计学意义,但同步放化疗后,两组相关指标变化结果见表2。经放化疗后,试验组血白蛋白和血红蛋白均无明显变化,对照组白蛋白和血红蛋白均显著下降,两组比较差异有统计学意义(P<0.05);与治疗前比较,两组血前血红蛋白的差异均无统计学意义,但试验组治疗后血前白蛋白水平比对照组高(P<0.05);试验组血转铁蛋白治疗前后的差异无统计学意义,经过放化疗后,对照组血转铁蛋白下降(P<0.05),试验组血转铁蛋白比对照组高(P<0.05)

表2 两组治疗前后相关营养指标比较
2.3 两组放疗不良反应情况 治疗过程中,两组患者放射性肺炎(≥3级)无差别,但患者骨髓抑制(≥3级)的发生情况,试验组明显好于对照组,P<0.05,放射性食管炎(≥3级)方面试验组亦明显低于对照组,P<0.05,见表3。试验组按计划完成治疗96.7%(29/30),其中有1例患者未按计划完成治疗,而对照组中有5例患者因为严重并发症暂停或终止治疗。
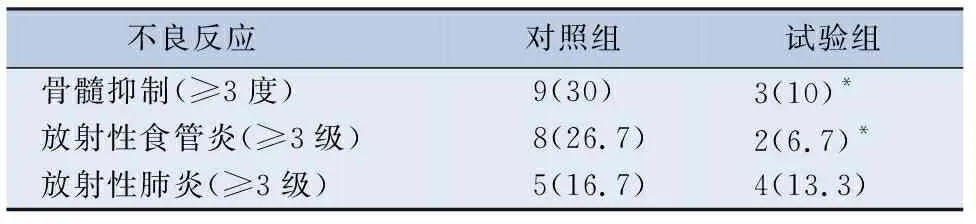
表3 两组不良反应发生情况/n(%)
2.4 免疫功能指标变化情况 两组患者治疗前后免疫指标试验组差异无统计学意义,而对照组CD3+、CD4+明显降低,P<0.05,且试验组患者免疫指标好于对照组,见表4。
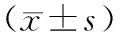
表4 患者调强放射治疗前后T细胞亚群变化情况
3 讨论
全球肿瘤报告显示,食管癌在男性所有肿瘤死亡中占第六位,女性占第七位[7]。我国是食管癌的高发区,其发病率排在全部恶性肿瘤的第5位[8],且多数为老年患者,食管癌患者由于肿瘤本身的消耗性、食管病变部位的特殊性致使其初诊时多合并营养不良, 据报道食管癌患者营养不良发生率高达60%~85%[9],约 20%的食管癌患者其死亡结局是由于营养不良和营养不良导致的相关并发症引起的,而非肿瘤本身[10]。因其早期症状不明显,发现时大多为中晚期,已失去手术机会,多数患者需行放化疗,但患者行放化疗又增加了营养不良发生风险,营养不良还会导致患者住院时间延长,有些患者因此中断治疗。因此,对肿瘤患者实施营养支持治疗可改善患者的营养状况,对于保证治疗的疗效、降低治疗并发症发生率、提高患者的生活质量具有积极意义[11]。放疗和手术是食管癌根治的治疗手段,同步放化疗目前是不能手术或拒绝手术治疗的食管癌患者的首选治疗方案[12],其除了最大限度地发挥化疗和放疗的抗肿瘤协同效用外,还可以抑制肿瘤细胞耐药基因的表达。但同步放化疗的不良反应较单纯放疗或化疗更重,所以对患者进食的影响会更明显。营养状况不仅与抗肿瘤治疗的耐受性相关,还会加大放疗摆位误差,影响放疗精确度,降低放疗敏感性,从而直接影响患者的治疗效果及生存期[13],而且多数患者因放化疗反应中断治疗。2015年我国发布了食管癌放疗患者肠内营养专家共识,为食管癌患者的肠内营养提供了依据,且国内外的多项研究均证实,肠内营养对食管癌患者营养状态有明显改善[14]。但考虑到食管癌患者多数为老年患者,因本身老年患者营养代谢异于中青年人,故除单纯基于此共识基础上的常规营养支持和膳食指导,是否有其他措施可以减少老年食管癌患者同步放化疗期间或之后出现营养不良、治疗中断、副反应、免疫力下降风险等,进而提高老年患者治疗顺应性。故本研究旨在探讨添加谷氨酰胺的营养治疗对老年食管癌同步放化疗患者营养状况及治疗顺应性的作用。丙氨酰谷氨酰胺是肠外营养的一个组成部分,适用于需要补充丙氨酰谷氨酰胺的患者,同时谷氨酰胺是一种条件必需氨基酸,对人体的营养状态及免疫功能的维持十分重要。当前对于常规营养支持和膳食指导下对恶性肿瘤患者营养状态改善、并发症减少、同步放化疗副反应降低、生活质量提高及改善预后等方面的研究较多,但在此基础上加用丙氨酰谷氨酰胺,对食管癌患者,特别是老年食管癌患者同步放化疗的影响研究较少。在肿瘤患者中,谷氨酰胺强化的营养支持改善了患者的免疫抑制。谷氨酰胺可以恢复机体NK细胞的功能,增强肿瘤患者的免疫功能,激活宿主产生抗肿瘤免疫应答,并能有效地清除机体内残存的肿瘤细胞,防止肿瘤的复发和转移,也即是近几年研究比较热门的“免疫营养”问题。研究表明补充谷氨酰胺可以保护放化疗患者的胃肠道黏膜上皮完整性及促进骨髓增殖,降低放化疗不良反应[15]。本研究发现,在一般营养指标方面,两组患者体重变化无明显差异,表面增加丙氨酰谷氨酰胺,对患者体重影响不大,血红蛋白及白蛋白试验组变化不明显,但对照组下降,考虑与丙氨酰谷氨酰胺改善机体蛋白质代谢有关,血前白蛋白方面相比于治疗前,试验组和对照组的血前白蛋白均增加,但差异无统计学意义,试验组更明显,表明两组都改善了患者前白蛋白,但丙氨酰谷氨酰胺组更明显,相比于治疗前,试验组治疗后血转铁蛋白升高,而对照组经过放化疗后,血转铁蛋白显著下降,也表明了丙氨酰谷氨酰胺等优势。两组虽然在严重放射性肺炎方面差异无统计学意义,但两组患者在放射性食管炎方面,丙氨酰谷氨酰胺组明显优于对照组,考虑与丙氨酰谷氨酰胺提高免疫功能、降低感染发病率、减轻机体炎症反应等有关。综上所述,在常规营养支持和膳食指导的同时加用丙氨酰谷氨酰胺,可以改善患者营养状况、降低严重毒副反应的发生概率,且改善患者免疫状态。

