宣肺逐饮方对肺癌恶性胸腔积液模型小鼠胸膜粘连、ERK1/2通路及AQP4表达的影响
卢杉杉,钱自明,颜 辉,姚 飞,王 猛
肺癌是全球癌症患者死亡的主要原因,肺癌患者中约15%在初次诊断时伴有恶性胸腔积液,30%~40%在病程后期出现恶性胸腔积液[1-2]。肺癌伴恶性胸腔积液患者预期寿命短,对该类患者临床通常采用胸腔引流术,然后胸腔内注射如博来霉素、顺铂等化疗药物或其他免疫药物治疗,可使患者的胸膜粘连,胸膜腔消失,阻止恶性胸腔积液的复发[3-5];但此种方法具有显著的血液学毒性和消化道不适症状,患者生活质量较差,且反复多次引流穿刺,容易引起多房型包裹性积液,30 d后复发率高[6]。包玉花[7]通过分析宣肺逐饮方组成药物的药理学发现,该饮方中的猪苓等可以通过下调肿瘤细胞免疫抑制来控制肺癌细胞,抑制肾小球重吸收,从而减少肺癌患者体内的胸腔积液量,增强机体免疫功能,并可缓解患者咳嗽、喘息等临床症状,起到治疗肺癌伴恶性胸腔积液的作用。目前对宣肺逐饮方作用的分子机制未见报道,本研究通过观察宣肺逐饮方对肺癌恶性胸腔积液小鼠模型胸膜粘连、细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)1/2通路及水通道蛋白(aquaporins, AQP)4表达的影响,旨在探讨其对肺癌恶性胸腔积液的治疗作用和分子机制。现报告如下。
1 材料与方法
1.1实验动物 雄性C57BL/6小鼠50只,6~8周龄,体重20~25 g,由安徽医科大学实验动物中心提供,实验动物生产许可证号:SCXK(皖)2018-0004,实验动物使用许可证号:SYXK(皖)2018-0026,动物质量合格证号:2019-0097,并在无特定病原体的动物房中饲养。实验方案经由安徽医科大学动物保护委员会批准,符合美国国立卫生研究院(NIH)的实验动物饲养和管理指南。
1.2药品、试剂与仪器
1.2.1药品:顺铂注射液(江苏豪森药业股份有限公司,批号181104);宣肺逐饮方(葶苈子30 g、猪苓30 g、龙葵25 g、半枝莲25 g、防己15 g、泽兰15 g、白术15 g、大枣15 g、薏苡仁10 g、茯苓10 g、黄芪10 g、桂枝6 g、炙甘草6 g)由本院中药房提供。具体方法:在水中浸泡1 h,水煎30 min,煎煮2次,过滤后去渣,置于旋转蒸发仪中浓缩,生药终浓度分别为1.2、2.4 mg/ml,高压灭菌后储存备用。
1.2.2试剂:小鼠Lewis肺癌细胞(中国科学院细胞库,批号:20181027);伊文思蓝染料、磷酸盐(PBS)缓冲液(北京索莱宝科技有限公司,批号:181117、180921);M-MLV反转录酶、SYBR Green PCR试剂盒[宝日医生物技术(北京)有限公司,批号:MR0024K、MR1027M];TRIzol试剂、RIPA裂解液(碧云天生物技术研究所,批号:P1019R、P0013B);兔抗ERK1/2、AQP4多克隆抗体、兔抗β-actin多克隆抗体、生物素标记山羊抗兔IgG二抗均购自美国Sigma公司,批号:S8044、S8013、S8534、S9025;DAB显色试剂盒(北京中杉生物技术有限公司,批号:181229)。
1.2.3仪器:SYD-K4080型全自动病理冰冻切片机(深圳市汇沃科技有限公司);AGT9601 PCR扩增仪(美国Thermo公司);EVOS M5000倒置显微镜(日本奥林巴斯公司);invitrogen凝胶成像仪、BIO-RAD垂直电泳仪、ABI Prism 7500型荧光定量PCR仪(美国UVP公司、BD公司、ABI公司);西门子SENSA-TION 16层螺旋CT机(德国Siemens公司)。
1.3方法
1.3.1小鼠Lewis肺癌细胞培养:将Lewis肺癌细胞放在含有10% PBS、青霉素100 U/ml、链霉素100 μg/ml的DMEM培养基,37℃、5% CO2条件下温育,每隔1天将处于对数生长期的小鼠Lewis肺癌细胞进行传代,以0.02% EDTA、0.25%胰蛋白酶消化对数生长期良好的细胞2 min,用Hank's平衡盐溶液洗涤后将细胞重悬于DMEM培养基,配置成终浓度为5.0×106cell/ml细胞用于实验。
1.3.2分组、造模及给药方法:将50只小鼠随机分为对照组、模型组、顺铂组和宣肺逐饮方低、高剂量组,每组10只。对照组无任何处理,其余4组小鼠用乙醚麻醉后,对右侧胸壁的皮肤进行消毒处理,在胸骨柄右侧行长约5 mm的纵行切口,在不损伤肋间肌的前提下,通过胸膜注射0.2 ml的Lewis肺癌细胞悬浮液,针刺深度3~5 mm,避免刺穿内脏胸膜或肺,注射后缝合切口。Lewis肺癌细胞注射后3 d,顺铂组给予顺铂注射液5 mg/kg(预实验求出顺铂对肺癌恶性胸腔积液模型小鼠的半数致死浓度为10 mg/kg,以5 mg/kg 为有效剂量)腹腔注射。按照参考文献[7]的方法,预实验求出宣肺逐饮方对肺癌恶性胸腔积液模型小鼠的半数致死浓度为48 mg/kg,以24、12 mg/kg为高、低剂量,生药终浓度分别为1.2、2.4 mg/ml,灌胃体积10 ml/kg,因此宣肺逐饮方低、高组分别给予灌胃宣肺逐饮方12、24 mg/kg,1/d。对照组和模型组给予生理盐水10 ml/kg灌胃,1/d。在Lewis肺癌细胞注射后14 d,CT检查示肺窗和纵隔出现均匀密度阴影;处死小鼠后观察到大量的胸腔积液和分散在整个顶叶、胸膜及纵隔表面的转移性结节时表明成功建立肺癌伴恶性胸腔积液模型。
1.4标本采集与检测
1.4.1胸腔积液量:Lewis肺癌细胞注射14 d,断头处死小鼠,用注射器抽取胸腔积液,观察积液外观并记录容积。
1.4.2胸膜粘连检查:处死小鼠后,快速取右肺组织,用10%福尔马林在PBS缓冲盐水中固定24 h,随后用自来水洗涤,在乙醇中脱水并包埋在石蜡中,切成约4 μm厚的切片,用HE染色光镜下观察组织结构和病变特点。
1.4.3ERK1/2和AQP4 mRNA表达水平:采用PCR进行,按照制造商的规程以TRIzol试剂提取总RNA,使用M-MLV反转录酶产生第一链cDNA;使用SYBR Green PCR试剂盒在ABI Prism 7500型荧光定量仪上进行qRT-PCR。引物序列如下:①ERK1/2:5'-GGAAAGAAAAGTTGAATC-3'(正向),5'-TTCCTGTGGGCGGATTAG-3'(反向)。②AQP4:5'-GGTAGTGTTGTACTGGGCCAAT-3'(正向),5'- CCTGGTGCCCGTTGG GTTGTGGAAAT(反向)。③β-肌动蛋白:5'- AATACCTCAGCCTCCAGCAGATG-3'(正向),5'-AGAGAAGTGGGGTGGCTTTT-3'(反向)。
1.4.4ERK1/2和AQP4蛋白表达水平:采用蛋白免疫印迹法(Western-Blot)检测。将肺组织在含有1%苯甲基磺酰氟的RIPA裂解液中匀浆,匀浆后取上清液,通过聚丙烯酰胺凝胶电泳分离等量的蛋白质,转移到聚偏二氟乙烯膜上,并在4℃下与ERK1/2一抗(1∶500)和AQP4一抗(1∶1500)孵育过夜,洗涤后,避光将膜与生物素标记二抗(1∶1000)一起温育2 h;二抗孵育后显色、曝光、显影;并以β-actin 为内参计算相对光密度值(ROD)。
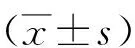
2 结果
2.1胸腔积液量比较 5组小鼠胸腔积液量分别为:对照组(1.85±0.31)ml、模型组(3.62±0.41)ml、顺铂组(2.27±0.35)ml、宣肺逐饮方低、高剂量组(2.98±0.35)ml、(2.30±0.41)ml。模型组胸腔积液量显著多于对照组(P<0.05);与模型组相比,顺铂组和宣肺逐饮方高、低剂量组胸腔积液量显著减少,且宣肺逐饮方低剂量组胸腔积液量多于顺铂组(P<0.05),宣肺逐饮方高剂量组胸腔积液量与顺铂组比较差异无统计学意义(P>0.05)。
2.2胸膜粘连情况比较 对照组小鼠胸膜结构正常。模型组小鼠胸膜粘连、增厚明显,结缔组织异常增生,脏层和壁层胸膜被覆的单层扁平间皮细胞转为复层上皮细胞。宣肺逐饮方低剂量组小鼠仍可见明显胸膜粘连、增厚,脏层和壁层胸膜的复层上皮细胞覆盖较模型组略微减轻。顺铂组和宣肺逐饮方高剂量组小鼠胸膜粘连、增厚情况明显轻于模型组,胸膜的单层扁平间皮细胞有少量转化为单层立方上皮细胞。
2.3肺ERK1/2和AQP4 mRNA表达水平比较 与对照组比较,模型组肺ERK1/2和AQP4 mRNA表达水平增多(P<0.05);与模型组比较,顺铂组和宣肺逐饮方低、高剂量组肺ERK1/2和AQP4 mRNA表达水平显著减少,但宣肺逐饮方低剂量组多于顺铂组和高剂量组(P<0.05)。宣肺逐饮方高剂量组肺ERK1/2和AQP4 mRNA表达水平与顺铂组比较差异无统计学意义(P>0.05)。见表1。

表1 5组小鼠肺组织ERK1/2和AQP4 mRNA表达水平比较
2.4肺ERK1/2和AQP4相对蛋白表达水平比较 与对照组比较,模型组肺ERK1/2和AQP4 相对蛋白表达水平增多(P<0.05);与模型组比较,顺铂组和宣肺逐饮方低、高剂量组肺ERK1/2和AQP4相对蛋白表达水平显著减少;且宣肺逐饮方低剂量组肺ERK1/2和AQP4相对蛋白表达水平多于顺铂组和高剂量组(P<0.05)。宣肺逐饮方高剂量组肺ERK1/2和AQP4相对蛋白表达水平与顺铂组比较差异无统计学意义(P>0.05)。见表2、图1。

表2 5组小鼠肺ERK1/2和AQP4相对蛋白表达水平比较
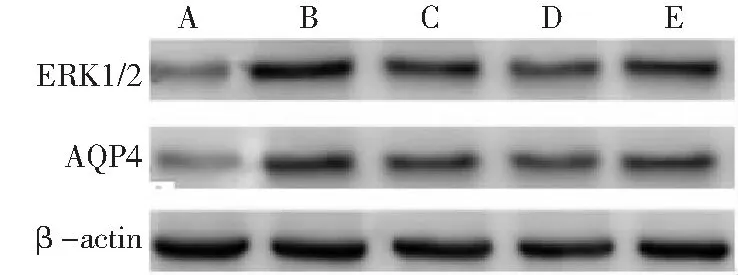
图1 5组小鼠肺ERK1/2、AQP4相对蛋白表达水平A.对照组;B.模型组;C.顺铂组;D.宣肺逐饮方低剂量组;E.宣肺逐饮方高剂量组;ERK为细胞外信号调节激酶,AQP4为水通道蛋白4
3 讨论
25%~30%的肺癌患者因胸膜转移而出现恶性胸腔积液,严重影响了其生活质量,使生存期缩短[8-10]。宣肺逐饮方具有发汗、利水、攻逐的功效并能兼顾健脾不伤正。现代药理学研究认为,宣肺逐饮方可以在免疫调节、利尿、止咳平喘和控制肺癌细胞等方面发挥作用。研究表明,宣肺逐饮方可以通过剂量依赖性方式抑制G2/M细胞周期阻滞,从而抑制肺癌细胞A549的增殖。用宣肺消水方式处理肺癌伴恶性胸腔积液小鼠模型,可将小鼠血性的胸腔积液颜色转换为浅黄色,表明宣肺消水具有抗血管生成的作用[11]。宣肺逐饮方中的葶苈子可以抑制实体瘤中的血管密度并破坏血管壁结构,通过抑制血管生成而对肺癌伴恶性胸腔积液患者发挥作用[12]。本研究将Lewis肺癌细胞注入C57BL/6小鼠的胸膜,建立肺癌恶性胸腔积液模型,在模型建立后的第14天进行胸部CT扫描发现模型组中存在胸腔积液,提示建模成功。本研究结果显示,宣肺逐饮方低剂量组胸膜明显粘连、增厚,脏层和壁层胸膜的复层上皮细胞覆盖较模型组略微减轻;顺铂组和宣肺逐饮方高剂量组胸膜粘连、增厚情况明显轻于模型组,胸膜的单层扁平间皮细胞有少量转化为单层立方上皮细胞。这说明逐饮方可能是一种较为理想的姑息治疗中药。本研究结果同时显示,与对照组比较,模型组胸腔积液量显著增多;与模型组比较,顺铂组和宣肺逐饮方低、高剂量组胸腔积液量显著减少;宣肺逐饮方低剂量组胸腔积液量多于顺铂组,但宣肺逐饮方高剂量组胸腔积液量与顺铂组比较差异无统计学意义。这与既往研究结果一致[10-13],说明宣肺逐饮方能显著减少肺癌伴恶性胸腔积液小鼠模型胸腔积液量,且高剂量宣肺逐饮方疗效与顺铂相近。
ERK1/2可促进肿瘤坏死因子-α(TNF-α)表达,而ERK1/2诱导的TNF-α激活可以上调血管内皮生长因子(VEGF)的表达。VEGF能够促进肿瘤血管生成并增加血管通透性,从而导致肺癌伴恶性胸腔积液的发展[14-16]。AQP4是肺部主要的水通道蛋白,也是重要的抑癌因子,降低AQP4在壁层胸膜中的表达,可促进胸腔积液吸收,减少胸腔积液过度过滤,进而消除积液[17]。ERK1/2通路作为AQP4上游分子在星形胶质细胞上直接调控其表达,在脑出血模型和原代星形胶质细胞中证实通过ERK1/2通路可上调AQP4表达,影响脑水肿,抑制ERK1/2途径的激活,降低AQP4蛋白表达,是改善机体水液代谢的重要策略。研究证实,顺铂可影响ERK1/2、AQP4的表达[18-21]。本实验以顺铂为阳性对照,结果显示,与对照组比较,模型组肺组织ERK1/2和AQP4 mRNA、ERK1/2和AQP4相对蛋白表达水平增多;与模型组比较,顺铂组和宣肺逐饮方低、高剂量组肺ERK1/2和AQP4 mRNA、ERK1/2和AQP4相对蛋白表达水平显著减少;宣肺逐饮方低剂量组肺ERK1/2和AQP4 mRNA、ERK1/2和AQP4相对蛋白表达水平多于顺铂组,宣肺逐饮方高剂量组肺ERK1/2和AQP4 mRNA、ERK1/2和AQP4 相对蛋白表达水平与顺铂组相近。提示宣肺逐饮方可能通过抑制ERK1/2信号通路的激活,来下调AQP4表达,从而达到治疗肺癌恶性胸腔积液的目的。
综上所述,宣肺逐饮方能显著减少肺癌恶性胸腔积液模型小鼠的积液量,改善小鼠胸膜的粘连,减少小鼠肺组织中ERK1/2和AQP4 mRNA、ERK1/2和AQP4相对蛋白表达水平。本研究为宣肺逐饮方临床用于肺癌恶性胸腔积液的治疗提供了实验依据,其作用的分子机制可能与抑制ERK1/2途径的激活,降低AQP4表达有关。

