海南红树林淡紫拟青霉胞外多糖抗HSV-1作用研究
王永霞,王娇娇,黄燕妮,林英姿
单纯疱疹病毒 (herpes simplex virus, HSV)属于疱疹病毒科a亚科,在人群中感染极为普遍,潜伏和复发感染者可达90%[1],可通过皮肤、黏膜直接接触感染机体,引起的疱疹性角膜炎致盲率较高,未经治疗的病毒性脑炎病死率可达80%,存活者亦可因中枢神经系统损伤留有智力、语言、行动障碍等不同程度后遗症[2-4]。课题组前期从海南红树林中分离获得一株淡紫拟青霉,体外研究发现其分泌的胞外多糖具有一定的抗HSV-1作用,可抑制病毒吸附和生物合成[5],但体内抗病毒效果未知。本研究拟腹腔注射HSV-1建立小鼠感染模型,观察淡紫拟青霉胞外多糖体内抗病毒作用。
1 材料与方法
1.1实验动物及试剂、仪器
1.1.1实验动物:7周龄SPF级健康昆明种雄性小鼠75只,体重18~22 g,购于长沙市天勤生物技术有限公司,实验动物许可证号:SCXK(湘)2014-0011。
1.1.2实验试剂:淡紫拟青霉胞外多糖由本实验室制备;非洲绿猴肾细胞(vero cell line, Vero细胞)购于中科院干细胞库(SCSP-520、CCL-81TM)。HSV-1病毒液由本实验室保存。小鼠干扰素-γ(IFN-γ)、白介素-12(IL-12)和肿瘤坏死因子-α(TNF-α)ELISA 试剂盒均购于深圳欣博盛生物科技有限公司;病毒基因组DNA/RNA快速提取试剂盒升级版(离心柱型)购于北京百泰克生物技术有限公司,HSV-1阳性模板购于武汉百泰基因工程有限公司(注册号:国械注准20173400732)。
1.1.3实验仪器:生物安全柜(SG403A-HE)购于Baker公司,CO2培养箱[(MCO-18AC)松下电器有限公司],超声波细胞粉碎机(SCIENTZ-950E)和高通量组织研磨器(宁波新芝生物科技有限公司),AE2000倒置生物显微镜(上海光学仪器厂),高速冷冻离心机(美国Beckman公司),PCR仪(Biometra GmbH公司),酶标分析仪[(DNM-9606),北京普朗新技术有限公司],全自动凝胶成像分析仪[(JY04S-3E),北京君意东方电泳设备有限公司)]。
1.2方法
1.2.1病毒滴定:HSV-1于Vero细胞中传代2次后接种于已长成单层的Vero细胞中,观察48~72 h内的细胞病变情况(cytopathic effect, CPE),当CPE达“+++~++++”时收获病毒,按Reed -Muench法滴定其半数组织感染量(50 % tissue culture infective dose, TCID50)为10-4,拟用100TCID50浓度病毒感染小鼠。
1.2.2小鼠HSV-1感染模型建立:7周龄昆明种小鼠随机分为正常对照组,病毒对照组,低、中、高剂量组,每组15只。低、中、高剂量组和病毒对照组小鼠分别给予HSV-1 0.5 ml腹腔注射,正常对照组小鼠给予DMEM 0.5 ml腹腔注射。次日低、中、高剂量组小鼠分别经腹腔注射淡紫拟青霉胞外多糖6、8、10 g/(kg·d);正常对照组和病毒对照组腹腔注射生理盐水0.5 ml,连续注射7 d。每日观察并记录小鼠的进食情况、有无倦怠、竖毛、蜷缩及死亡等。淡紫拟青霉胞外多糖干预结束后第3天,各组小鼠眼球取血,分离血清置于-20℃备用。处死小鼠,无菌条件下取肝脏,部分置于10%多聚甲醛中固定,常规制作石蜡切片进行HE染色,镜下观察肝脏病理变化。
1.2.3脑组织匀浆致Vero细胞病变作用:取各组小鼠同一部位脑组织20 mg,预冷PBS冲洗后,再于各管中加PBS 0.3 ml,组织研磨器研磨成匀浆,超声破碎仪破细胞,12 000 r/min离心15 min,收集上清液,取该上清液100 μl与2 ml含5%胎牛血清的DMEM混匀后,接种于已长成单层的Vero细胞中,观察7 d内细胞病变情况。
1.2.4脑组织病毒载量检测:另取各组小鼠同一部位的脑组织20 mg,加预冷PBS液0.5 ml,组织研磨器研磨成匀浆,12 000 r/min离心15 min。沉淀用HSV-1核酸检测试剂盒提取病毒基因组DNA。HSV-1UL36基因引物据根据参考文献[6],序列如下,UL36F:5'-TAC GTC CTC ACC GTC ATC AAC-3',UL36R:5'-CGC CAA AAG GTG TAA ATG TG -3';反应体系为:Taq PCR MasterMix 11.25 μl,病毒基因组DNA或阳性对照模板DNA 1 μl,上下游引物各0.5 μl,ddH2O 6.75 μl,反应条件为:94℃ 5 min,94℃ 60 s,53℃ 40 s,72℃ 40 s,72℃ 7 min,共30个循环。取PCR产物6 μl进行1%琼脂糖凝胶电泳,紫外凝胶成像仪观察结果。通过Gel-Pro Analyzer图像分析软件分析产物电泳条带的光密度扫描值,将实验组与阳性模板UL36条带光密度扫描值的比值作为UL36基因相对含量。
1.2.5血清中IFN-γ、IL-12和TNF-α分泌情况:采用ELISA法,试剂盒用前平衡至室温,检测方法按试剂盒说明书进行,酶标仪于波长450 nm处测定OD值,绘制标准曲线,根据各样品OD值计算其细胞因子含量。
2 结果
2.1生存情况 除正常对照组外,其余4组小鼠接种HSV-1后次日出现食欲减退、竖毛、倦怠、蜷缩等症状,3~4 d达高峰。各组间小鼠死亡率比较差异无统计学意义(P>0.05)。见表1。各组未死亡小鼠于1周后症状开始缓解,胞外多糖干预组小鼠2周内完全缓解,而病毒对照组小鼠症状缓解较为缓慢,延迟至第3周。
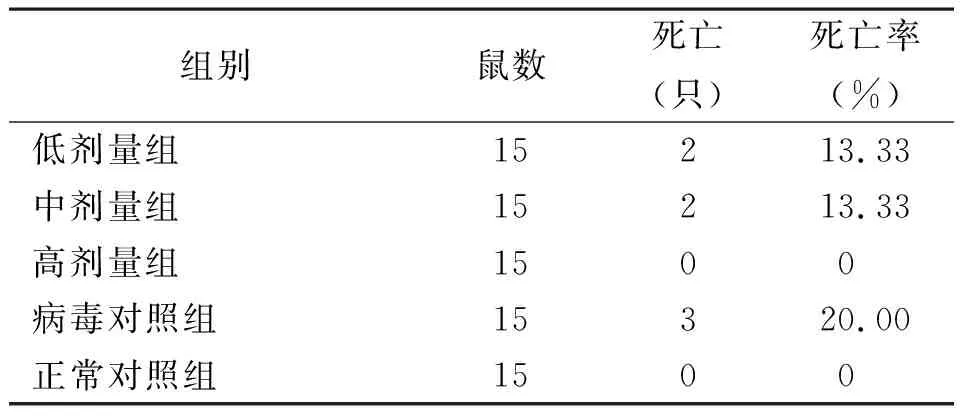
表1 5组小鼠死亡情况比较
2.2肝脏病理变化 正常对照组小鼠肝小叶结构完整,细胞形态正常,以中央静脉为中心呈放射状排列;病毒对照组小鼠部分肝细胞肿胀,汇管区见大量炎性细胞浸润,肝实质内有少量炎性细胞;低剂量组亦见肝组织中有大量炎性细胞浸润,少数肝细胞肿胀;中剂量组肝组织内炎性细胞浸润明显减少;高剂量组肝实质内仅有少量炎性细胞浸润,肝小叶结构完整。见图1。
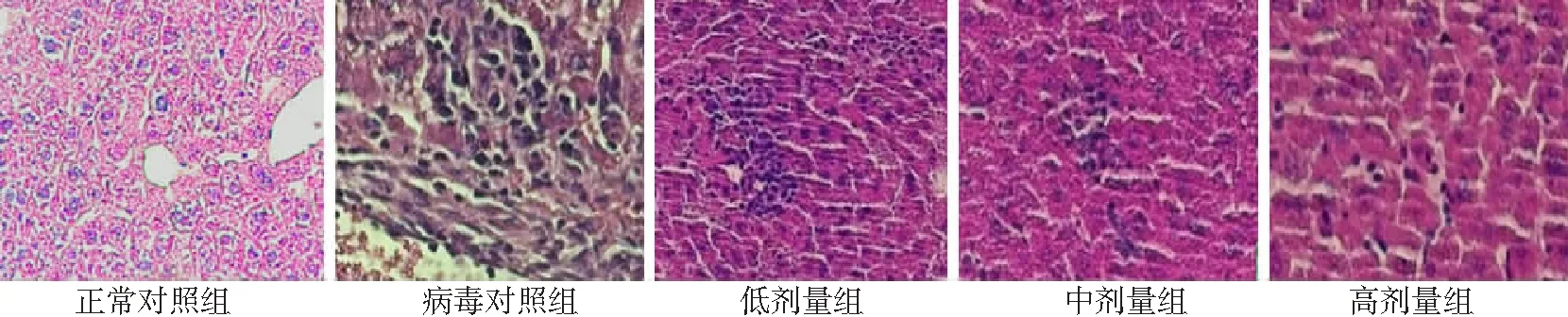
图1 5组小鼠肝脏结构病理改变(HE×200)低、中、高剂量组小鼠分别给予淡紫拟青霉胞外多糖6、8、10 g/(kg·d)
2.3脑组织匀浆上清液致Vero细胞病变比较 HSV-1接种次日,病毒对照组和低剂量组少数细胞脱落、融合;正常对照组和中、高剂量组细胞病变不明显。接种第3天病毒对照组和低剂量组细胞脱落明显增多,融合细胞亦增多;中剂量和高剂量组少量细胞开始脱落、融合,但所致细胞病变作用明显弱于病毒对照组和低剂量组,正常对照组未发现细胞病变。各组细胞病变于接种4~5 d达高峰。见图2。

图2 5组小鼠脑组织匀浆上清液Vero细胞形态(×100)低、中、高剂量组小鼠分别给予淡紫拟青霉胞外多糖6、8、10 g/(kg·d);Vero为非洲绿猴肾细胞
2.4脑组织HSV-1病毒载量比较 病毒对照组HSV-1病毒DNA相对含量为0.505±0.025,低、中、高剂量组分别为0.496±0.055、0.248±0.034、0.262±0.033。与病毒对照组相比,中、高剂量组HSV-1病毒DNA相对含量明显减低(P<0.01),但低剂量组与病毒对照组比较差异无统计学意义(P>0.05)。见图3。
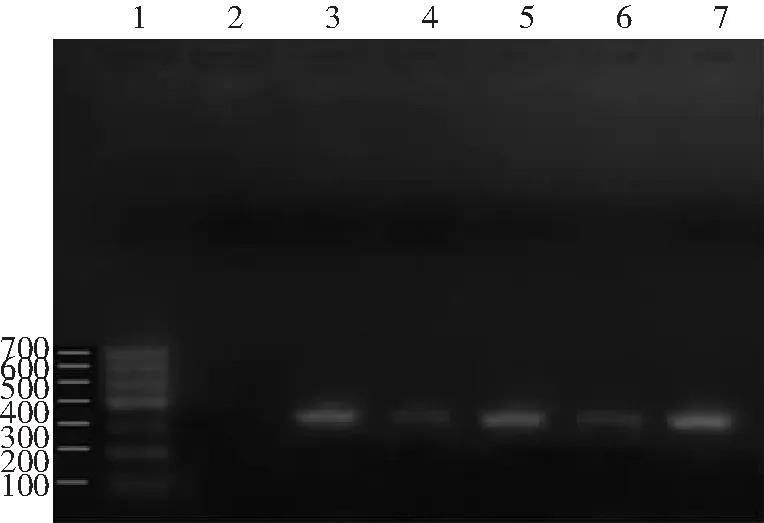
图3 5组小鼠脑组织HSV-1病毒载量比较1. Marker;2.正常对照组;3.低剂量组;4.中剂量组;5.病毒对照组;6高剂量组;7.阳性模板;低、中、高剂量组分别给予淡紫拟青霉胞外多糖6、8、10 g/(kg·d);HSV-1为单纯疱疹病毒-1
2.5血清IFN-γ、IL-12、TNF-α含量比较 与正常对照组比较,病毒对照组和低、中、高剂量组血清IFN-γ、IL-12、TNF-α水平显著升高(P<0.01)。高剂量组IFN-γ高于病毒对照组和低、中剂量组(P<0.01),但病毒对照组和低、中剂量组比较差异无统计学意义(P>0.05)。中、高剂量组IL-12显著高于病毒对照组和低剂量组(P<0.01),但病毒对照组和低剂量组比较差异无统计学意义(P>0.05)。与病毒对照组比较,低、中、高剂量组TNF-α水平显著降低,且高剂量组和中剂量组均低于低剂量组(P<0.01)。见表2。

表2 5组小鼠血清IFN -γ、IL-12和TNF-α水平比较
3 讨论
多糖类化合物作为重要的生物活性物质,广泛参与了生物体内细胞识别和功能调控,作用涉及细胞生命的全部时间和空间,多糖已被证实参与了病原体感染,糖链决定着细胞识别、聚集和受体作用,寄生物或病毒表面的寡糖能与宿主细胞表面的受体作用,产生感染。研究发现,真菌多糖能活化巨噬细胞和T、B淋巴细胞,诱导IFN-γ、IL-12和TNF-α等细胞因子分泌,调节固有免疫和适应性免疫[7-9]。海洋生物由于独特的生活环境导致其产生的生物活性物质有别于陆生生物。本研究结果显示,腹腔接种HSV-1后次日大部分小鼠出现食欲减退、竖毛、倦怠、蜷缩等症状,3~4 d达高峰,淡紫拟青霉胞外多糖干预组小鼠症状缓解较病毒对照组提前,但各组间死亡率比较差异无统计学意义。本研究结果显示,与正常对照组比较,病毒对照组部分肝细胞肿胀,汇管区大量炎性细胞浸润,肝实质内少量炎性细胞浸润;低剂量组亦见肝组织中有大量炎性细胞浸润;中剂量组炎性细胞浸润明显减少;高剂量组肝实质内仅有少量炎性细胞浸润,肝小叶病变不明显。说明淡紫拟青霉胞外多糖可缓解HSV-1感染所致的肝脏病理改变且该作用呈剂量依赖性。
将各组小鼠脑组织匀浆上清液接种于Vero细胞,发现中剂量和高剂量组较病毒对照组和低剂量组致细胞病变作用明显减轻,说明淡紫拟青霉胞外多糖可能抑制了HSV-1在脑组织中的复制。本研究检测了各组小鼠同一部位脑组织的HSV-1病毒DNA相对含量,结果显示中、高剂量组HSV-1相对含量显著低于病毒对照组,低剂量组HSV-1病毒DNA相对含量与病毒对照组比较差异无统计学意义。提示中剂量和高剂量淡紫拟青霉胞外多糖对HSV-1病毒的抑制作用较好,而低剂量对HSV-1病毒无明显抑制作用;说明淡紫拟青霉胞外多糖对HSV-1病毒的抑制作用呈现一定的剂量依赖性。
IFN-γ作为重要的Th1型细胞因子可刺激病毒感染细胞表达MHC-1类分子、激活巨噬细胞、NK细胞等免疫细胞,参与抗病毒免疫;另外IFN-γ还可干扰病毒复制、抑制B细胞的功能[10-11]。IL-12作为重要的免疫调节因子,可刺激IFN -γ分泌,诱导Th1型抗病毒免疫反应[12-13]。TNF-α在HSV-1感染中具有一定的抗病毒作用,同时也参与了继发性免疫损伤[14-15]。本研究结果显示,病毒对照组小鼠血清IFN-γ、IL-12和TNF-α水平均显著高于正常对照组。高剂量组IFN-γ高于病毒对照组和低、中剂量组;中、高剂量组IL-12显著高于病毒对照组和低剂量组。与病毒对照组比较,低、中、高剂量组TNF-α水平显著降低,且高剂量组低于中、低剂量组,中剂量组低于低剂量组。说明不同剂量淡紫拟青霉胞外多糖均不能对TNF-α分泌完全抑制,TNF-α的持续增高提示预后不良。
综上所述,红树林淡紫拟青霉胞外多糖可能通过刺激IFN-γ和IL-12、抑制TNF-α分泌达到抗病毒的目的,也可能通过早期干预病毒复制,减少病毒载量,间接影响了细胞因子分泌,从而减轻了HSV-1感染后的免疫病理损伤。然而淡紫拟青霉胞外多糖的作用机制如何,作用靶点在哪,仍需进一步研究。

