米曲霉固态发酵产蛋白酶酶解虾头工艺探究
王振猛,江晓,孙建安*,毛相朝
(1. 中国海洋大学食品科学与工程学院, 山东 青岛 266003; 2. 青岛滨海学院医学院, 山东 青岛 266500)
随着中国经济的进步,捕捞业和水产养殖业不断发展,虾类产品的市场十分庞大,市场需求量呈逐渐上升趋势。中国虾类产品种类主要是虾仁或者冷冻虾,而在虾类产品的加工过程中会产生大量虾头、虾壳等副产物,几乎占到原材料质量的45%~60%[1]。这些副产物富含蛋白质、甲壳素和虾青素等营养成分[2],并富含不饱和脂肪酸、类胡萝卜素以及人体必需微量元素等营养物质[3]。
目前,这些副产物大多被直接丢弃,不仅浪费了宝贵的资源,还易造成环境污染。由于虾头营养价值十分丰富,目前许多国家正在着手开发这一优良的资源,如将虾副产物通过酶解发酵等方法制成虾调味品[4],或从虾头中提取甲壳素、虾青素等具有生物活性的物质,也可将之用于生产水产饲料和生物肥料等[5]。因此,将这些虾副产物转化为有用的产品对于对虾产业的可持续发展至关重要。目前对虾头的加工利用多采用化学酸碱法,但环境危害大,不符合绿色生产要求[6]。另一种加工方式是采用市售蛋白酶酶解虾头,但是酶对蛋白的降解有选择性,不同市售酶对不同虾头的水解程度不同,并且价格昂贵,不利于大规模加工利用[7]。
米曲霉(Aspergillusoryzae)是目前微生物发酵产蛋白酶最重要的菌株,其基因组中有135个胞外蛋白酶基因[8]。米曲霉的胞外蛋白酶系非常复杂[9],主要通过顶端分泌的方式分泌至胞外[10-11]。米曲霉发酵过程中不产生毒素,是分解各类蛋白用于饲料加工、生物肥料生产及食品加工等领域的最佳选择。米曲霉产生的蛋白酶包括酸性蛋白酶、中性蛋白酶和碱性蛋白酶,由于在发酵期间不同蛋白酶之间交替发生作用,能够赋予产品独特的风味,因此,米曲霉目前在食品行业主要用于发酵分解大豆蛋白酿造酱油[12],赋予酱油独特风味[13]。Su等[14]研究发现,米曲霉蛋白酶粗提物水解脱脂大豆的能力优于碱性蛋白酶、复合蛋白酶和木瓜蛋白酶等商业蛋白酶。米曲霉产酶活力的高低影响到原料利用率及产品品质,提高米曲霉产蛋白酶活力不仅可以提高原料利用率,而且可减少酿造工业的污染,对于实际生产具有十分重要的作用[15]。
为实现阿根廷红虾(Pleoticusmuelleri)虾头的绿色高值化利用,本研究利用米曲霉固态发酵所产的蛋白酶酶解虾头,脱掉蛋白质,以制备蛋白液与甲壳素。此工艺避免了环境污染,降低了生产成本,且米曲霉安全性高,酶解液可用于生物饲料的开发利用,从而实现虾头的全面综合利用。
1 材料与方法
1.1 原料与试剂
马铃薯、麸皮和豆粕,购于青岛市市南区农贸市场。阿根廷红虾虾头购于青岛市盛隆伟业科技有限公司,储存在-20 ℃条件下。米曲霉由青岛灯塔酿造有限公司提供,保藏在-80 ℃条件下20%甘油中,该菌在PDA培养基上于30 ℃下活化2 d,用无菌水将孢子刮下,得到孢子悬浮液。
PDA培养基:称取去皮马铃薯200 g,切成小块,加1 000 mL蒸馏水煮沸30 min,用双层纱布滤成清液。加入20 g葡萄糖至完全溶解,然后加蒸馏水至1 L, 自然pH(约7.5),121 ℃灭菌20 min。固体培养基加入琼脂粉20 g。
1.2 仪器与设备
主要包括:匀浆机(九阳股份有限公司,JYL-C022E);BCM-1000型超净台(苏州净化设备有限公司);SPX生化培养箱(新江南仪器有限公司);水浴锅(常州智博瑞仪仪器公司,HH-3A);pH计(上海精科仪器有限公司,PHS-2F);恒温水浴摇床(常州万顺仪器公司,SHZ-88)。
1.3 指标测定
蛋白酶活力的测定采用福林酚法,具体步骤参照GB/T 23527—2009。将一个酶活力单位(U)定义为:在特定的条件下,每分钟产生1 μg酪氨酸所需要的酶量。氨基态氮的测定采用甲醛滴定法[16]。可溶性蛋白的测定采用双缩脲法[17]:取3.0 mL样品溶液置于一试管中,先加入双缩脲A试剂1.0 mL,再加入双缩脲B试剂1.0 mL,于漩涡混合仪上混合均匀,静置10 min,4 000 r/min离心10 min,取上清液于540 nm下测定OD值,对照标准曲线求得样品溶液中的可溶性蛋白浓度(mg/mL)。
1.4 米曲霉固态发酵产蛋白酶工艺条件的优化
麸皮和豆粕为常见的米曲霉培养基构成成分,能够满足米曲霉生长繁殖所需的碳源和氮源。麸皮和豆粕的不同配比对米曲霉固态发酵产蛋白酶有较大的影响。将不同配比的含水量均为60%的培养基(1号:麸皮10 g;2号:麸皮8 g+豆粕2 g;3号:麸皮6 g+豆粕4 g;4号:麸皮5 g+豆粕5 g;5号:麸皮4 g+豆粕6 g;6号:麸皮2 g+豆粕8 g;7号:豆粕10 g)灭菌后搅拌均匀,以10%的接种量接入米曲霉孢子悬浮液(孢子含量107个/mL)。30 ℃静置培养3 d,之后向培养基中加入100 mL水,30 ℃、200 r/min条件下振荡3 h,浸提蛋白酶,取上清液离心测定蛋白酶酶活。考察培养基组成对米曲霉固态发酵产蛋白酶活力的影响。
在最佳培养基的基础上,培养基含水量分别调整为20%、30%、40%、50%、60%和70%,其他条件不变,考察培养基含水量对米曲霉固态发酵产蛋白酶的影响。在最佳培养基和最佳含水量的基础上,培养温度分别调整为25、30、35、40和45 ℃,考察培养温度对米曲霉固态发酵产蛋白酶的影响。在已优化的工艺条件基础上,分别以1%、2%、4%、6%、8%和10%的接种量接入米曲霉孢子悬浮液,考察接种量对米曲霉固态发酵产蛋白酶的影响。在上述最佳条件基础上,培养时间调整为24、36、48、60、72、84和96 h,浸提蛋白酶,取上清液离心测定蛋白酶活,考察培养时间对米曲霉固态发酵产蛋白酶的影响。在上述最佳条件下培养之后,浸提时间分别为1、2、3、4、5和6 h,考察浸提时间对米曲霉固态发酵所产蛋白酶浸出效果的影响。
1.5 响应面优化实验
根据单因素实验结果,发现培养温度、含水量和培养时间对米曲霉固态发酵产蛋白酶具有显著影响,因此采用 Design-Expert 8.0.6.1 软件,按照 Box-Benken设计原理,选取培养温度、含水量和培养时间三因素,以蛋白酶活力作为响应函数,进行三因素三水平的响应面实验,通过响应曲面分析得出自变量与响应函数之间的统计模型,确定米曲霉固态发酵产蛋白酶的最佳工艺条件,实验因素水平编码如表1所示。

表1 因素水平表Tab.1 Factors and levels in Box-Behnken
1.6 米曲霉所产蛋白酶酶解虾头工艺条件的优化
最佳酶解温度的确定:称取10 g匀浆后的虾头,按料液比1∶4加入米曲霉固态发酵所产的蛋白酶液混匀,自然pH下,酶解温度分别设置为30、35、40、45和50 ℃,酶解5 h,测定酶解液中氨基态氮和可溶性蛋白的含量。
最佳酶解pH的确定:在最佳温度的基础上,使用HCl和NaOH调节体系pH为6.0、6.5、7.0、7.5(自然pH)和8.0,酶解5 h,测定酶解液中氨基态氮和可溶性蛋白的含量。
最佳酶解时间的确定:在最佳pH、最佳温度下分别酶解2、3、4、5、6和7 h,测定酶解液中氨基态氮和可溶性蛋白的含量。
1.7 虾头酶解液的风味成分分析
1.7.1 挥发性成分分析
目前,固相微萃取技术是应用最为广泛的萃取挥发性物质的方法,其主要是利用萃取头上的萃取纤维对挥发性物质进行吸附。实验选用50/30 μm Car/PDMS/DVB萃取纤维头对样品进行吸附提取,具体操作如下:准确移取10 mL样品装入20 mL顶空萃取瓶中,放入转子,同时加入1.5 g NaCl,盖上瓶盖,轻轻混匀,设置磁力搅拌转数150 r/min,60 ℃水浴锅中保持10 min,将固相微萃取纤维插入瓶中,调节萃取纤维与液面距离,顶空吸附30 min。吸附结束后,将萃取纤维迅速转移到进样口,进行气相色谱-质谱分析,将检测到的挥发性物质与NIST02.LIB数据库比对,当且仅当匹配度大于80%时才予以采纳。
1.7.2 电子鼻分析
电子鼻(E-nose)俗称机器嗅觉,通过模拟动物和人的嗅觉功能,实现对挥发性物质的检测与鉴定。将25 mL样品溶液装入50 mL样品瓶中,密封放置于25 ℃水浴锅中保持30 min。电子鼻仪器使用前要先自清洗,当响应信号恢复到基线时,方可进行样品测定。将样品收集针头插入样品瓶中,开始收集数据,电脑记录每秒钟相对电导率比值变化,最后生成相对电导率比值曲线。设定测试参数:自清洗时间200 s,基线收集10 s,样品收集时间100 s,载气流速300 mL/min。当电导率比值信号稳定时,采用Winmuster软件对数据进行采集与处理。电子鼻传感器性能描述见表2。

表2 电子鼻传感器性能描述Tab.2 Sensor performance description in E-nose
1.7.3 电子舌分析
电子舌(E-tongue)俗称机器味觉,本实验选取TS-5000Z味觉分析系统对酶解液进行分析,该系统不仅可以分析样品的鲜、咸、酸、苦、涩和甜味,还可以客观地分析苦、涩和鲜的回味,具有很高的灵敏度。具体操作如下:清洗液中清洗90 s,参比液清洗120 s,接着用第二参比液,继续清洗,时间仍为120 s,传感器归零30 s,平衡后,取80 mL样品开始进行测定。首先进行前味测定,即将传感器放入样品中,测试时间为30 s;清洗传感器3 s,接着进行回味测定,即将传感器再次放入参比液中进行测试,时间仍为30 s。测试结束后,及时用洁净溶液清洗传感器。当电导率比值信号稳定时,采用TS-5000Z软件对数据进行采集与处理。
1.8 统计分析
每个实验重复3次。试验数据采用Origin进行单因素实验结果分析,采用Design-Expert 8.0.6.1进行响应面试验数据分析,采用SPSS 19.0进行数据的分析处理,组间差异显著性分析采用ANOVA方差分析,P<0.05为有显著差异。
2结果与分析
2.1米曲霉固态发酵产蛋白酶的单因素优化试验
2.1.1 不同固态培养基对米曲霉产蛋白酶的影响
由图1可知,随着固态培养基中豆粕含量的不断增加,米曲霉所产蛋白酶的酶活逐渐下降。麸皮和豆粕均是米曲霉生长过程中所需的碳源、氮源,麸皮质地疏松、透气性良好,而豆粕质地紧密,会影响培养基的透气性,不利于微生物的生长繁殖。当培养基中只含有麸皮时,不仅能够满足该米曲霉生长繁殖分泌蛋白酶的基本营养需求,且能保证培养基良好的透气性,因此确定米曲霉固态发酵产蛋白酶的最佳培养基为麸皮。
2.1.2 培养基含水量对米曲霉产蛋白酶的影响
水分是微生物发酵过程中生长及代谢的必要成分,适宜的初始含水量,一方面使发酵基质具有一定的水分活度,而水分活度决定了微生物的萌发时间、生长速率及死亡率,另一方面使得发酵基质的疏松度适宜,颗粒间存在一定间隙,对菌体获取营养物质及氧的传递起到重要作用。含水量过低不利于米曲霉的生长繁殖及蛋白酶的分泌,含水量过高又会导致整个固态培养体系透气性差,供氧不足。由图2可知,随着培养基含水量的增加,米曲霉所产蛋白酶酶活呈现先升高后下降的趋势,在含水量为60%时,蛋白酶活力达到最大值。因此确定米曲霉固态发酵产蛋白酶的培养基最佳含水量为60%。
2.1.3 培养温度对米曲霉产蛋白酶的影响
温度作为影响固态发酵的关键因素,首先会影响米曲霉的生长和繁殖,其次由于固态培养过程中,基质的传热性差,初始温度过高,不利于发酵热的散出,进而使发酵反应无法进行,会严重影响蛋白酶的分泌,因此温度对固态发酵的影响比较大。米曲霉在40 ℃和45 ℃时,几乎没有生长迹象,37 ℃米曲霉能够生长,但白色菌丝体较多,绿色孢子生长较少。由图3可知,培养温度在30 ℃时,米曲霉所产蛋白酶活力最高,因此确定米曲霉固态发酵产蛋白酶的培养基最佳培养温度为30 ℃。
2.1.4 接种量对米曲霉产蛋白酶的影响
由图4可知,随着米曲霉接种量由1%增加至2%,米曲霉所产蛋白酶活力有显著上升(P<0.05),之后随接种量的进一步增加,所产蛋白酶活力无明显差异(P>0.05)。推测原因,10 g麸皮的固态培养基仅仅能够满足2%的接种量时米曲霉生长繁殖所需的营养成分,当米曲霉孢子总数达到一定量时,10 g麸皮已经不能满足更多米曲霉生长繁殖所需的营养成分,因此随着接种量的增大,米曲霉所产蛋白酶活力不会继续增高。最终确定最佳接种量为2%。
2.1.5 培养时间对米曲霉产蛋白酶的影响
由图5可知,随着培养时间的延长,米曲霉所产蛋白酶活力不断升高,在36~48 h呈现快速增长的趋势;48 ~84 h呈现缓慢增长的趋势;84 h时,米曲霉所产蛋白酶活力最高;超过84 h,米曲霉所产蛋白酶活力呈现下降趋势。观察米曲霉的生长状况,在24 h,开始生长出白色菌丝体,在36 h,开始生长出绿色孢子,因此初步确定,在36 h后,开始大量分泌蛋白酶,84 h蛋白酶分泌量达到最多。
2.1.6 浸提时间对米曲霉所产蛋白酶浸出效果的影响
加水振荡是为了使米曲霉所产的蛋白酶更好的溶出,合适的浸提时间可使蛋白酶更好地完全溶出,并能节约时间成本。由图6可知,随着振荡时间的延长,蛋白酶逐渐溶出,在1 ~3 h内蛋白酶快速溶出,在3~4 h仍有少量蛋白酶继续溶出,4 h后蛋白酶活力无明显差异(P>0.05),说明蛋白酶基本全部溶出,且3 h左右蛋白酶溶出效果浮动较大,为保证蛋白酶能够完全溶出,为后续试验奠定基础,保证后续酶解试验效果,因此确定4 h为合适的浸提时间。
2.2 响应面结果与分析
在培养基组成为麸皮、接种量为2%、浸提时间为4 h的基础上,根据模型的中心组合试验设计原理,挑选出培养温度、含水量和培养时间3个对米曲霉固态发酵产蛋白酶效果影响较大的因素,以蛋白酶活力为指标进行试验设计,试验结果如表3。
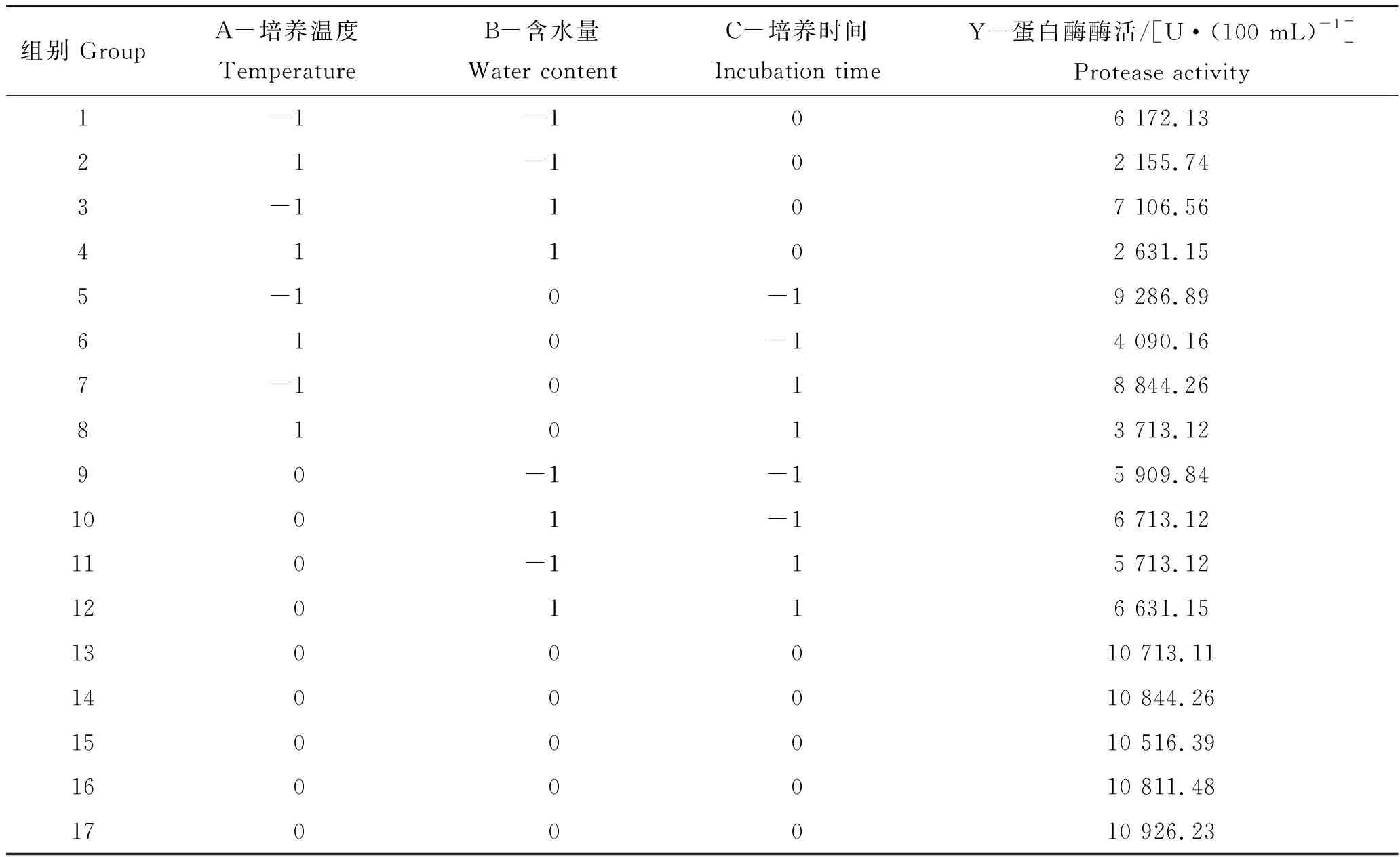
表3 响应面试验设计与结果Tab.3 Design and result of response surface in Box-Behnken
对表2进行多元化的回归方程分析,得到二次响应面回归方程为:Y=10 762.30-2 352.46A+391.39B-137.30C-114.75AB+16.39AC+28.69BC-3 002.05A2-3 243.85B2-1 276.64C2。
该模型的方差分析见表4。由表4可知,该模型的F值为196.4,P<0.000 1,表示该二次回归模型是极显著的;拟合不足P值为0.053 2,说明该模型失拟显著;相关系数R2=0.996 1,说明二次回归模型预测性良好,能够较好地反映响应值的变化。该模型与实际实验拟合程度较好,预测值和实际值之间具有较高的相关性,可用于米曲霉固态发酵产蛋白酶的理论指导依据。信噪比Adeq Precision=40.587>4,表示模型可行。培养温度、含水量、培养温度的二次项、含水量的二次项及培养时间的二次项对米曲霉固态发酵产蛋白酶的影响达到极显著水平(P<0.01)。
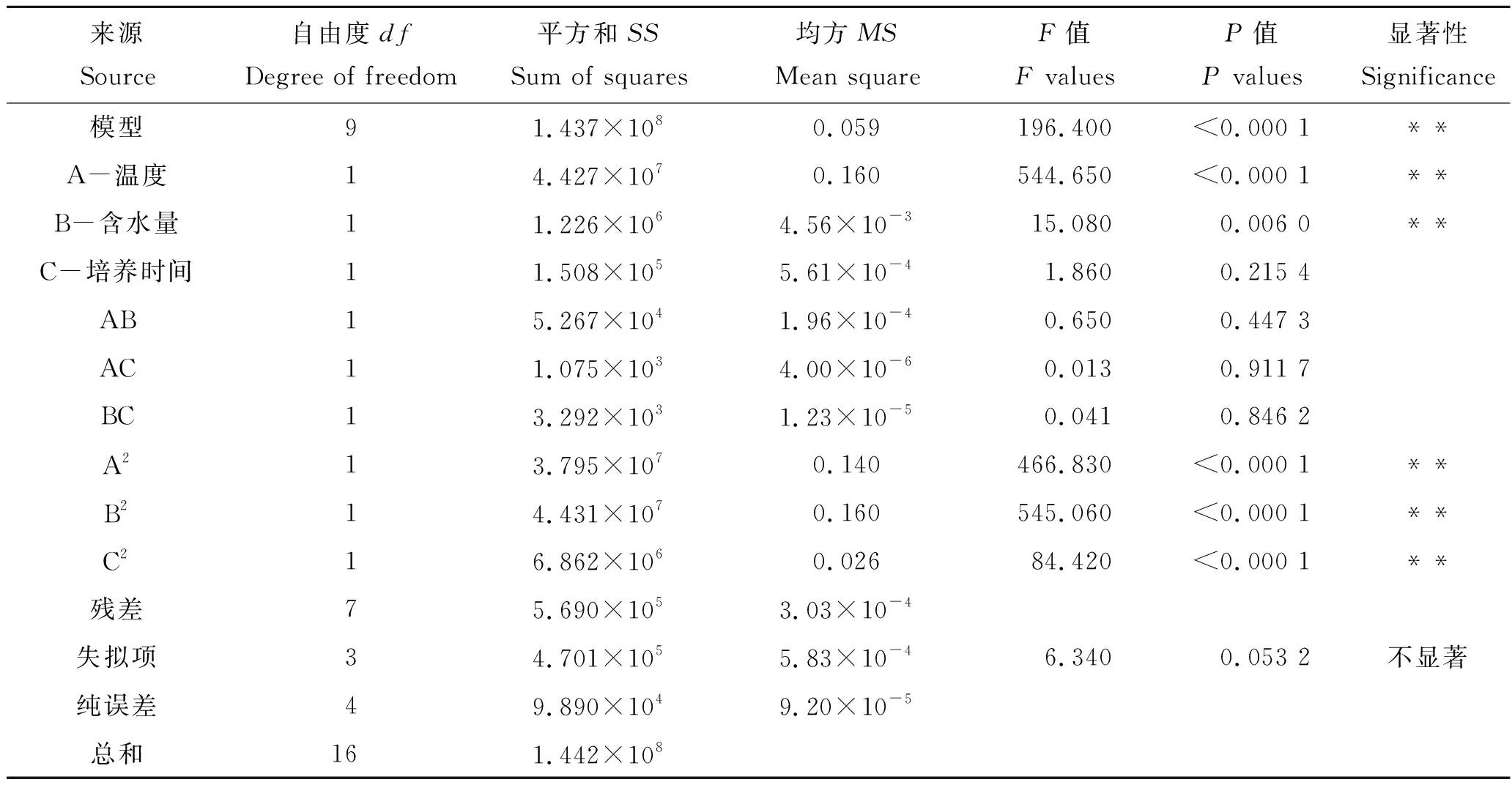
表4 回归系数模型及方差分析表Tab.4 Coefficient of regression model and variance analysis
各因素对米曲霉固态发酵产蛋白酶的2D等高线图和3D响应面图如图7所示。三维曲面图是各因素相互作用的直观反映,因素影响越大,则曲面图的曲线越陡峭。从图7中可以发现,当培养温度或培养时间一定时,随着含水量的增加,蛋白酶活呈现先上升后下降的趋势(图7b和图7f);当含水量或培养时间一定时,随着培养温度的增加,蛋白酶活呈现先上升后下降的趋势,下降坡度较大(图7b和图7d);当培养温度或含水量一定时,随着培养时间的增长,蛋白酶活变化趋势不大(图7d和图7f)。这与单因素试验结果一致,也进一步说明了培养时间的影响不显著,3个因素的两两交互作用不显著,与表4结果一致。
通过Design-Expert 8.0.6.1 软件分析,得到米曲霉固态发酵产蛋白酶的的最佳工艺参数:培养温度为28.05 ℃,含水量为60.7%,培养时间为83.28 h,此条件下,蛋白酶活力理论预测值为11 241.8 U/100 mL。验证试验过程中采取培养温度为28 ℃,含水量为60.7%,培养时间为83.3 h,测得蛋白酶酶活实际值为11 139.35 U/100 mL。刘志伟等[18]研究发现,米曲霉在固态培养基为麸皮、含水量为50%、30 ℃培养72 h所产蛋白酶酶活最高。袁艳玲等[19]研究发现,米曲霉在固态培养基麸皮和豆粕的质量比为4∶1、含水量为55%、30 ℃培养84 h条件下所产蛋白酶酶活最高。本实验结果与刘志伟等的研究结果非常相似,均采用了麸皮做培养基,培养温度和培养时间基本一致,但本研究中的培养基含水量相对较高,推测原因可能为不同菌种之间存在一定的差异导致。总体来看,本研究结果具有非常高的普遍性,可为米曲霉的研究提供一定的理论支持。
2.3 米曲霉所产蛋白酶酶解虾头的单因素优化试验
2.3.1 酶解温度对虾头酶解效果的影响
温度对米曲霉所产蛋白酶酶解虾头效果的影响如图8所示。在30~40 ℃范围内,随着温度的上升,可溶性蛋白和氨基态氮的含量均在不断升高,酶解温度为40 ℃时,可溶性蛋白和氨基态氮的含量达到最高,分别为7.79 mg/mL和1.82 mg/mL。在40~50 ℃范围内,可溶性蛋白含量呈明显下降趋势(P<0.05),推测40 ℃可能更有利于蛋白酶发挥作用,温度过低或过高,导致蛋白酶活性降低。因此确定40 ℃为米曲霉固态发酵所产蛋白酶酶解阿根廷红虾虾头的最佳温度条件。
2.3.2 酶解pH对虾头酶解效果的影响
pH对米曲霉所产蛋白酶酶解虾头效果的影响如图9所示。从结果可知,氨基态氮随着pH的增加而降低,这是因为氨基态氮的测定是采用的甲醛滴定法,且总体来看,不同pH条件下,氨基态氮含量虽然有所降低,但是差异很小,因此主要从可溶性蛋白的含量进行判断。在pH为7.5即自然pH时,可溶性蛋白达到最高值7.93 mg/mL,且具有明显优势,因此确定自然pH(7.5)为米曲霉固态发酵所产蛋白酶酶解阿根廷红虾虾头的最佳pH。
2.3.3 酶解时间对虾头酶解效果的影响
酶解时间对米曲霉所产蛋白酶酶解虾头效果的影响如图10所示。氨基态氮在3 h时,达到最大值1.91 mg/mL,之后有微弱下降趋势,可溶性蛋白在5 h时达到最大值7.31 mg/mL,之后有微弱下降趋势。二者总和在5 h时达到最大值9.15 mg/mL,效果较好。因此确定5 h为米曲霉固态发酵所产蛋白酶酶解阿根廷红虾虾头的最佳时间。
2.4 虾头酶解液的风味成分分析
2.4.1 挥发性成分分析
从表5中可以看出,酶解前检测出醛类、酮类、醇类及胺类化合物共13种,其中醛类物质含量最高,占总的挥发性成分的61.56%,醇类物质次之,占总成分的28.40%,此外还检测出三甲胺和少量的酮类。酶解后检测出醛类、酮类、醇类、酯类、芳香族化合物、酚类、胺类化合物及杂环化合物共28种。其中,醇类物质含量最高,占总的挥发性成分的51.25%,醛类和酮类次之,分别为28.16%和7.54%,此外,还检测出少量的三甲胺、酯类、酚类、芳香族化合物以及杂环化合物。孟凌玉等[20]以南美白对虾(Penaeusvannamei)风味蛋白酶酶解产物为原料制备虾风味基料,对酶解后产品进行挥发性物质测定发现,醛、酮和醇三类物质为主要成分,相对含量分别为20.45%、26.06%和8.16%,与本研究结果相似。

表5 虾头酶解前后挥发性风味物质相对含量比较Tab.5 Comparison of relative contents of volatile compounds before and after enzymatic hydrolysis of shrimp heads
醛类物质一般为脂质降解的产物,且呈现出阈值较低的特点[21],尤其是苯甲醛,作为虾头的重要风味成分[22],能给予清香、果香和坚果香的芳香特质[23]。丰富的酮类化合物贡献于虾的甜香和果香风味,通常由多不饱和脂肪酸的氧化或降解、氨基酸降解或微生物氧化产生[24]。醛酮类通常具有浓郁的香味,醛类物质经过脱氢酶的作用又可还原成相应的醇类物质,因此酶解后醛类物质相对含量有所下降,而醇类物质种类和相对含量均有所增多。醇类通常会产生比较清淡、柔和的气味[25],是虾头酶解产物中的主要成分。含量较高的醇类化合物,特别是具有蘑菇风味的1-辛烯-3-醇等,具有低阈值和高风味活性的特点,同时带有类似于薰衣草、玫瑰和干草的香气,一般存在于海产品的挥发性气味物质中,已有报道称1-辛烯-3-醇是大多数鱼虾类动物中共同具有的甜香和类植物香的气味成分,可能由脂肪的氧化分解或由羰基化合物还原生成,对虾头风味也有较大的贡献[26]。酯类物质常带有水果香,使风味更加浓郁[27]。含氮类物质的阈值较低,是水产品气味的重要组成部分,三甲胺作为一种非常强的挥发性物质广泛存在鱼、虾及蟹体内,产生鱼腥味[28]。2-戊基呋喃是亚油酸的氧化产物,呈现出蘑菇味[29]。
分析酶解前后挥发性成分的变化,可以发现,阿根廷红虾虾头经过米曲霉蛋白酶液酶解后,相比酶解前多检测出酯类、酚类、芳香族化合物和杂环类化合物,挥发性成分种类变多,风味程度变得更加多样复杂;苯甲醛在酶解前后的高含量说明酶解保留了虾头中优良的虾风味;具有明显鱼腥味的三甲胺相对含量降低,酶解液鱼腥味减轻;醛类物质种类未发生变化,相对含量有所降低。而酮类和醇类物质种类更加多样,相对含量有所升高,这也说明酶解液的风味成分更优。在发酵过程中,米曲霉分泌了丰富的蛋白酶和脂肪酶,作用于虾头后,其中的蛋白质和脂肪酸经氧化降解产生更多的酮类和醇类等物质;另外在虾头的酶解过程中,本身所富含的醛类物质经过蛋白酶液的作用,被还原成大量的醇类物质,因此醛类物质的相对含量有所降低,而醇类物质相对含量显著增加,这是酶解前后挥发性成分变化的原因。
2.4.2 电子鼻分析
总体来看,酶解前和酶解后响应值有较明显差异,酶解后的总响应值略低于酶解前(图11),这说明酶解液中的挥发性物质含量略低。结合传感器代表的取值(表2)分析可知,芳香物质、醇类物质(传感器1、8)的含量经过酶解后稍微得到提高,氨类物质、硫化物及有机硫化物(传感器3、7、9)等与虾类等水产品腥味有关的物质有明显降低。这与挥发性成分的测定结果相一致,说明虾头经过米曲霉蛋白酶液酶解后的风味得到进一步的改善。
2.4.3 电子舌分析
通过对电子舌味觉雷达图的分析,可以发现酶解前和酶解后味觉差异不大,但是酶解液的鲜味有明显的提升,鲜味回味也有一定程度的增加,且酸味有微弱降低(图12)。这说明虾头经过米曲霉蛋白酶酶液酶解后的总体味觉有明显改进,该结果再一次证明经过米曲霉所产蛋白酶酶解后的虾头的酶解液具有作为调味基料的潜能。
3 结论
本研究以阿根廷红虾虾头为原料,通过单因素实验和响应面优化实验,确定了米曲霉固态发酵产蛋白酶的优化参数:培养基为麸皮、培养基含水量为60.7%、培养温度为28 ℃、培养时间为83.3 h、接种量为2%及浸提时间为4 h。在此条件下,米曲霉固态发酵产蛋白酶酶活为11 139.35 U/100 mL。应用所产蛋白酶酶解阿根廷红虾虾头,通过单因素实验优化了酶解条件:酶解温度为40 ℃、酶解pH为7.5(自然pH)、酶解时间为5 h。此条件下,酶解液中可溶性蛋白和氨基态氮含量最高,表明虾头脱蛋白效果好。对虾头酶解液进行风味评价结果表明,与酶解前相比,酶解后其风味成分更加丰富,鲜味有所提高,腥味减弱,可进一步开发为调味品。本研究采用米曲霉产蛋白酶酶解虾头,该工艺条件较温和,且绿色环保,产品质量较好,可为虾头等废弃物的高值化利用提供理论参考和实践指导。

