双齿围沙蚕(Perinereis aibuhitensis)的生物扰动作用对沉积物中AVS分布的影响
侯颖,韩雪萌,付发武,王亚宁,田胜艳,2*
(1. 天津科技大学海洋与环境学院; 2. 天津市海洋环境保护与修复技术工程中心:天津 300457)
沉积物中的硫化物主要包括铁和锰的硫化物以及有机硫化物。根据其活动性通常可分为酸挥发性硫化物(acid volatile sulfide, AVS)、黄铁矿和有机硫化物。AVS是其中活动性最强的一类,可溶于盐酸[1]。沉积物中的AVS是还原条件下硫酸盐还原的结果[2],因此,AVS含量的高低代表了沉积物的氧化还原特性的强弱,在高含量AVS的沉积物中,底栖动物因缺氧而难以生存[3]。此外,AVS本身对底栖动物也有一定的生物毒性作用[4]。因此AVS含量被列为衡量沉积物环境质量优劣的一项重要指标[5-6]。虽然沉积物中的AVS影响底栖动物的生存,但底栖动物的爬行、摄食、建管和筑穴等行为可以改变沉积物的理化性质,如改变沉积物的结构和孔隙度、通气状况、氧化/还原边界分布及增加沉积层中氧化界面表面积。底栖动物生命活动对沉积物理化性质的改变过程被称为生物扰动作用[7],已有研究表明,生物扰动可以有效增加沉积物中氧化条件分布,从而改变沉积物的氧化还原电位[8-11]。沉积物中氧化还原电位显著影响AVS的分布,因此,生物扰动作用可以影响沉积物中AVS的分布。
双齿围沙蚕(Perinereisaibuhitensis)属环节动物门多毛纲,广泛分布于中国近海沉积环境[12],通常栖息于淤泥质沉积物中,在沉积物内掘成U型或Y型穴道,穴道深度可达15~40 cm[8,13]。双齿围沙蚕对有机质丰富的缺氧和高含量硫化物环境有很强的适应能力,研究发现,双齿围沙蚕在350 mg/L的硫化物中可以存活72 h以上,因此该物种可能在沉积环境修复中发挥重要作用[14]。已有研究表明,双齿围沙蚕的扰动作用可以改变沉积物的氧化还原条件,促进沉积层中有机质的降解与矿化,显著改善沉积物环境质量[15-16]。但关于双齿围沙蚕对沉积物中AVS分布的影响尚鲜见报道。
经济发达地区的近海沉积环境中汇集了各种来自陆源和海源的污染物,其中石油污染普遍存在[17-18],石油烃类污染物增加了沉积物中的有机质,从而促进沉积环境的厌氧化使得AVS含量增加。本研究通过构建室内试验系统模拟石油污染沉积物,研究双齿围沙蚕生物扰动作用下沉积环境中氧化还原电位以及AVS含量和分布的变化,探讨双齿围沙蚕对含有难降解有机质沉积环境厌氧条件的改善作用,以及对AVS的去除作用,以期为厌氧沉积物修复提供参考和理论依据。
1 材料与方法
1.1 试剂
硫化钠、抗坏血酸、硫酸铁铵、碳酸钠、盐酸和硫酸(均为分析纯)购自天津市风船化学试剂科技有限公司。硫酸亚铁、氢氧化钠和重铬酸钾(均为分析纯)购自天津市江天化工技术有限司。苯基代邻氨基苯甲酸、硫酸银和N,N-二甲基对苯二胺盐酸盐(均为分析纯)购自上海迈瑞尔化学技术有限公司。正己烷购自天津康科德科技有限公司。
1.2 沉积物采集与原油染毒处理
实验所用沉积物采自天津北塘河口潮间带(117.81 °E; 39.07 °N),是蓟运河、潮白新河及永定新河3条河流汇集入海处。选择落潮时间,用不锈钢铲(JF-002)挖取表层15 cm深的沉积物,过1 mm筛,以去除其中的大型底栖动物。取部分沉积物进行风干、研磨处理,其余沉积物避光储存。
实验所用原油为重质原油,取自渤海石油曹妃甸钻井平台,使用前先进行风化处理:置于玻璃表面皿中呈约5 mm厚的油膜,然后于通风柜中30 ℃恒温水浴,至原油恒重(每天重量损失低于0.5 %)为风化终点。风化后的原油用正己烷溶解,加入到研磨后的沉积物中,搅拌混合12 h,待正己烷彻底挥发后,将含有原油的干沉积物加入到湿沉积物中,电动搅拌1周,取5个随机样品测定总石油烃含量,标准偏差< 5%,表明石油烃在沉积物中分布均匀。原油染毒沉积物中石油烃含量为2.51 g/kg。染毒后的沉积物避光静置2周后使用。
1.3 双齿围沙蚕
实验用双齿围沙蚕购自浙江台州牧海水产养殖场。用人工海水(盐度为26‰,pH=8.0)在实验室内驯养10 d后用于实验。驯养期间往养殖缸内放入少量沉积物作为食源,每隔2 d更换养殖用水1次。
1.4 实验系统构建
实验在圆柱形玻璃缸(Φ14 cm×40 cm)内进行,内置25 cm深的沉积物,上覆10 cm深的人工海水(盐度为26‰,pH=8.0)。实验设计分2组:加入双齿围沙蚕的生物扰动组和不放双齿围沙蚕的对照组。每个实验组均设3个平行系统。实验系统装置示意图如图1所示。
实验系统的沉积物和上覆水装填后静止平衡5 d,用内径为1.5 cm的PVC管在氮气下对实验系统中的沉积物进行插管取样,取出的柱状沉积物样品根据距离泥/水界面的距离分为表层(0~5 cm)、中层(5~15 cm)和深层(15~25 cm),取出后立即置于容器中充氮气密封,用于测定AVS含量。另外取柱状样品,每隔2~3 cm分层测定氧化还原电位,以获得实验初始AVS含量和氧化还原电位值。实验系统中取出柱状样品后的圆洞填入实验用沉积物。生物扰动组实验系统内放入8条个体相近的双齿围沙蚕,其湿重为(1.73±0.32) g,生物密度为520条/m2。双齿围沙蚕放入的时间计时为第1天,实验共进行60 d。实验期间上覆水微曝气充氧,实验装置用保鲜膜封口以减少上覆水蒸腾损失。实验终止后,同样用插管法取柱状样,测定不同深度沉积物的氧化还原电位和AVS含量。

图1 实验系统示意图Fig.1Sketch map of the experimental design
1.5 沉积物氧化还原电位的测定
沉积物氧化还原电位的测定参照《海洋监测规范》第5部分:沉积物分析(GB 17378.5—2007)中的电位计法[19],用pH 计(PHS-3C,上海仪电科学仪器股份有限公司)进行测定。测定时将饱和甘汞电极和铂电极插入沉积物中,稳定后读数。根据公式(1)计算沉积物的氧化还原电位E。
E=Ea+Eb
式(1)
式中,Ea为饱和甘汞电极的电位(mV),Eb为仪器上测得的电位(mV)。
1.6 沉积物AVS的测定
沉积物中AVS含量的测定采用亚甲基蓝分光光度法(HJ 833—2017)[20]。沉积物样品中加入20 mL盐酸(6 mol/L),通过加热蒸馏装置将生成的硫化氢吹出,用氢氧化钠溶液(10 g/L)吸收,吸收液用亚甲基蓝显色,于665 nm波长处分光光度法测定。
1.7 数据处理与分析
实验结果以“平均值±标准偏差”表示,用SPSS 21.0统计软件进行数据分析,使用t检验及单因素方差分析(ANOVA) 对组间数据进行差异显著性检验,P<0.05 表明差异显著,P>0.05 表明差异不显著。
2 结果与讨论
2.1 双齿围沙蚕的生存状况与生物扰动行为
生物扰动组共放入双齿围沙蚕24只,实验结束时全部存活,并成功从系统中取出,表明双齿围沙蚕在实验系统中的生活状况良好。然而,双齿围沙蚕的平均湿重从实验初始的(1.73±0.42) g下降至(1.50±0.38) g,这可能是由于实验期间双齿围沙蚕只能利用沉积物中的有机质,缺少底栖藻类等优质食源造成的。
双齿围沙蚕进入实验系统的第3 d便全部钻入沉积物中,活动区域主要在表层(0~5 cm)和中层(5~15 cm);第10天其穴道出现在沉积物深层(15~25 cm)区域,系统装置侧面可观察到少量穴道,如图2(A)所示,沉积物表层出现双齿围沙蚕的粪便颗粒;实验进行至第30天时,系统装置侧面可见多条清晰的穴道,主要集中在表层和中层,掘穴深度最深达到18 cm;至第60天时,掘穴深度至20 cm,穴道周围的沉积物呈现浅褐色,表明局部区域的氧化状态(图2B),沉积物表面堆积了大量粪便颗粒(图2C)。
根据底栖动物对沉积颗粒物的迁移混合方式,可将扰动生物分为4种功能类群: 生物扩散者(biodiffusers)、上行输送者(upward conveyors)、下行输送者(downward conveyors) 和沉积物再造者(regenerators)[8]。双齿围沙蚕属于上行输送者,即头向下尾在上,通过摄食和排便过程将中层和深层的沉积颗粒物输运至表层。覃雪波等[21]利用微宇宙示踪技术研究发现双齿围沙蚕掘穴深度可达18 cm,与本研究中发现的掘穴深度基本一致。

图2 生物扰动组实验系统的表观状态A:第10 d系统侧视图;B:第60 d系统侧视图;C:第60 d系统表面洞口及粪便颗粒(圆圈标出粪便)。Fig.2 Appearance in the experimental system of bioturbation groupA: Side view of the experimental system at 10th day;B: Side view of the experimental system at 60th day;C: Burrow holes and fecal particles at the surface of the experimental system at 60th day (circles show the feces).
2.2 沉积层氧化还原电位的变化
双齿围沙蚕生物扰动作用下沉积层的氧化还原电位显著升高,且显著改变了沉积物中氧化还原电位的纵向分布。实验终止时(第60天),生物扰动组和对照组中沉积物的氧化还原电位均高于实验初始的状态,其中生物扰动组中氧化还原电位显著高于对照组和实验初始(P<0.05),如图3所示。实验终止时(第60天),生物扰动组沉积物表层和中层氧化还原电位显著高于深层(P<0.05),其中表层和中层氧化还原电位无显著差异(P>0.05);对照组沉积物表层氧化还原电位显著高于中层和深层(P<0.05),其中中层和深层氧化还原电位无显著差异(P>0.05)。对于深层沉积物,对照组第60天时仍为还原状态,而生物扰动组呈氧化状态。上覆水中的氧气很难扩散进入深层,只能通过沉积物-水界面和穴道壁进入沉积物内部[13],而底栖动物扰动过程中形成的穴道有效改变了沉积物的孔隙结构,增加了沉积物与上覆水进行物质交换的有效面积。底栖动物为了呼吸和进食,通过生物灌洗作用将含有氧气的上覆水引入洞穴,促进了水中溶解氧与深层孔隙水的交换[22-23],从而改变了沉积层的氧化条件分布。本研究中生物扰动组穴道周围被新引入的氧气氧化,使穴道周围的沉积物呈浅褐色,而其他部位沉积物颜色较深,说明双齿围沙蚕的生物扰动明显促进上覆水的溶解氧进入沉积层,尤其是通过双齿围沙蚕的穴道进入沉积物深层,使得穴道周围的沉积物被氧化,并且通过与孔隙水之间的物质交换,提高了沉积物的氧化还原电位。Timmermann等[24]研究发现海蚯蚓(Arenicolamarina)的生物扰动增加了沉积层的含氧量;Mana等[25]的室内试验系统研究发现大型底栖动物群落生物扰动50 d后,沉积物的氧化还原电位明显增加,由还原条件变为氧化条件,显著高于未添加扰动生物的对照组。本研究结果与上述文献报道一致。

图3 沉积物中氧化还原电位的纵向分布Fig.3Vertical distribution of oxidation-reduction potential in sediment
2.3 沉积物中酸挥发性硫化物(AVS)的变化
经过60 d,生物扰动组和对照组实验系统中AVS含量呈现出不同的变化。如图4所示,对照组中各层沉积物中AVS含量较实验初始值均增加,而生物扰动组中各层沉积物中的AVS含量较初始值均降低,且生物扰动组各层沉积物的AVS含量均显著低于对照组(P<0.05)。在双齿围沙蚕生物扰动作用下,沉积层氧化还原电位提高,使得沉积物中AVS被氧化。而AVS氧化生成的硫酸盐水溶性高,更易进入孔隙水,并通过与上覆水的物质交换进入上覆水中。此外,双齿围沙蚕的U形穴道增加了物质交换的有效面积,并在生物灌洗作用中使硫酸盐被快速冲出,从而降低沉积物和孔隙水中的AVS含量[23-26]。根据双齿围沙蚕的穴道分布情况分析,表层和中层沉积物中穴道分布更密集,深层沉积物中穴道数量少,且沉积层中氧化还原电位也表现出从表层到深层逐渐降低的变化情况(图3),因此沉积物中AVS含量的纵向分布表现为:表层<中层<深层,且表层和中层沉积物中的AVS显著低于深层沉积物中的AVS含量(P<0.05),这一现象与Chareonpanic等[27]和Heilskov等[28]的研究结果一致。然而,不同扰动类型的底栖动物对AVS含量的影响可能不同。Remaili等[29]对双壳类动物(Tellinadeltoidalis)和端足类动物(Victoriopisaaustraliensis)进行的28 d的扰动实验发现,沉积物0~4 cm中AVS含量与初始值相比出现了增多的情况。Nedwell等[30]的研究也发现,海洋环境中的端足类生物(amphipods)提高了沉积物中有机质转化为无机质的反应速率,为沉积物表面氧化层的硫酸盐还原菌提供了营养物质,有利于AVS 的形成,引起AVS含量增加。
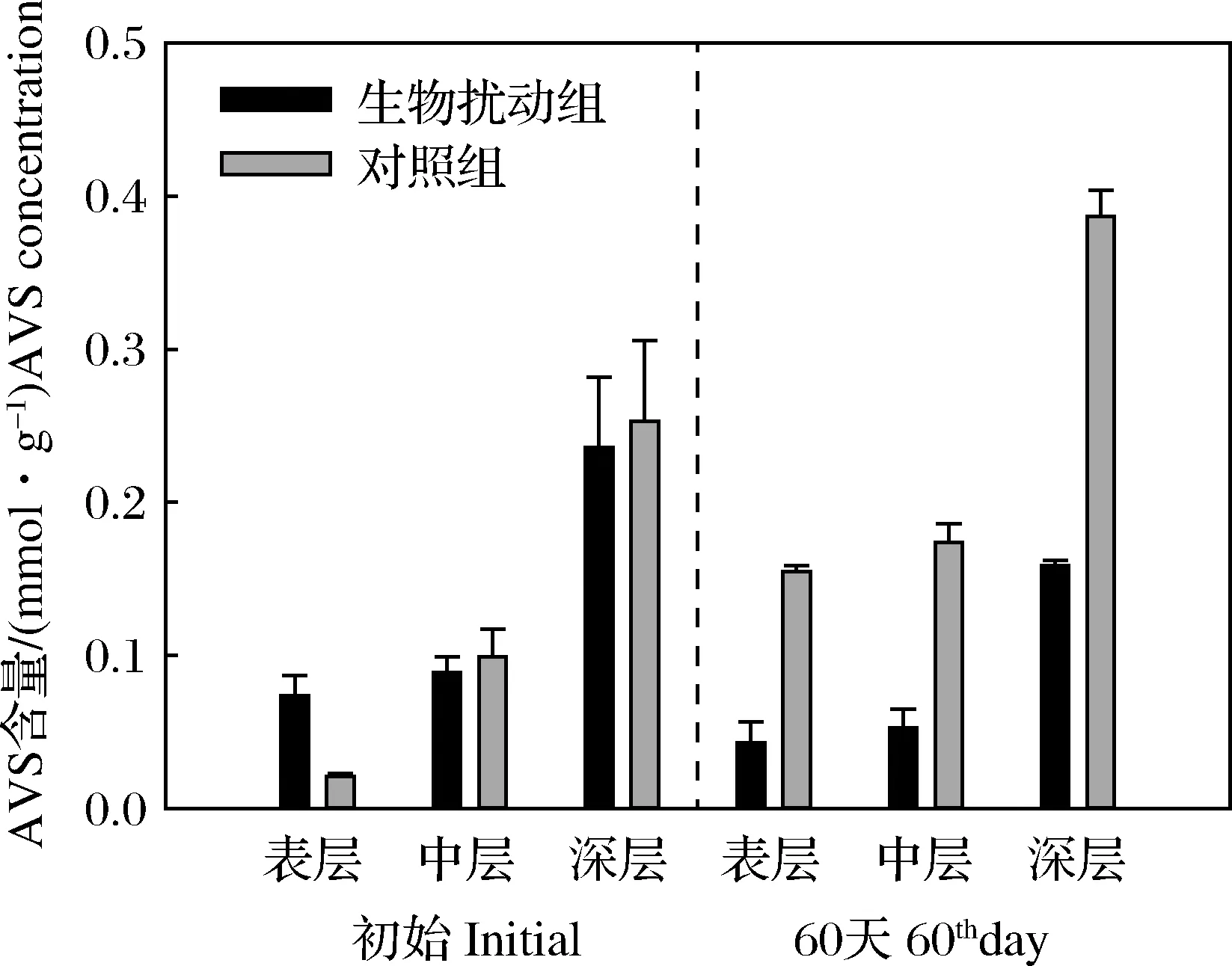
图4 沉积物中AVS的含量Fig.4AVS Concentrations in sediment
3 结论与展望
双齿围沙蚕的生物扰动作用有效改变了沉积层中氧化/还原边界,提高了沉积物中的氧化还原电位,从而促进了AVS的氧化,导致AVS含量降低。由于双齿围沙蚕主要在沉积物表层和中层活动,沉积物中AVS含量的纵向分布表现为:表层<中层<深层,且表层和中层沉积物中的AVS显著低于深层沉积物中的AVS。
双齿围沙蚕生物扰动下AVS氧化减少对于沉积物环境质量是有利的一面。然而,沉积物中的AVS还关系到其他污染物的环境行为,如还原条件下AVS对沉积物中的重金属结合可降低其生物有效性,那么生物扰动作用可改变沉积物中的氧化还原条件及降低AVS含量,极可能影响沉积物中重金属的生物有效性。因此,评价生物扰动作用对沉积物环境质量影响时,要综合考虑对AVS的影响以及其他污染物生物有效性的影响。

