组合训练骨骼肌分子适应机制研究进展*
马继政 郑益丽,2 徐琳,3
组合训练骨骼肌分子适应机制研究进展*
马继政1郑益丽1,2徐琳1,3
(1.陆军工程大学军事运动科学研究中心,江苏 南京 211101;2.南京大学生命科学学院,江苏 南京 211101;3.南京体育学院运动健康科学系,江苏 南京 210014)
在运动中,骨骼肌表现出非凡的适应能力,包括收缩蛋白的结构功能、卫星细胞与线粒体的结构功能、代谢调节、细胞内信号转导、转录应答。骨骼肌可精确应答不同运动,因此,特异性适应原则是运动训练的基本原则之一,通过特定训练(包括训练量、强度、次数,肌肉工作模式)产生特定适应,进而获得最佳化的运动能力。组合训练(一次训练同时涉及耐力和力量练习)广泛用于发展个体的基本运动能力,但AMPK代谢途径的激活,可能会抑制AKT-mTOR合成通路,最终弱化力量练习获得的适应,AMPK下游分子PGC-1α在其中可能发挥关键作用。当前,组合训练诱导生物分子适应机制方面的研究相当有限,miRNA的发现为组合训练研究提供了一个新途径,充分认识其中的变化规律,有助于制定精准运动处方。
组合训练;特异性适应;腺苷酸活化蛋白激酶;雷帕霉素复合物;过氧化物酶体增殖物受体γ共激活因子1α
系统训练可增加运动员个体的运动能力。训练负荷可作为应激诱导人体发生反应以适应外界负荷。运动诱导的应激可致机体疲劳、个体工作能力降低,使机体处于应激状态,随后在恢复期发生适应性变化。长期训练可提高人体运动能力,其中涉及大量分子事件。运动通常分为三类:“以耐力为基础”“以力量-爆发力为基础”以及介于两者之间的运动。针对具体的运动项目,对耐力和力量的需求是不同的。从整体上看,运动相关分子事件与肌肉收缩类型、强度和持续时间有关。本综述主要关注力量和耐力组合训练(concurrent training,CT),即同一次训练中包含力量和耐力练习。
基于训练的特异性适应原则的研究表明,耐力运动可促进线粒体生物合成和血管生成,并提高代谢适应能力,从而提高耐力能力,多条分子途径参与其中,包括过氧化物酶体增殖物受体γ共激活因子1α(peroxisome proliferator-activated receptor-γcoactivator-1α,PGC-1α)、腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)、Ca2+/钙调素依赖性蛋白激酶(calmodulin-dependent kinases,CaMK)、丝裂原活化蛋白激酶(ERK1/2,p38 MAPK)和钙调磷酸酶(calcineurin)等。力量训练可促进肌纤维蛋白的生物合成(如肌球蛋白重链蛋白等),从而增加骨骼肌的肥大程度、力量和爆发力,涉及到的分子事件主要发生在AKT-雷帕霉素复合物(mammalian target of rapamycin,mTOR)信号通路。充分认识CT诱导的骨骼肌分子适应机制,有助于制定基于运动模式、持续时间和强度的精准运动干预治疗策略。
1 组合训练效应
在以期获得最佳训练效果的日常训练中,常涉及CT以提高基础代谢率、胰岛素敏感性、葡萄糖/脂质代谢率、脂质体与改善体成分,从而增加骨骼肌肥大程度、力量、爆发力,并提高心肺代谢能力。长期力量、耐力训练后,骨骼肌会发生不同的表型变化(见表1)。
20世纪80年代,Hickson首次报道,与单独力量训练相比,组合练习后力量会适应减弱,称其为“干扰效应”。但随后的研究存在较大争议,一些研究认为CT可干扰骨骼肌肥大程度/力量/爆发力,而一些研究则认为不存在干扰机制。但最近有研究认为长持续CT可影响优秀运动员的耐力成绩。另外,一些个体受CT影响,而一些个体不受CT影响。迄今为止,CT参与者之间的差异反应/适应原因尚未得到阐明,存在许多未解决的问题。CT效应是一种多维现象,受各种生理和非生理因素的影响,如运动特征、训练背景、受训肌肉群以及个体差异等,其分子机制非常复杂,难以评估。此外,有研究表明,CT主要受各训练阶段适应性分子途径的干扰与肌肉损伤程度的影响。
表1 耐力练习和力量练习诱导的骨骼肌适应反应
耐力练习力量练习 肌肥大—⇈ 肌力—⇈ 肌纤维大小—↑⇈ 肌原纤维蛋白合成↑⇈ 卫星细胞计数↑⇈ 肌核计数—↑⇈ 乳酸耐受能力⇈—↑ 糖酵解功能↑⇈ 线粒体体积⇈↑ 线粒体蛋白合成⇈—↑ 毛细血管密度⇈— 氧化功能⇈—↑ 耐力能力⇈—↑
注:—,无变化;—↑,无变化或影响很小;↑,较小影响;⇈,较大影响。
2 组合训练的训练学变量与潜在分子干扰机制
2.1 耐力训练的方式、强度和训练量
AMPK,细胞能量代谢的关键分子,主要通过激活其下游关键分子PGC-1α,参与线粒体蛋白生物合成的调节,主要为I型肌纤维。PGC-1α在骨骼肌线粒体功能调节方面,具多重作用,可上调丙酮酸脱氢酶激酶4(pyruvate dehydrogenase kinase,PDK4)和丙酮酸脱氢酶复合物(pyruvate dehydrogenase complex ,PDCP),从而促进肌细胞脂肪氧化。此外,与运动相关的活性氧(reactive oxygen species,ROS)、CaMK、Calineuurin、sirtuin 1(Sirt1)和p38 MAPK,可激活PGC-1α基因表达与PGC-1α介导的线粒体转录因子A(TFAM)和代谢蛋白编码基因。另外,AMPK可抑制AKT-mTOR信号通路,即骨骼肌肌肉肥大。细胞能源可利用率低、匮乏,AMP/ATP比率增加,可导致AMPK磷酸化,随后激活结节性硬化复合物蛋白1/2 (tuberous sclerosiscomplex 1/2,TSC1/2),导致Raptor-mTOR去磷酸化,从而抑制mTOR信号通路。耐力训练负荷/强度与AMPK磷酸化可能存在剂量效应,高负荷(长持续时间、高强度)可增加AMP/ATP比率,激活AMPK。
另外,AMPK通过活化叉头框蛋白O3a(forkhead box protein O3a,FoxO3a)、肌肉萎缩F盒蛋白(muscle-atrophy f-box,MaFbx)、肌肉环指蛋白-1(musclering finger-1,MuRF-1)等分子,激活泛素蛋白酶体途径与自噬/溶酶体系统。因此,CT方案中涉及的长持续(>20min)中等强度耐力练习,将抑制肌纤维、线粒体蛋白的生物合成。此外,除AMPK途径外,还可能存在其他干扰途径,但它可能是一个非常重要的途径。
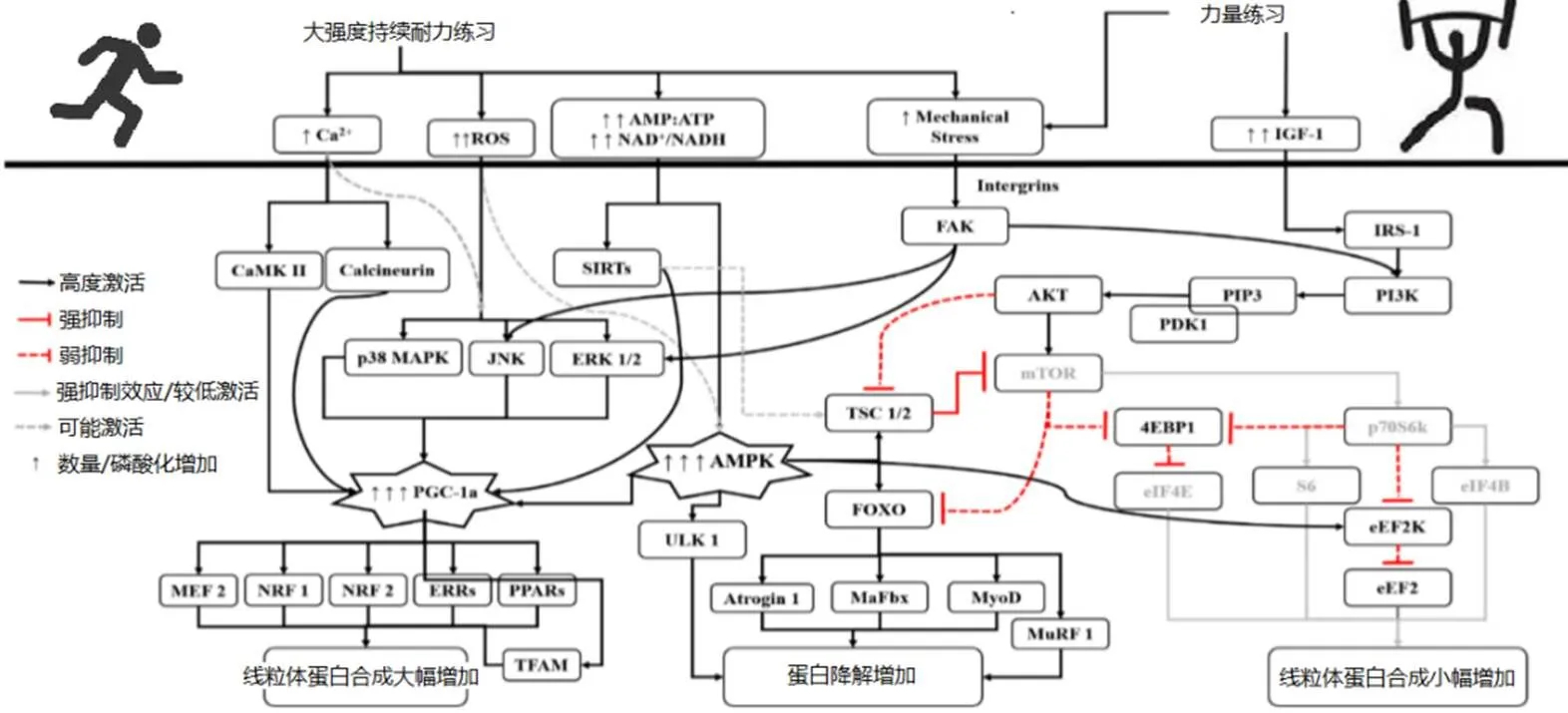
图1 耐力训练和力量训练的分子信号通路[2]
2.2 力量训练的方式、强度和训练量
骨骼肌质量和功能的维持,对疾病预防、生活质量和全身性新陈代谢至关重要。力量训练是促进肌肉蛋白合成的强效刺激,可诱发4个主要生理应激:机械负荷应激、神经元激活、激素调整和代谢紊乱,其中机械刺激是最主要的。目前,对于力量训练诱导的骨骼肌肥大机制,有研究提出了一个可能的主要生物信号途径:哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号通路。力量练习(机械刺激)通过激活mTOR上游和下游的调控分子,磷酸化上游(即胰岛素受体底物1 insulin receptor substrate 1,IRS1;蛋白质激酶B,Akt;肿瘤硬化复合物2,tumor sclerosis complex 2,TSC2)和下游(核糖体S6激酶1,ribosomal S6 kinase 1,p70S6k)分子(见图1)。
另外,mTORC1还参与调节核糖体蛋白和核糖体RNA(ribosomal RNAs,rRNA)的合成,在核糖体生物合成中发挥核心作用。RT诱导肌纤维肥大时,核糖体生物合成可能是一个关键的限速因素。
此外,骨骼肌再生能力依赖于肌源性特异性的未分化的前体细胞(即卫星细胞),它能促使肌纤维肥大。目前,主要通过Adams等人提出的模式,来阐述力量训练诱导的骨骼肌肥大现象(见图2)。该模式认为初始阶段,肌核结构区域未达到假定上限时(≥25%横断面积),机械过负荷诱导的肌纤维肥大不需借助卫星细胞,此时肌纤维增大主要依靠蛋白质的增加;继续过负荷刺激,随肌纤维进一步增大与肌细胞区域扩大,卫星细胞介导的肌核细胞增加可能对持续肌肥大至关重要,其中Ⅱ型肌纤维受到的影响要远大于I型肌纤维。

图2 肌肥大示意图[14]
当前,力量训练诱导的急性反应具有强度依赖性,运动强度小,即一次最大重复次数(1RM)为40%时即可激活肌肉,但强度超过60%1RM后,肌肉激活程度可提高2-3倍。尽管力量训练诱导的合成代谢存在剂量效应,但力量训练肌肥大效应的训练学影响因素较多,这为研究带来了挑战,包括力量训练方式、强度和量、选择练习手段和顺序、组间休息时间、速度和次数等。骨骼肌结构和功能适应的形成是这些训练参数重复性机械刺激的结果,可直接作用于肌细胞,从而影响肌肥大程度,但尚不清楚该如何设计力量训练参数来最佳化其适应的获得。
2.3 力量和耐力训练的次序
组合训练是一个挑战,个体需要同时适应2个截然不同的生理过程。训练变量的调节可能有助于优化适应,除上述训练变量外,力量和耐力练习的先后次序也可能影响训练效果。其研究资料较少,且结果存在冲突。一些研究认为次序不重要,其细胞信号急性应答相似;而一些研究则认为练习顺序会影响急性分子应答。类似争议也存在于训练方面的研究。先进行耐力训练,后进行力量训练,肌肉肥大和力量/爆发力适应能力受到影响,其原因可能是耐力训练诱导分子的急性应答潜在抑制随后力量训练获得的分子适应;相反,一些研究认为不存在拮抗效应,尽管这些短周期训练研究表明,练习顺序不影响适应的获得,可观测到力量训练适应的不显著增加,但这些非显著性改变可能对长期训练适应(>2年)产生巨大影响。另外,耐力练习先于力量练习与力量练习先于耐力练习相比,女性更易获得较高力量训练适应,其原因可能与耐力练习后的肌肉疲劳程度有关。当前,很难确定何种练习次序可获得CT最佳化诱导适应。根据优先训练原则,应根据练习目的,首先调整影响运动能力的主要训练参数。
最近,有研究认为间隔训练可有效提高耐力与肌肥大程度和力量/爆发力。根据Sale等人的工作,发现在不同日期和/或训练期间进行耐力和力量训练,可获得更高适应性。与单一训练课次(同时进行耐力和力量训练)相比,进行力量和耐力间隔训练是一个非常好的方式。荟萃分析研究表明,为最大限度地提高CT训练适应能力,两次训练应相隔3-6h(若训练目标为获得力量训练最佳适应)或24h(最大化耐力训练适应)。其原因可能是进行间隔训练可避免肌原纤维和线粒体蛋白质合成分子级联反应被激活的峰值,从而获得更优的训练适应。两次训练间隔时长取决于第一次训练引发的疲劳程度,较高训练负荷会引起较高疲劳,因此需较长时间的恢复间隔。如果在力量训练前进行耐力训练,则需要较长的时间间隔(可能>48小时)。尤其是女性,其训练疲劳要高于男性。
考虑到各项研究的局限性及其争议性结果,目前认为训练目的为最大限度发展肌肉质量、力量/爆发力适应和改善身体成分时,力量练习应先于耐力练习进行;反之,当需要增加耐力能力,或力量训练适应性不重要时,耐力训练应放在前面。但是,为最大化CT训练诱导的适应性,需要进行间隔训练,休息间隔至少为6-24小时。此后,应根据训练目标决定练习次序,若侧重力量则保持2:1或3:1的训练比例(每周力量训练次数:每周耐力训练次数),以获得关键能力;而当比例为1:1或1:2时,可以更好地发展耐力能力。
2.4 个体的训练史
个体训练史、系统训练年限也可能是影响CT效果的一个重要因素。与训练有素的运动员相比,未训练或中等程度训练的个体往往具有更高的分子激活能力,同时诱导肌原纤维和线粒体蛋白质合成。细胞稳态极易受干扰是可能的原因,因此可观察到更高的训练适应。事实上,新手/未经训练个体,仅一次耐力运动刺激,就可发现mTOR级联显著上调,这能够促进肌肉大小/力量/爆发力适度增加;力量训练后,促线粒体蛋白合成的分子途径同样增加,因此,氧化能力得到增强。另外,力量或耐力训练经验者进行一次不熟悉的训练,会出现串扰现象。与耐力训练受训者相比,未经训练的个体进行耐力运动时,调控线粒体蛋白质合成的分子的激活程度更高,而耐力训练个体进行抗阻训练时,mTOR级联蛋白的磷酸化程度高于力量训练经验者。以上这些研究结果表明,个体训练史会影响不同运动刺激产生的特异性信号反应,特别是当新刺激处于耐力-力量训练连续体两端时。
因此,对于新手或训练不足个体来说,与单一的力量或耐力训练相比,CT可增加调控肌纤维和线粒体生物合成的信号途径,也可导致两方面均产生显著适应[1]。然而,长期运动干预(5-20周)往往会削弱最初CT运动刺激后整体合成代谢的增加。
随训练时长(月份或年份)的增加与不同训练负荷的积累,体内平衡愈易受干扰,重复性CT训练可能会产生特定的训练适应,通过每次训练后分子应答的减弱,从而诱导肌肉表型转化和/或激活特定肌肉损伤保护机制。训练有素的个体,上述变化可能会导致CT后,力量训练诱导的生理适应受损,CT对训练有素个体产生的影响远超过新手。然而,确切的生物学机制、CT产生的特异适应何时开始削弱力量训练获得的适应,以及如何设计训练计划进行规避?目前,没有可靠的研究证据和结论,仍需要进一步研究。
2.5 MicroRNAs
短链非编码RNA(即microRNAs,miRNAs),通过RNA沉默/转录后调节基因表达。2007年,McCarthy和Esser发现miR-1表达显著下降,伴随小鼠肌肥大时IGF-I表达的增加,表明miRNA可能调节骨骼肌肥大进程,可能通过其负调控抑制IGF-I表达;而耐力训练导致骨骼肌miR-23和miR-494表达下调,通过生物预测可能上调PGC-1α、mtTFA和Foxj3,促线粒体生物发生;miR-19下调,通过生物预测上调Vegf和Vegfr,增加血管生成。上述研究表明,miRNA可能调节耐力训练诱导的代谢适应。这些运动方式特定变化的miRNA可能参与调控运动的适应机制。
另外,miRNA可释放入血,存在4种形式:外泌体(Exosomes)包裹、结合Argonaute2蛋白(Ago 2)形成复合物、结合于高密度脂蛋白(highdensitylipoprotein,HDL)以及RNA结合蛋白核磷酸蛋白(nucleophosmin,NPM1)。近期,有研究开始关注循环miRNA(c-miRNA)能否作为转录后调节因子、细胞间通讯器,特别是可否作为急性运动系统适应的潜在生物标志物?通过前期检测大强度间歇练习、中等距离持续耐力练习和不同力量训练方案后血浆c-miRNA的变化,结果显示:不同形式运动,c-miRNA应答不同。这表明相对运动形式特定变化的c-miRNA可潜在用于评定训练效果,但目前尚不清楚其生物学功能。
运动可对收缩肌群施加机械或代谢负荷。当前,需要更好地认知CT:急性、慢性CT如何改变miRNA表达,其目标基因及调控网络;更全面地认知CT引起的适应性分子机制。该方面研究有助于认识何种运动方式更为有益,通过调控其表达可提高训练适应能力。此外,miRNA本身可作为治疗靶标,特别是在疾病防治方面。
3 小结与展望
运动可保持并增加有氧能力和骨骼肌力量,改善代谢功能障碍并预防慢性疾病。健康效益包括骨骼肌代谢和分子重塑。耐力和力量运动代表了运动连续体的两极,会导致截然不同的训练适应,是大量信号通路之间复杂的相互作用的结果,基因表达被视为构成运动诱导效应的“基石”,该过程涉及几类信号事件:转录前和转录后事件及其调节、翻译和蛋白质加工(存在复杂的分子时空交互作用),并受基因、环境和运动刺激(方式、强度、持续时间和次数)的影响。运动多效性以及代谢和分子水平应答复杂性表明,运动训练适应并非由单一的信号途径介导。当前,CT生物分子机制方面的研究相当有限,这些有限的资料表明高运动量、中等强度、多次数的耐力训练可能会抑制力量训练诱导的适应性,主要是由于AMPK抑制AKT-mTOR通路的激活,其中PGC-1α发挥关键作用。此外,miRNA的发现为研究CT提供了一个新途径。
另外,从现实应用的角度来看,设计和提供精准训练方案,需要根据运动模式、强度或持续时间等因素,建立特定运动干预方面的分子特征,探索训练适应的基础机制,并优化有氧或力量方面的适应,以期最佳化获得身体健康。
[1]Coffey VG, Hawley JA. Concurrent exercise training: do opposites distract[J].J Physiol,2017,595(9):2883-2896.
[2]Methenitis S. A brief review on concurrent training: from laboratory to the field[J]. Sports (Basel),2018,6(4).
[3]Garber CE, Blissmer B, Deschenes MR, et al. Quantity and quality of exercise for developing and maintaining cardiorespiratory, musculoskeletal, and neuromotor fitness in apparently healthy adults: guidance for prescribing exercise[J]. Med Sci Sports Exerc,2011,43(7):1334-1359.
[4]Qaisar R, Bhaskaran S, Van Remmen H. Muscle fiber type diversification during exercise and regeneration[J]. Free Radic Biol Med,2016(98):56-67.
[5]Hickson RC. Interference of strength development by simultaneously training for strength and endurance[J]. Eur J Appl PhysiolOccup Physiol,1980,45(2-3):255-263.
[6]Doma K, Deakin GB, Bentley DJ. Implications of impaired endurance performance following single bouts of resistance training: an alternate concurrent training perspective[J]. Sports Med,2017,47(11):2187-2200.
[7]Hawley JA, Hargreaves M, Joyner MJ, et al. Integrative biology of exercise[J]. Cell, 2014,159(4):738-749.
[8]Sanchez AM, Candau RB, Csibi A, et al. The role of AMP-activated protein kinase in the coordination of skeletal muscle turnover and energy homeostasis[J].Am J Physiol Cell Physiol, 2012,303(5):475-485.
[9]Silva RF, Cadore EL, Kothe G, et al. Concurrent training with different aerobic exercises[J].Int J Sports Med, 2012,33(8):627-634.
[10]Murach KA, Bagley JR. Skeletal Muscle Hypertrophy with Concurrent Exercise Training: Contrary Evidence for an Interference Effect[J]. Sports Med,2016,46(8):1029-1039.
[11]Hoppeler H. Molecular networks in skeletal muscle plasticity[J].J Exp Biol, 2016,219( 2):205-213.
[12]Gonzalez AM, Hoffman JR, Townsend JR, et al. Intramuscular anabolic signaling and endocrine response following high volume and high intensity resistance exercise protocols in trained men[J].Physiol Rep,2015,3(7):12466.
[13]Watson K, Baar K. mTOR and the health benefits of exercise[J]. Semin Cell Dev Biol,2014(36):130.
[14]Bamman MM, Roberts BM, Adams GR. Molecular regulation of exercise-induced muscle fiber hypertrophy[J].Cold Spring HarbPerspect Med,2018,8(6).
[15]Gonzalez AM, Hoffman JR, Stout JR, et al. Intramuscular Anabolic Signaling and Endocrine Response Following Resistance Exercise: Implications for Muscle Hypertrophy[J]. Sports Med,2016,46(5):671-685.
[16]Spiering BA, Kraemer WJ, Anderson JM, et al. Resistance exercise biology: manipulation of resistance exercise programme variables determines the responsesof cellular and molecular signalling pathways[J]. Sports Med,2008,38(7):527-540.
[17]Jones TW, Walshe IH, Hamilton DL, Howatson G, et al. Signaling responses after varying sequencing of strength and endurance training in a fed state[J]. Int J Sports Physiol Perform,2016,11(7):868-875.
[18]Coffey VG, Jemiolo B, Edge J, Garnham AP, Trappe SW, et al.Effect of consecutive repeated sprint and resistance exercise bouts on acute adaptive responsesin human skeletal muscle[J]. Am J Physiol Regul Integr Comp Physiol, 2009,297(5):1441-1451.
[19]Eddens L, van Someren K, Howatson G. The role of intra-session exercise sequence in the interference effect: a systematic review with meta-analysis[J]. Sports Med,2018,48(1):177-188.
[20] Schumann M, Küüsmaa M, Newton RU, et al. Fitness and lean mass increases during combined training independent of loading order[J]. Med Sci Sports Exerc,2014,46(9):1758-1768.
[21]Sale DG, Jacobs I, MacDougall JD, et al. Comparison of two regimens of concurrent strength and endurance training[J]. Med Sci Sports Exerc, 1990,22(3):348-356.
[22]Wilson JM, Marin PJ, Rhea MR, et al. Concurrent training: a meta-analysis examining interference of aerobic and resistance exercises[J].J Strength Cond Res.2012,26(8):2293.
[23]Schumann M, Eklund D, Taipale RS, et al. Acute neuromuscular and endocrine responses and recovery to single-session combined endurance and strength loadings: "order effect" in untrained young men[J].J Strength Cond Res,2013,27(2):421.
[24]Wilkinson SB, Phillips SM, Atherton PJ, et al. Differential effects of resistance and endurance exercise in the fed state on signalling molecule phosphorylation and protein synthesis in human muscle[J].J Physiol,2008,586(15):3701-3717.
[25]McCarthy JJ, Esser KA. MicroRNA-1 and microRNA-133a expression are decreased during skeletal muscle hypertrophy[J]. J Appl Physiol (1985),2007,102(1):306-313.
[26] Kirby TJ, McCarthy JJ. MicroRNAs in skeletal muscle biology and exercise adaptation[J]. Free Radic Biol Med,2013(64):95-105.
[27]Ortiz-Quintero B. Cell-free microRNAs in blood and other body fluids, as cancer biomarkers[J].Cell Prolif,2016,49(3):281-303.
[28]Cui SF, Li W, Niu J, Zhang CY, Chen X, Ma JZ. Acute responses of circulating microRNAs to low-volume sprint interval cycling[J]. Front Physiol,2015(6):311.
[29]Cui SF, Wang C, Yin X, et al. Similar Responses of Circulating MicroRNAs to Acute High-Intensity Interval Exercise and Vigorous-Intensity Continuous Exercise[J]. Front Physiol,2016(7):102.
[30]Cui S, Sun B, Yin X, et al. Time-course responses of circulating microRNAs to three resistance training protocols in healthy young men[J].Sci Rep,2017,7(1):2203.
Research Development of the Mechanism of Skeletal Muscle Molecules’s Adaptation to Combination Training
MA Jizheng,etal.
(the Army Engineering University of PLA, Nanjing 211101, Jiangsu, China)
全军军事类研究生资助课题(项目编号:2016JY374);江苏省普通高校学术学位研究生科技创新计划项目(项目编号:KYCX17-1369);解放军理工大学预先研究基金(项目编号:KYJYZLXY1602-35)。
马继政(1971—),博士,教授,研究方向:军事运动训练与生物适应。

