陈皮提取物绿色合成纳米银无标记比色法检测汞离子
杨博玥,张 卫,孙 奕,董 晨,符伟杰,诸 杰
(1.水利部交通运输部国家能源局南京水利科学研究院,江苏 南京 210029;2.水利部南京水利水文自动化研究所,江苏 南京 210012;3.水利部水文水资源监控工程技术研究中心,江苏 南京 210012;4.南京邮电大学材料科学与工程学院,江苏 南京 210003)
当前,汞污染防治形势严峻,保守估计全球约有800万人面临汞污染威胁[1]。汞及其化合物会对口腔、肝、肾及神经系统造成严重损害[2-5]。水体中的汞离子(Hg2+)经过微生物作用转化为甲基汞[6-7],在水生生物中富集并最终通过食物链传递给人体,对人类健康造成严重威胁。2007年,Sunderland[8]指出,美国90%以上汞污染威胁来自于水产品,伊拉克及日本也都曾爆发过大规模水俣病。由此可见,监测水体中Hg2+含量在防控汞污染、避免汞中毒方面具有重要意义。
常见的Hg2+检测方法有原子吸收光谱法[9-10]、原子荧光光谱法(AFS)[11]、质谱法[12]、高效液相色谱法[13]等,这些方法多数需要精密昂贵的设备,样品处理或检测步骤复杂。基于金属纳米材料的Hg2+检测方法,如比色法[14-15]、荧光法[16]、电化学法[17]、表面增强拉曼光谱法(SERS)[18-19]等,普遍具有检测设备要求较低、样品处理相对简单等优势,逐渐成为快速检测Hg2+的新方法;但传感器的制备需先合成纳米粒子,再在其表面修饰探针分子,探针分子不仅价格昂贵而且修饰时间过长,修饰过程中还会使用有毒化学试剂,对环境造成二次污染。如Kandjani等[20]以ZnO/Ag为SERS基底提出了一种快速检测痕量Hg2+的方法,其中的拉曼信号分子罗丹明B被认为具有致癌作用[21]。因此,开发一种相对环保、便捷、灵敏的Hg2+检测方法具有重要的实用意义。
纳米银(Ag NPs)广泛应用于医疗抗菌、光电池制造、分析检测等领域[22-26]。传统的Ag NPs合成方法因为使用有毒化学试剂、高成本和能源需求等受到限制[27]。Mukherjee等[28]、Kim等[29]提出利用微生物、植物提取物或天然聚合物等替代有毒化学试剂合成Ag NPs。Roy等[30]指出,Ag NPs表面的植物提取物可为Ag NPs提供天然的保护剂,使Ag NPs@植物提取物具有良好的分散性和更强的抗菌性。目前,Ag NPs@植物提取物的应用大多集中在抗菌和药用领域,在检测Hg2+方面的报道还较少。基于此,作者以陈皮提取物为还原剂和表面保护剂,一步法合成Ag NPs@陈皮,采用紫外可见吸收光谱、透射电镜及X-射线衍射等对其进行表征,并将Ag NPs@陈皮作为Hg2+传感探针,采用比色法检测水体中Hg2+,拟为Hg2+快速、便捷、环保检测提供一种新方法。
1 实验
1.1 材料、试剂与仪器
陈皮(PericarpiumCitriReticulatae,PCR),江苏先声药业有限公司。
Hg(NO3)2标准溶液(1 mg·mL-1)、AgNO3,阿拉丁;NaCl、ZnCl2、Cu(NO3)2、KCl、CaCl2·2H2O、MgCl2·6H2O、MnCl2·4H2O、FeCl3·6H2O、CoCl2·6H2O、NiCl2·6H2O等均为分析纯,国药集团化学试剂有限公司;实验用水为三级纯水(9.5 MΩ·cm)。
BSA-124S型电子天平,德国Sartorius公司;DF-101S型集热式磁力搅拌器,上海力辰邦西仪器科技有限公司;759MC型双光束紫外可见分光光度计,上海菁华科技仪器有限公司;H-7500型透射电子显微镜,日本Hitachi公司;D8 Advance型X-射线粉末衍射仪,德国Bruker AXS公司;Zeta PALS型电位分析仪,美国Brookhaven公司。
1.2 Ag NPs@陈皮的合成
将陈皮用纯水洗净、烘干、粉碎,过40目筛,得陈皮粉末。称取5 g陈皮粉末,加入200 mL纯水,超声振荡10 min后,置于95 ℃水浴中恒温保持10 min,取出,用G4砂芯漏斗抽滤2遍,去除滤渣,即得陈皮提取液。
将陈皮提取液用纯水稀释,快速加入AgNO3溶液(100 mmol·L-1),80 ℃下磁力搅拌2 min后,静置反应3 h,溶液颜色逐渐由浅黄色变为橘黄色最终变为棕褐色,10 000 r·min-1离心15 min,弃上清液,即得Ag NPs@陈皮,用纯水再分散,置于4 ℃冰箱中保存,备用。
1.3 Hg2+的检测
在3 675 μL含Hg2+水样中依次加入225 μL NaCl溶液(0.1 mol·L-1)和600 μL Ag NPs@陈皮,混匀后静置反应5 min,采用紫外可见分光光度计测定水样在408 nm处的吸光度,按下式计算含Hg2+水样吸光度变化百分比Ic(%):
式中:I0为不含Hg2+水样的吸光度;I为含Hg2+水样的吸光度。
2 结果与讨论
2.1 Ag NPs@陈皮的表征(图1)

图1 Ag NPs@陈皮合成前后的UV-Vis吸收光谱(a),Ag NPs@陈皮合成过程中的颜色变化照片(b),Ag NPs@陈皮的TEM照片(c)及XRD图谱(d)
从图1a可以看出,AgNO3溶液和陈皮提取液在408 nm处没有吸收峰,而Ag NPs@陈皮在408 nm处有吸收峰。
从图1b可以看出,将AgNO3溶液与陈皮提取液混合反应,溶液颜色从透明、浅黄色、橘黄色到棕褐色逐渐加深。
从图1c可以看出,合成的Ag NPs@陈皮呈分散分布,形状近似球形,粒径为(39.35±0.83)nm。Zeta电位表征结果显示,Ag NPs@陈皮颗粒表面电位为(-132.64±11.13)mV,颗粒相互之间具有较大的静电斥力,可以有效避免颗粒聚集,提高颗粒稳定性。
从图1d可以看出,Ag NPs@陈皮的衍射峰位置与标准卡片(JCPDS No.87-0720)一致,分别归属于Ag的(111)、(200)、(220)、(311)晶面,属于多晶纳米颗粒[31]。表明Ag NPs@陈皮具有面心立方结构。
Li等[32]利用辣椒植株(CapsicumannuumL.)叶片提取物一步法合成Ag NPs,并采用循环伏安法对辣椒植株叶片提取物进行表征,证明了提取物中富含多种还原性物质,使得Ag+可以被还原成Ag,并进一步成核生长。与此类似,陈皮提取物中富含类黄酮、可溶性酚酸及醇等多种物质,这些物质部分具有还原性[33]。因此,可以推测Ag NPs@陈皮的合成过程为:部分Ag+通过静电作用吸附到陈皮提取物有效成分表面,加热后,Ag+被还原性物质还原成 Ag,并进一步生长为Ag NPs。由于Ag NPs表面附着带负电的陈皮提取物,停止加热后,Ag NPs之间的静电斥力作用阻止了Ag NPs颗粒之间的进一步聚集长大。
2.2 Hg2+的检测原理
目前,多数绿色合成的Ag NPs对Hg2+的检测原理尚无定论,常见的推论认为:Ag+/Ag标准电极电位(0.80 V)与Hg2+/Hg标准电极电位(0.85 V)存在差异,使得Hg2+可以在Ag NPs表面发生氧化还原反应,Hg2+被还原为Hg,Ag被氧化为Ag+,Ag NPs粒径减小,随后Hg在Ag NPs表面形成汞齐,逐渐形成Ag@Hg NPs[34]。由于Hg是无色的,因此可以观察到颗粒胶体颜色消失,Ag NPs的吸收强度下降,吸收峰蓝移。在本实验中,随着加入的Hg2+浓度升高,Ag NPs@陈皮胶体颜色由棕褐色逐渐变浅直至透明,吸收峰发生蓝移,吸收强度降低;同时胶体颗粒表面电位大幅度提升,由(-132.64±11.13)mV升至(-34.34±7.40)mV。此外,与Ag NPs@陈皮相比,用艾叶、红叶石楠、枸杞等植物提取物合成的Ag NPs对于同等浓度的Hg2+则无上述实验现象,可以推测,Ag NPs@陈皮对Hg2+有特异性的识别作用。因此,Ag NPs@陈皮对Hg2+的检测原理(图2)可能为:Hg2+通过静电吸引、形成有机金属配合物而被Ag NPs表面的陈皮提取物捕获,同时陈皮提取物可以促进Hg2+和Ag NPs表面间的静电-离子吸引,促进Hg2+和AgNPs之间发生氧化还原反应,使得Ag NPs的吸收强度下降,且Ic与Hg2+浓度有关。

图2 Ag NPs@陈皮检测Hg2+的原理示意图
2.3 Hg2+标准曲线的绘制
将Hg2+标准溶液(1 mg·mL-1)用纯水稀释成不同浓度的Hg2+溶液,按1.3方法制成水样,其UV-Vis吸收光谱及对应Ic如图3所示,其中图3b中插图为0.01~20 μmol·L-1范围内(lgcHg2+)5/2与Ic的校正曲线。
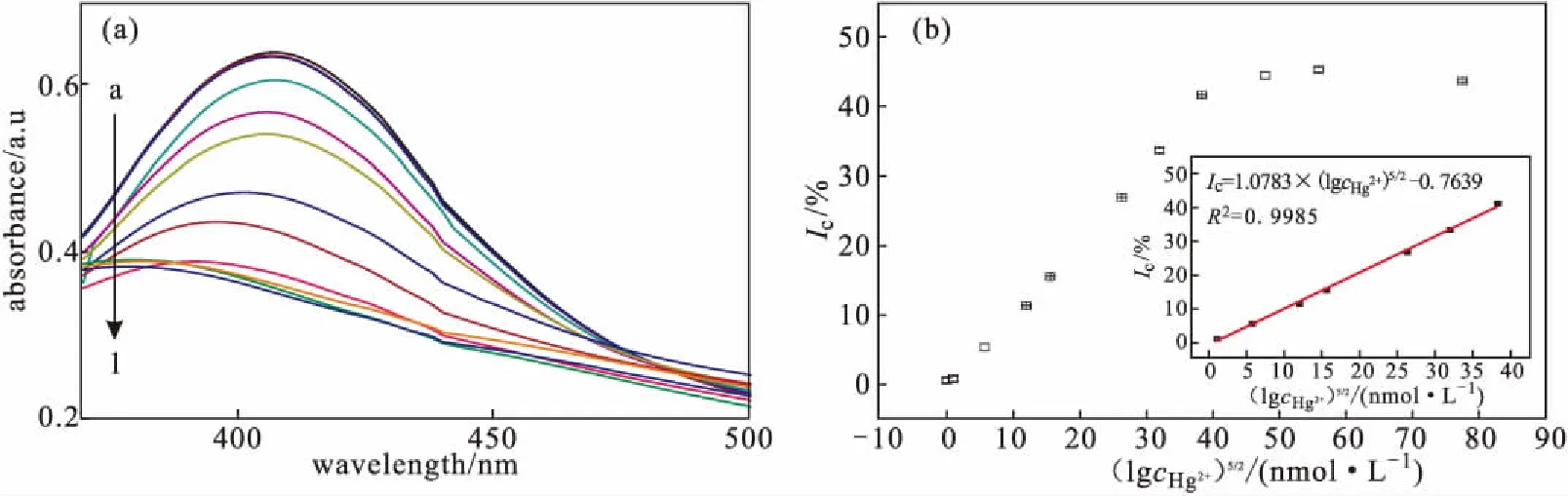
a~l,Hg2+浓度(μmol·L-1):0、0.001、0.01、0.1、0.5、1、5、10、20、50、100、500
从图3a可以看出,Hg2+浓度在0.01~20 μmol·L-1范围内,Ag NPs@陈皮在408 nm处的吸光度随着Hg2+浓度的升高而逐渐降低;当Hg2+浓度超过20 μmol·L-1后,吸光度下降幅度保持约为45%,不再进一步下降,吸收峰蓝移明显,此时Ag NPs@陈皮已不能对高浓度Hg2+有所响应,溶液颜色由橘黄色快速变为浅黄接近透明。以(lgcHg2+)5/2为横坐标、Ic为纵坐标绘制标准曲线(图3 b),Hg2+浓度在0.010~20 μmol·L-1范围内时,(lgcHg2+)5/2与Ic存在良好的线性关系:Ic= 1.0783×(lgcHg2+)5/2-0.7639(R2=0.9985),检出限为8.93 nmol·L-1(S/N=3)。
2.4 Hg2+检测的选择性
为了验证所述检测方法是否易受其它离子的干扰,分别检测了含有1 μmol·L-1Ca2+、Mn2+、Cu2+、Zn2+、Ba2+、Co2+、Fe3+、Ni2+、Hg2+水样以及9种离子混合水样,结果如图4所示。

图4 Ag NPs@陈皮对Hg2+检测的选择性
从图4可以看出,Ca2+和Mn2+分别造成1.46%、1.41%的信号上升,其余离子对于信号的影响小于±1%,而Hg2+水样及离子混合水样中的Hg2+分别引起15.08%和14.97%的信号下降,与其它离子所产生的结果区别明显,表明其它离子对Ag NPs@陈皮检测Hg2+无明显干扰。
2.5 实际水样的检测
取南京外秦淮河铁心桥段河水,用孔径12.5 μm砂芯漏斗抽滤一次,去除水中较大的不溶性杂质,不做其它任何处理。向河水水样中分别加入浓度(nmol·L-1)为0、50、1 000的Hg2+标准溶液,混匀后,对水样进行检测,结果见表1。
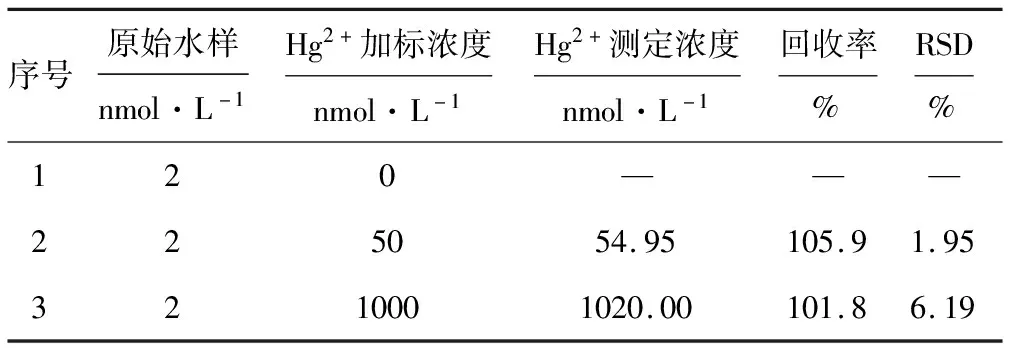
表1 Hg2+的加标回收率
从表1可知,Hg2+加标回收率在101.8%~105.9%之间,RSD小于7%。表明该方法在实际环境水体检测中具有实用性和推广应用的潜力。
3 结论
以陈皮提取物为还原剂和表面保护剂,一步法合成Ag NPs@陈皮,采用紫外可见吸收光谱、透射电镜及X-射线衍射等对其进行表征,并将Ag NPs@陈皮作为Hg2+传感探针,采用比色法检测水体中Hg2+。结果表明,Ag NPs@陈皮具有面心立方结构,呈分散分布,形状近似球形,粒径为(39.35±0.83)nm。Ag NPs@陈皮可特异性识别Hg2+,Hg2+浓度在0.010~20 μmol·L-1范围内,Ag NPs@陈皮在408 nm处的Ic与(lgcHg2+)5/2呈良好的线性关系,检出限为8.93 nmol·L-1(S/N=3)。河水水样Hg2+加标回收率在101.8%~105.9%之间(n=3),RSD小于7%。该方法中陈皮提取物起到Ag+还原剂、Ag NPs保护剂和Hg2+识别探针三重作用,极大地精简了Hg2+探针构建步骤,减少有毒化学试剂使用,降低了Hg2+检测成本,为Hg2+检测提供了一种快速、便捷且相对环保的新方法。

