肺癌患者TAP表达水平与其预后的相关性
刘 哲,郝媛媛,卢 畅
(辽阳市中心医院 肿瘤内科,辽宁 辽阳111000)
肺癌是一种发病率及死亡率极高的恶性肿瘤,其中非小细胞肺癌最为常见,超过 80%,严重威胁患者生命健康[1-3]。尽管胸腔镜根治术、放化疗在肺癌治疗中的应用广泛,而临床上诊治肺癌的效果及预后尽不相同,肺癌患者长期生存率、生存质量远低于健康者[4]。肿瘤异常蛋白(TAP)在多种恶性肿瘤细胞中均有表达[5],而有关其与肺癌患者预后相关性尚不明确。因此,本研究旨在探讨肺癌患者TAP表达水平与患者临床病理特征参数及预后的相关性,现报道如下。
1 资料与方法
1.1 一般资料
随机选取2016年1月-2018年6月于我院接受治疗的73例肺癌患者为研究组,于术前进行TAP检测。纳入标准:①术前一般情况稳定,手术可耐受;②术前未经放化疗治疗者;③经组织病理学分析确诊为肺癌者;④临床各项检查资料完整者;⑤自愿签署知情同意书者。排除标准:①合并心、肝、肾等器官病变者;②严重感染性疾病者;③合并造血系统疾病者;④合并其他肿瘤者;⑤合并免疫系统疾病者;⑥远处转移者;⑦因临床上针对肿瘤TNM分期系统中Ⅰ-Ⅲa期与Ⅲb-Ⅳ期者治疗原则不同,而排除Ⅲb-Ⅳ期者;⑧临床资料不全者。随机选取同期接受体检的自愿者40例为健康对照组,本研究已获得医院伦理会员会批准。研究组男53例,女20例;年龄35-80岁,平均年龄(63.52±8.17)岁,年龄<60岁者23例,≥60岁者50例;TNM分期:Ⅰ-Ⅱ期49例,Ⅲa期24例;淋巴结转移45例;病理类型:肺腺癌51例,肺鳞癌15例,小细胞肺癌7例。健康对照组28例,女12例,年龄34-81岁,平均年龄(63.21±8.04)岁。两组对象性别、年龄比较差异不显著(P均>0.05),具有可比性。
1.2 TAP检测方法
清晨取患者及健康者外周静脉血25 μl,制作成3个血涂片后自然晾干。将TAP凝聚助剂(购自于浙江瑞生医疗科技有限公司)摇匀、静置10 min,用胶头滴管吸取上清液,往晾干了的血涂片上滴加3滴试剂,静置干燥2 h(18-25℃),使用TAP检测系统图像分析仪(购自于浙江紫荆生物技术有限公司)测定TAP凝聚颗粒。
1.3 评价标准
显微镜下观察血涂片可见淡绿色、淡黄色或棕黄色不规则原型晶型颗粒,颗粒中心呈淡亮色,且有屈光性,四周为棕黑色或墨绿色混合物且较多,则判定为TAP表达阳性。TAP凝聚物面积<121 μm2,为无明显凝聚物,判断为阴性表达;TAP凝聚面积121-225 μm2,为凝聚物较小,判断为阳性表达;TAP凝聚面积>225 μm2,为凝聚物较大,判断为阳性表达[6]。
1.4 随访
对73例行肺癌根治术患者进行个人电话随访及医院病历系统随访,随访截止时间为2020年6月。观察终点为疾病发展,以无进展生存(PFS)进行预后判断,PFS时间定义为从确诊进行根治术后至疾病进展或因死亡的时间。
1.5 统计学方法
2 结果
2.1 不同组TAP表达情况
研究组TAP凝聚面积显著大于对照组,差异有统计学意义(P<0.05);研究组患者肺癌组织中TAP阳性表达率为63.01%,显著高于健康对照组5.00%,差异有统计学意义(P<0.05),见表1。
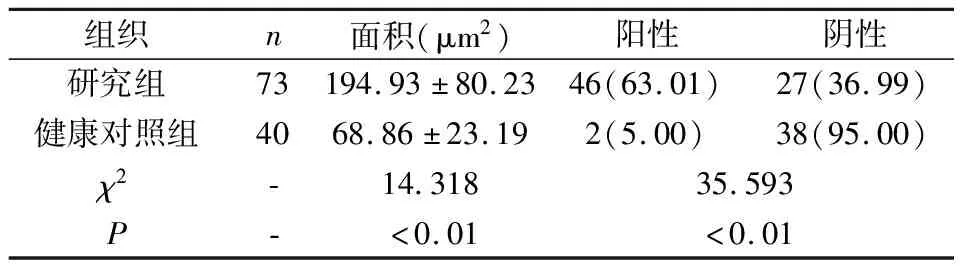
表1 不同组TAP表达情况
2.2 TAP在肺癌组织中表达水平与患者一般资料相关性分析
分析肺癌患者一般资料对TAP在肺癌组织中表达水平的影响,研究结果表明,TNM分期、淋巴结转移与TAP表达有关(P<0.05),而与其他临床病理特征参数无相关性,见表2。
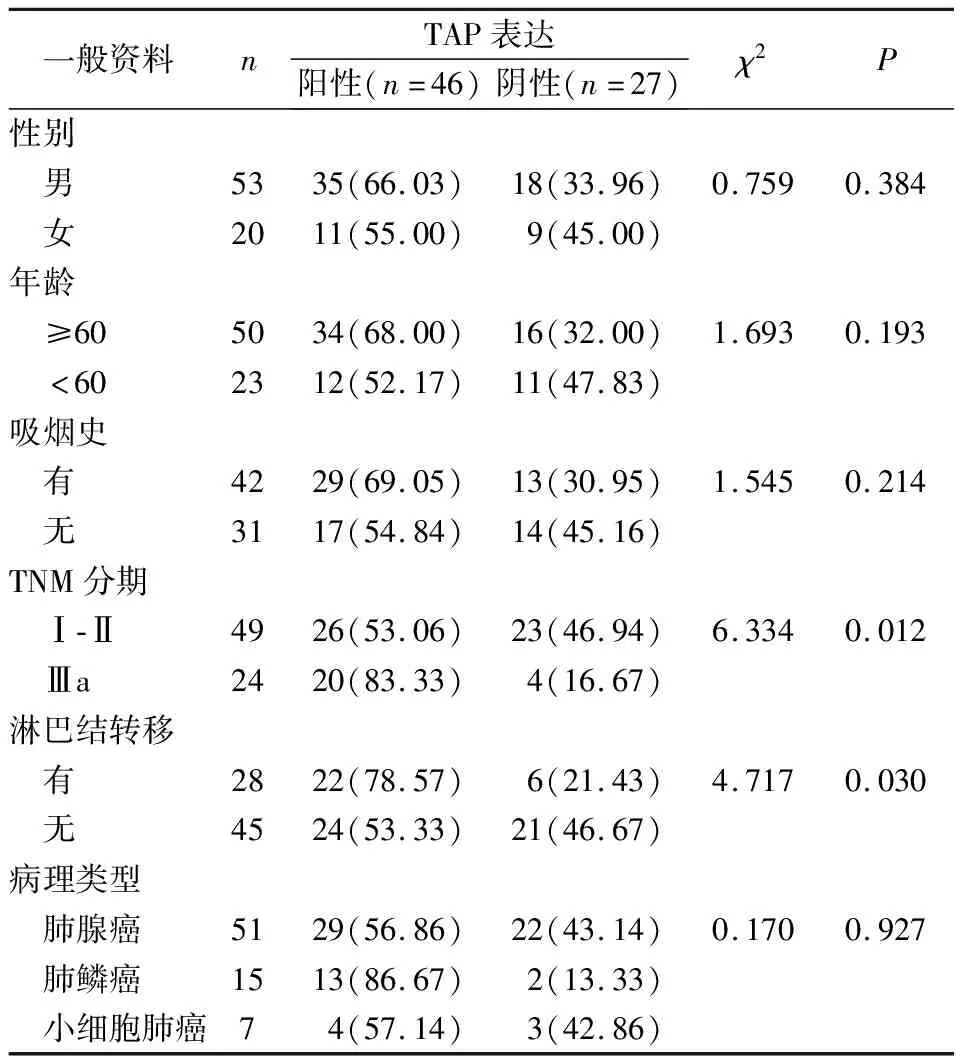
表2 TAP在肺癌组织中表达水平与患者一般资料相关性
2.3 TAP表达水平与肺癌术后患者预后的关系
截止2020年6月,73例患者3年生存率为60.27%,TAP阳性表达患者3年生存率为56.52%,阴性表达患者3年生存率为66.67%。通过Kaplan-Meier方法分析结果后显示,患者TAP阳性表达组预后差于阴性表达组,Log-rank检验,P值为0.037,见表3。

表3 TAP表达水平与肺癌术后患者预后的关系
3 讨论
肺癌早期无明显症状,容易被忽视,早期诊断率低,其发病率死亡率居各种肿瘤首位[7]。我国老龄化人群越来越多,肺癌的发生率呈逐渐上升趋势,而老年人多含有慢性疾病,使得某些肿瘤相关诊断指标敏感度不高。随着医疗水平提升,对肺癌综合性治疗如手术治疗、放化疗等虽已大幅度改善,但肺癌患者总生存率仍未超过20%,流行病学显示我国肺癌患者在确诊时有超过75% 的患者已发生转移[8],因而需寻找新的肿瘤预后标志物。TAP是正常细胞恶化所产生的具有共同特征的异常糖链糖蛋白,可释放进入外周血,已在肝癌、肺癌、乳腺癌等原发性癌症患者中检测到其表达,且对恶性肿瘤及癌变前的检测均具有较高的敏感性及特异性[9,10]。黄婷婷等[4]研究结果显示,伴胸水及远处转移的肺癌患者阳性表达率显著高于不伴胸水及无远处转移者,而与其他临床特征参数无关。徐瑞彤等[11]研究结果显示,Ⅲ+Ⅳ肺癌患者的TAP阳性表达率明显高于Ⅰ+Ⅱ期肺癌患者,但与性别、年龄、组织学分型等无关。同时还有研究显示,TAP与Ki-67参与了非小细胞肺癌的发生发展,且影响患者的生存状况[12],此与本研究结果部分一致。较多的研究数据表明肺癌与TAP表达水平存在必然联系,但是否表明TAP是影响肺癌复发转移的直接因素,目前临床数据仍不完善。
TAP检测技术在1个反应体系中对多种异常糖链糖蛋白进行综合检测,在TAP助凝剂下可形成特殊形状的晶型颗粒,接着测量凝聚面积,其为组合标志物检测,可提高肿瘤检出率[11]。本研究通过TAP检测技术对肺癌患者及健康对照者进行TAP表达水平检测,结果证实肺癌患者TAP阳表达率显著高于健康对照组,提示TAP的表达与肺癌组织之间存在一定关系,可能参与肿瘤的发生发展。本研究对肺癌患者TAP表达水平与性别、年龄、吸烟、TNM分期、淋巴结转移、病理类型等临床病理特征参数进行分析,结果显示TAP表达水平与患者的性别、年龄、吸烟、病理类型无明显相关性,而TNM分期及是否淋巴结转移的肺癌患者TAP表达水平有显著差异,提示肺癌患者TAP表达与TNM分期及淋巴结转移存在一定相关性,此与某些研究结论不完全一致[4],可能与纳入的样本差异有关。同时,本研究预后分析结果显示,73例患者3年生存率为60.27%,TAP阳性表达患者3年生存率为56.52%,阴性表达患者3年生存率为66.67%,患者TAP阳性表达组预后差于阴性表达组,提示TAP表达水平可有效反映术后肿瘤的控制情况,可用作预后评估指标。
综上所述,本研究通过观察TAP在肺癌患者外周血中的表达水平,发现TAP的表达与TNM分期、有无淋巴结转移有关,阳性表达组预后差于阴性表达组,可作为预后评估指标。但由于本次研究因纳入样本量偏小而存在不足,有待进一步增加样本量加以研究。

