腹腔镜下右半结肠切除术尾侧联合中间入路与中间入路的疗效比较
蒋雪峰 肖宝来 孙以民 谢建平 熊派 胡小苗 向进见
结肠癌在我国的发病逐年增加,已成为发病率第三、死亡率第四的常见多发肿瘤[1]。自1990年Jacobs开展世界首例腹腔镜辅助右半结肠切除术以来,腹腔镜结直肠癌手术在国内外广泛开展,成为腹腔镜结直肠外科较成熟的手术方式[2-3]。因为右半结肠与邻近组织器官关系密切,血管变异多,术中操作易致器官损伤和出血,故腹腔镜下右半结肠手术是一种难度较大的手术。如何利用右半结肠天然的外科平面,采用合适的手术入路使手术操作相对简单,从而减少出血,避免损伤?外科医生对此不断探索手术方式和改良入路[4-5]。荆州市第一人民医院胃肠外科在传统腹腔镜右半结肠中间入路的基础上,于2015年3月至2018年9月行尾侧联合中间入路及中间入路腹腔镜下右半结肠癌根治术109例,现将临床资料进行对比并总结报道如下。
资料与方法
一、一般资料
本研究的对象是比较手术入路,两种入路在肿瘤的根治原则及淋巴结清扫范围理论上一致。经医院伦理委员会审核同意,将2015年3月至2018年9月在长江大学附属第一医院收治的109例右半结肠癌根治术作为研究对象,采用前瞻性随机对照研究的方法将其分为尾侧联合中间入路组(观察组)和中间入路组(对照组),比较两种入路的近期疗效并进行分析。观察组56例,男36例,女20例,年龄(53.5±15.6)岁;对照组53例,男35例,女18例,年龄(56.3±12.6)岁;两组患者纳入标准:肿瘤位于右半结肠,术前肠镜及病理检查均明确为结肠癌;肿瘤局限于肠壁,未侵犯后腹膜及周围脏器。排除标准:肿瘤广泛浸润;有肝、肺等远处转移;合并肠梗阻、腹部手术史,腹腔广泛粘连,无法行腹腔镜手术探查。两组患者性别、年龄、BMI、术前TNM分期及肿瘤部位等一般资料经比较差异无统计学意义(均P>0.05)。见表1。
二、手术方法
1. 尾侧联合中间入路组:(1)患者取仰卧分腿,采用5孔Trocar穿刺,脐下约5 cm置10 mm Trocar为观察孔,左锁骨中线下约2 cm置12 mm Trocar为主操作孔,左下腹反麦氏点置5 mm Trocar为辅助操作孔,右侧腹相对称部位置2个5 mm Trocar为助手辅助操作孔。头低脚高约30°,左侧倾斜15°,将大网膜翻向肝胃之间,小肠移至左上腹,以回盲部为指引充分显露回肠系膜根部与后腹膜的“黄白交界线”,见图1;打开小肠系膜根部进入融合筋膜间隙,采用“挑拨离间”的手术技巧充分向头侧、内侧拓展筋膜间隙,见图2;上部显露十二指肠及胰头部,内侧至肠系膜上静脉后方左侧并留置纱条标识,外侧一直拓展至右结肠旁沟腹膜返折,见图3;(2)将回肠翻转回归右中下腹,显露肠系膜上静脉投影,于回结肠血管嵴下方打开腹膜,并与已游离的右结肠后间隙贯通,由尾侧向头侧解剖显露肠系膜上静脉外科干处理回结肠及中结肠血管,见图4、5;(3)调整体位头高足低,于胃网膜血管弓外(扩大右半时行胃网膜血管弓内切除)离断胃结肠韧带进入小网膜囊,沿胃胰皱襞处分离胃与横结肠系膜,于右横结肠系膜根部后方游离进入横结肠后间隙并与已游离的胰十二指肠前间隙贯通;向右侧处理肝结肠韧带及升结肠侧韧带完成结肠肝曲及升结肠的游离,见图6;(4)取上腹正中切口取出标本行右半结肠切除、回肠横结肠吻合,注意小肠系膜是否扭转。
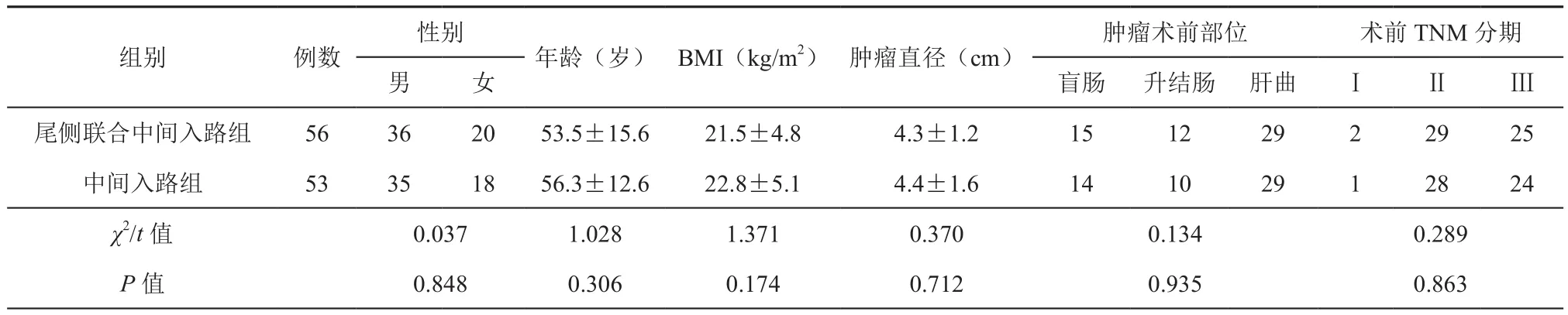
表1 两组患者一般资料比较
2. 中间入路组:(1)患者取与尾侧入路相同体位及Trocar布局。于内侧后腹膜回结肠血管投影下缘切开进入右Toldt间隙并向右侧及头侧扩展;(2)于肠系膜上动脉左缘分别处理回结肠、右结肠及中结肠血管行D3淋巴结清扫;(3)调整为头高足低位,离断胃结肠及肝结肠韧带,游离右半结肠外侧;(4)取上腹正中切口取出标本,行肠切除吻合。
三、观察指标:(1)手术相关指标,包括手术时间、术中出血量、清扫淋巴结数目;(2)术后恢复指标:胃肠道功能恢复时间、术后住院时间;(3)并发症发生情况。
四、统计学分析
采用SPSS 19.0软件包进行数据统计学分析。计量资料采用均数±标准差(±s)来统计描述,行t检验进行数据分析;计数资料采用相对数进行统计描述,运用Fisher's精确检验进行数据分析。P<0.05表示差异有统计学意义。
结 果
一、两组患者手术效果指标比较
研究发现,尾侧联合中间入路组的手术时间及术中出血量均少于中间入路组,差异有统计学意义(t=4.833,5.885;P<0.05);两组淋巴结清扫数差异无统计学意义(t=0.915,P>0.05);两组中转开腹各1例,差异无统计学意义(P>0.05);具体资料见表2。
二、两组患者术后恢复情况比较
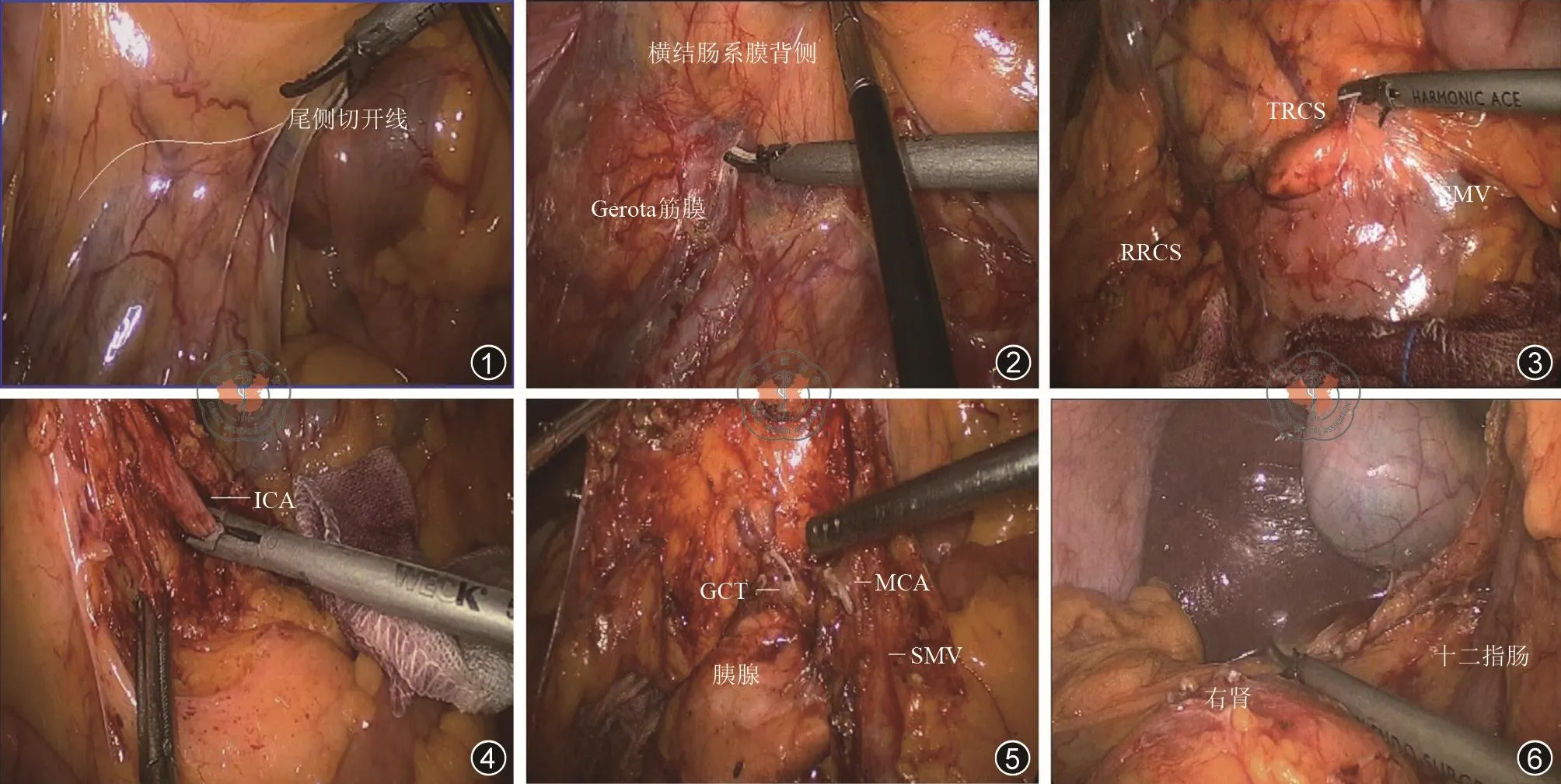
图1 尾侧入路切开线 图2 扩展右结肠后间隙 图3 扩展横结肠后胰十二指肠前间隙 图4 中间入路处理回结肠血管图5 裸化肠系膜上静脉,清扫淋巴结 图6 头侧完成结肠肝曲及升结肠的游离。TRCS:横结肠后间隙,RRCS:右结肠后间隙,SMV:肠系膜上静脉,ICA:回结肠动脉,GCT:胃结肠静脉干,MCA:结肠中动脉
表2 两组患者术中情况比较(±s)
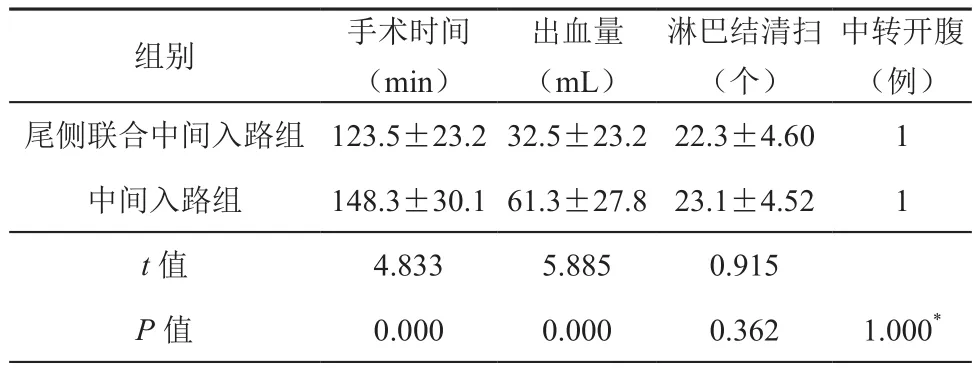
表2 两组患者术中情况比较(±s)
注:*Fisher's精确检验
淋巴结清扫(个)组别 手术时间(min)出血量(mL)中转开腹(例)尾侧联合中间入路组 123.5±23.2 32.5±23.2 22.3±4.60 1中间入路组 148.3±30.1 61.3±27.8 23.1±4.52 1 t值 4.833 5.885 0.915 P值 0.000 0.000 0.362 1.000*
研究发现,尾侧联合中间入路组和中间入路组两组患者术后肛门排气时间分别为(3.59±0.66)d及(3.62±0.62)d,进食流质时间分别为(4.16±0.72)d及(4.22±0.65)d,术后住院时间分别(9.27±2.10)d及(9.73±2.40)d,差异无统计学意义(t=1.016,0.875,0.425,P>0.05);两组患者均无围手术期死亡病例;尾侧联合入路组腹腔感染1例,肠梗阻1例,中间入路组切口感染1例,吻合口漏1例,差异无统计学意义(P>0.05)。具体资料见表3。
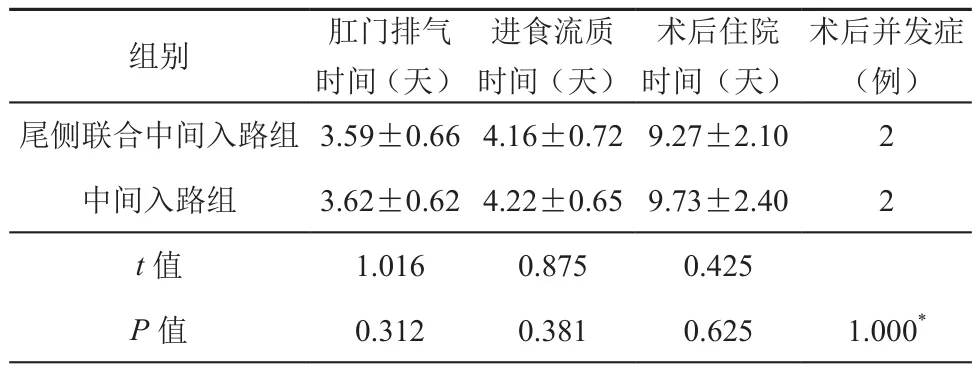
表3 两组患者术后恢复情况比较
讨 论
结肠肿瘤发病率在我国有逐年增高趋势,2018年中国国家癌症中心全国癌症统计数据显示,我国结直肠癌每年新发病例约37万例[6]。近20余年来腹腔镜技术在结肠肿瘤中的应用发展迅猛,各种新术式新技术不断出现;与开腹手术比较,腹腔镜结肠手术具有微创、疗效好、恢复快等优势,大量循证医学证据表明腹腔镜手术已经成为结肠根治术的首选[7]。美国国家综合癌症网络(NCCN)于2006年就在指南中推荐开展腹腔镜结肠癌手术。随着Hohenberger的完全结肠系膜切除(complete mesocolic excision,CME)理念的提出与推广,对降低结肠肿瘤术后复发率、提高5年生存率、规范手术方式产生了极大作用,CME D3手术作为结肠手术规范已成为共识[8-9]。目前腹腔镜手术治疗的微创理念已不是主要目的,重要的是更规范标准地完成肿瘤根治手术,提高患者长期生存率[10]。
腹腔镜右半结肠癌根治手术较为复杂并有一定的手术风险,CME能否在腹腔镜下顺利完成,除腹腔镜手术本身的局限性外还需术者熟练掌握手术技巧;对于如何进行淋巴结的彻底清扫、正确辩识解剖层次、避免术中血管(或)肠管等组织的副损伤,合理便捷的手术入路等均是结直肠医师关注和研究的热点。传统中间入路已经得到广泛推广应用,邹瞭南等[11]报道尾侧入路行腹腔镜右半结肠切除亦具有一定优势,尾侧入路同样可以坚持由远及近,非直接接触肿瘤同样符合肿瘤根治原则,尾侧容易进入Toldt间隙,避免中间入路寻找间隙困难时有破坏系膜完整性的风险。对于血管变异(Henle干及属支、RCV/A、MCV/A)较多及因淋巴结融合处理困难的胰头前方,应层面优先,从背侧及头侧提前准备,为处理困难血管时提供解剖标志,易于辨认血管,降低手术难度。本临床研究就存在一定争议的腹腔镜下右半结肠根治术(CME)的不同手术入路的优劣势作了一定探索。
右半结肠手术的天然外科平面分别是位于回盲部、盲肠、升结肠、结肠肝曲及其系膜与肾前筋膜之间的右结肠后间隙(Toldt间隙),位于横结肠右侧与十二指肠降部和胰头前方间的横结肠后间隙,位于横结肠系膜与胃后系膜间的融合筋膜间隙[12]。术中维持正确的外科平面对保持筋膜间隙完整性,进而减少出血及腹膜后重要结构的损伤至关重要。如何快速准确地进入解剖平面并显露肠系膜上动脉外科干及血管分支是手术的关键。腹腔镜下中间入路行右半结肠CME手术作为一传统经典术式,其优点是先处理血管再处理肠管,首先不接触挤压肿瘤(NO TOUCH),降低了肿瘤细胞播散的可能性,可做到无瘤原则,故中间入路目前被认为是较符合肿瘤学原则的手术入路方式。但该术式在实践中也存在如下不足:(1)右半结肠血管变异较大,中间入路在进入Toldt间隙的解剖过程中容易进入错误间隙,导致输尿管生殖血管及肾前筋膜等后腹膜器官损伤出血及结肠系膜完整性遭到破坏;(2)右半结肠CME的难点在于Henle干及胰头表面血管的处理,而Henle干的解剖及显露常较困难,中间入路从十二指肠水平到胰头前间隙的解剖容易误伤Henle干及误入胰腺组织内导致出血及视野不清;(3)对于肥胖患者,中间入路难以进入正确层面,解剖层次不清易导致出血及操作困难;(4)中间入路操作的复杂性使得术者学习曲线较长,同时对助手的要求也更高。尾侧入路以小肠系膜根和后腹膜的“黄白交界线”为入口,切开后便可直接进入升结肠后方的融合筋膜间隙(右Toldt间隙),无论患者肥胖与否都不易走错平面,无需刻意寻找而是顺势进入Toldt间隙,从而降低手术的难度。尾侧入路进入融合筋膜间隙后以肠系膜上血管为中心,由尾侧至头侧先解剖其后方,再由中间入路从尾侧向头侧逐步解剖它的前方,从而达到游离与根治的目的。尾侧入路首先进入融合筋膜间隙,为下一步处理肠系膜上血管的属支做好了准备,降低了手术中最难处理的血管部分的难度及风险;即使出现了血管的损伤及出血,也会因暴露更清楚,处理更加方便,可避免肠系膜静脉主干的损伤。本研究尾侧联合中间入路组的手术时间、出血量均少于中间入路组,得益于能迅速进入融合筋膜间隙,快速准确处理血管有关问题。另外,对于肿瘤较大,肿瘤是否可根治性切除尚不明确的患者选择尾侧入路可使术者在离断区域血供前了解肿瘤与局部组织的关系,从而进行完整充分的手术评估;同时侧方入路对助手的要求相比中间入路相对较低。本研究对尾侧入路与中间入路及头侧入路联合应用,对部分肿瘤位于十二指肠降部附近的患者首先采用尾侧入路分离Toldts间隙后再于胰头上方置放纱条,然后取头侧入路解剖横结肠后间隙与下方的Toldts间隙贯通,可以更好地避免胰头区Henle干等重要血管的损伤,同时,尾侧联合中间入路组行侧方入路时并不完全切除升结肠侧方腹膜(Toldt线),利用其天然牵引固定作用帮助术中的显露。
鉴于各手术入路的特点及优劣势,目前最佳方式尚无明确定论的情况下[13-14],本研究提示需根据患者情况、术者经验、团队配合等综合因素进行评估,从而选择较为合适的手术方式。本组前瞻随机对照研究显示,两组入路法均是有效手术方式,均可安全有效地达到肿瘤根治目的。尾侧联合中间入路法较中间入路明显缩短手术时间、减少出血量,手术安全性更高,值得在临床上推广应用。但操作过程并非一成不变,尾侧联合中间入路及中间入路和头侧入路需灵活联合应用,术者在熟练掌握中间入路手术操作的技能后应积极采用尾侧联合中间入路法腹腔镜右半切除术,可进一步提高手术效率及增加手术的安全性。

