基于权重基因共表达分析的结肠癌肝转移相关基因挖掘与验证
高博 陈卓妙语 王秋生
结肠癌是一种常见的消化道恶性肿瘤,男性结肠癌发病率居常见恶性肿瘤的第三位,女性居第二位[1]。约9%的癌症相关死亡由结直肠癌所致[2]。结肠癌肝转移是造成结肠癌高致死率的重要原因之一。流行病学调查显示,15%~25%的患者在确诊时已出现肝转移,而另有15%~25%的患者在切除原发病变后发生肝转移,其中大部分肝转移灶已无法行根治性切除[3]。因此,研究清楚结肠癌肝转移的发生机制,以及寻找有效的抗结肠癌肝转移治疗新靶点迫在眉睫。
经典的肿瘤转移机制共识之一是肿瘤在发生发展的过程中,原发肿瘤内的部分细胞会发生转移相关基因突变,当突变积累到一定程度后,这些细胞进而获得转移能力。随后,经过局部浸润,血管外渗等过程,转移到远处器官[4]。研究表明,这些转移相关基因自身发生改变的同时会通过相互作用来影响其他基因表达,从而形成庞大而复杂的转移相关基因互作网络[5]。如何在转移基因网络中挖掘出具有核心功能的基因节点成为结肠癌肝转移机制研究中的难题。
权重基因共表达网络分析(weighted gene coexpression network,WGCNA)作为一种常用的基因模块化分析技术,已经被广泛应用于鉴定和筛选复杂疾病的分子标志物或药物靶点[6]。本研究利用WGCNA等前沿生物信息学技术筛选出结肠癌肝转移相关基因模块,并利用分子生物学实验鉴定出结肠癌肝转移相关的关键分子叉头框转录因子C1(Forkhead box C1,FOXC1)。这些研究结果为结肠癌肝转移的分子机制研究和临床治疗提供可靠的切入点。
资料与方法
一、基于GEO数据库的结肠癌肝转移数据WGCNA分析
本研究在美国国立卫生研究院基因表达数据库(gene expression omnibus,GEO)中选取了GSE72718作为本次研究的基因样本。该数据集共收录了3组结肠癌患者二代基因测序数据,即(1)非转移性结肠癌组(primary non-metastatic colorectal cancer,PNMCC):包括 10例 10年内未发生转移的结肠癌患者原发灶样本;(2)肝转移结肠癌原发病灶组(primary metastatic colorectal cancer,PMCC):包括9例发生肝转移的结肠癌原发灶样本;(3)肝转移结肠癌转移病灶组(liver metastatic colorectal cancer,LMCC):包括9例与PMCC组配对的结肠癌肝转移灶样本。(如图1所示)。
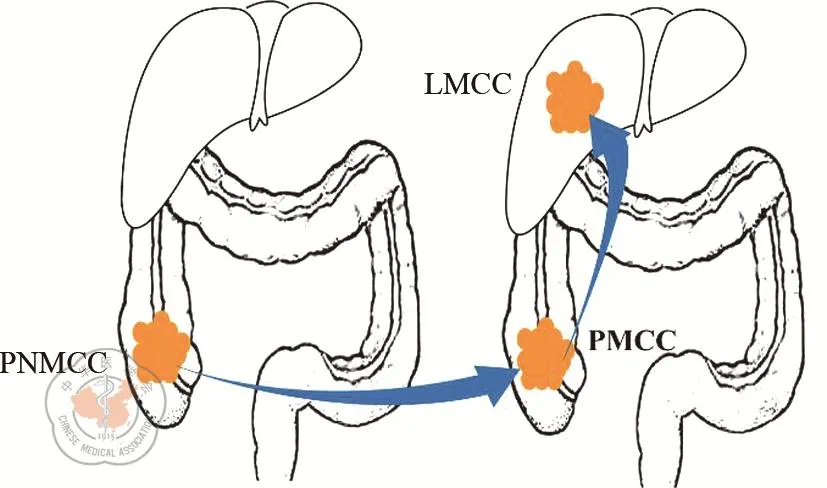
图1 根据结肠癌肝转移进展过程的GSE72718数据集样本分组
基于GSE72718数据集,我们利用R语言的gen filter包过滤掉在三个组别之间的表达差异小于组内的表达差异的基因后进行WGCNA分析。首先,利用WGCNA分析构建基因共表达相关矩阵。共表达矩阵中的元素为基因之间的两两相关系数,即每对基因m与基因n的相关系数为Smn=|cor(m,n)|,据此构成共表达矩阵S=[Smn]。其次,利用幂指数邻接函数amn=power(Smn,β)=|Smn|β作为衡量基因之间关系的指标。根据无尺度网络的原则确定加权系数β,将矩阵S转换成邻接矩阵A=[amn]。然后,构建分层聚类树,聚类树的不同分支代表不同的基因模块。模块识别后,基于分组表型数据,利用t检验计算每个基因在不同组间的基因表达的显著性检验P值,基因显著性(GS)用lgP值表示,再将每个模块的显著性(MS)定义为模块内所包含基因的GS平均值。拥有显著升高MS的模块可能与疾病存在相关关系[6]。
二、结肠癌肝转移相关PPI网络的建立及子模块挖掘
为了进一步探索WGCNA模块中存在的基因互作关系并挖掘模块中的关键基因节点,本研究利用STRING数据库(www. string-db. org)构建了WGCNA模块蛋白互作网络(protein-protein network,PPI),并利用Cytoscape 3.8.0软件绘制可视化网络图。然后,利用Cytoscape MCODE插件挖掘PPI网络中的基因互作子模块。
三、子模块的功能分析
为了了解WGCNA模块及子模块的功能,本研究利用Database for Annotation,Visualization and Integrated Discovery(DAVID)v6.7数据库(www.david.ncifcrf.gov)对结肠癌肝转移WGCNA模块及子模块基因进行功能GO term分析。
四、FOXC1对结直肠癌患者预后的影响
为了了解FOXC1对临床结肠癌患者预后的影响,本研究基于癌症基因图谱(the cancer genome atlas,TCGA)中594例结肠癌样本及其生存时间临床数据,使用cbioportal for Cancer Genomics(www. cbioportal. org)分析了FOXC1差异表达的结肠癌患者和FOXC1正常表达的结肠癌患者之间的生存差异,并绘制生存曲线。
五、细胞培养
人结肠癌细胞系HCT116购于武汉中国典型培养物保藏中心(CCTCC),在含有10%胎牛血清(美国Gibco)和1%青/链霉素(美国Invitrogen)的RPMI 1640培养基中培养。放置于恒温37 ℃ ,含5%CO2的细胞培养箱,每2日更换培养基。
六、FOXC1基因敲减
利用siRNA敲减HCT116细胞中的FOXC1。使用胰蛋白酶消化处于对数期生长的HCT116细胞,将其重悬于10%胎牛血清的培养基中,并以5×104/孔的密度接种于含400 μL完全培养基的24孔板中。24 h后,更换无血清培养基,使用FOXC1-siRNA或阴性对照siRNA(美国Thermo Fisher Scientific)转染HCT116细胞。20 pmol siRNA溶于50 μL Opti-mem无血清培养基中,再将1 μL Lipofectamine 2000(美国 Thermo Fisher Scientific)溶于50 μL Opti-mem无血清培养基中,室温放置5 min。将两种溶液混合后静置20 min进行细胞转染。转染12 h后更换普通培养液培养,24 h后进行后续实验。
七、实时荧光定量PCR(Real-time PCR)
利用Real-time PCR检测FOXC1敲减效果。使用Trizol试剂(美国Invitrogen)分离细胞总RNA,并使用PrimeScript试剂盒(日本TaKaRa)合成cDNA。使用基于SYBR Green荧光检测法在ViiATM7 RT-PCR系统上行实时定量PCR检测。三次生物学重复。引物如下:FOXC1:F 5′-CAGAACAGCATCCGCCACA-3′,R 5′-TGTTGTAGGAGTCCGGGTC-3′;GAPDH:F 5′-CGGAGTCAACGGATTTGGTCGTAT-3′,R 5′-AG CCTTCTCCATGGTGGTGTGAAGAC-3′。 预变性95 ℃ ,15 s;之后每一步变性95 ℃ ,5 s;退火延伸60 ℃ ,30 s;共进行45个循环。每次在延伸阶段读取吸光值。制作溶解曲线。以GAPDH表达值作为内参, 根据公式 2-ΔΔCt[ΔCt=Ct(FOXC1)-ΔCt=Ct(GAPDH)]计算FOXC1表达值。
八、Western blot检测
利用Western blot检测FOXC1敲减效果。使用细胞裂解液裂解细胞,并收集蛋白质,BCA法测定蛋白浓度。加入5x上样缓冲液,并将混合物煮沸10 min。聚丙烯酰胺凝胶电泳后,使用PVDF膜在300 mA恒定电流条件下,转膜90 min。随后,使用5%脱脂奶粉密封PVDF膜2 h,然后加入1:1 000稀释的FOXC1抗体(美国Abcam)。4℃孵育过夜后,加入1:200稀释的辣根过氧化物酶标记二抗(北京中杉金桥)室温孵育2 h。暗室中,利用显影液和定影液行胶片成像。
九、FOXC1对结肠癌细胞系迁移和侵袭能力的影响
通过使用Transwell系统来检测FOXC1对HCT116迁移和侵袭能力的影响。Transwell小室包含孔径为8 μm的聚碳酸酯滤膜(BD Biosciences),并预涂或未涂Matrigel基质胶。将含有10%胎牛血清的培养基至于下室中,以用作化学吸引剂。将细胞以4×104/孔的密度悬浮在200 μL无血清RPMI 1640培养液中,然后将其移至上室。在37 ℃ 下孵育48 h后,固定侵袭细胞,并用0.1%结晶紫水合物溶液染色30 min。倒置显微镜获取图像,并计数和比较每组中迁移和侵袭细胞的数量。
十、统计学分析
使用GraphPad Prism 5软件进行统计学分析,数据以均值±标准差(±s)表示,两组独立数据的比较采用Student'st检验,GO分析采用Fisher's精确检验,使用Logrank检验分析生存率差异显著性,以P<0.05认为差异有统计学意义。
结 果
一、结肠癌WGCNA模块的筛选
本研究利用WGCNA分析了结肠癌肝转移数据集GSE72718,结果显示共有5个模块,即模块1~模块5,与结肠癌肝转移显著相关(如图2A)。其中,模块1与LMCC组的相关性最为显著。模块1包含共表达基因178个,这些基因的表达量在结肠癌的恶性进展过程中,即从不具有转移特性到发生肝转移(PNMCC组-PMCC组-LMCC组),逐渐发生高表达或低表达,如图2B所示。这些结果提示模块1内的共表达基因可能与结肠癌肝转移关系密切。
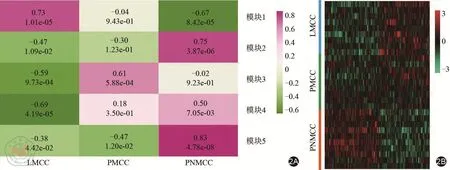
图2 结肠癌肝转移相关WGCNA模块筛选。2A:结肠癌肝转移数据的WGCNA分析;2B:模块1基因表达热图,红色为高表达,绿色为低表达
二、模块1基因的PPI网络分析及子模块的筛选
为了进一步了解模块1基因的内在联系,我们建立了模块1的PPI网络,如图3所示。由于节点网络较大,为了更精准地挖掘出影响结肠癌肝转移的核心靶点,我们对PPI网络进行了子模块挖掘,即找出大网络中具有更密切互作的基因团。结果显示在模块1中共挖掘出4个子模块,即子模块1~子模块4,如图4所示。这些子模块在模块1中具有更密切的互作关系,可能对结肠癌肝转移起到关键作用。
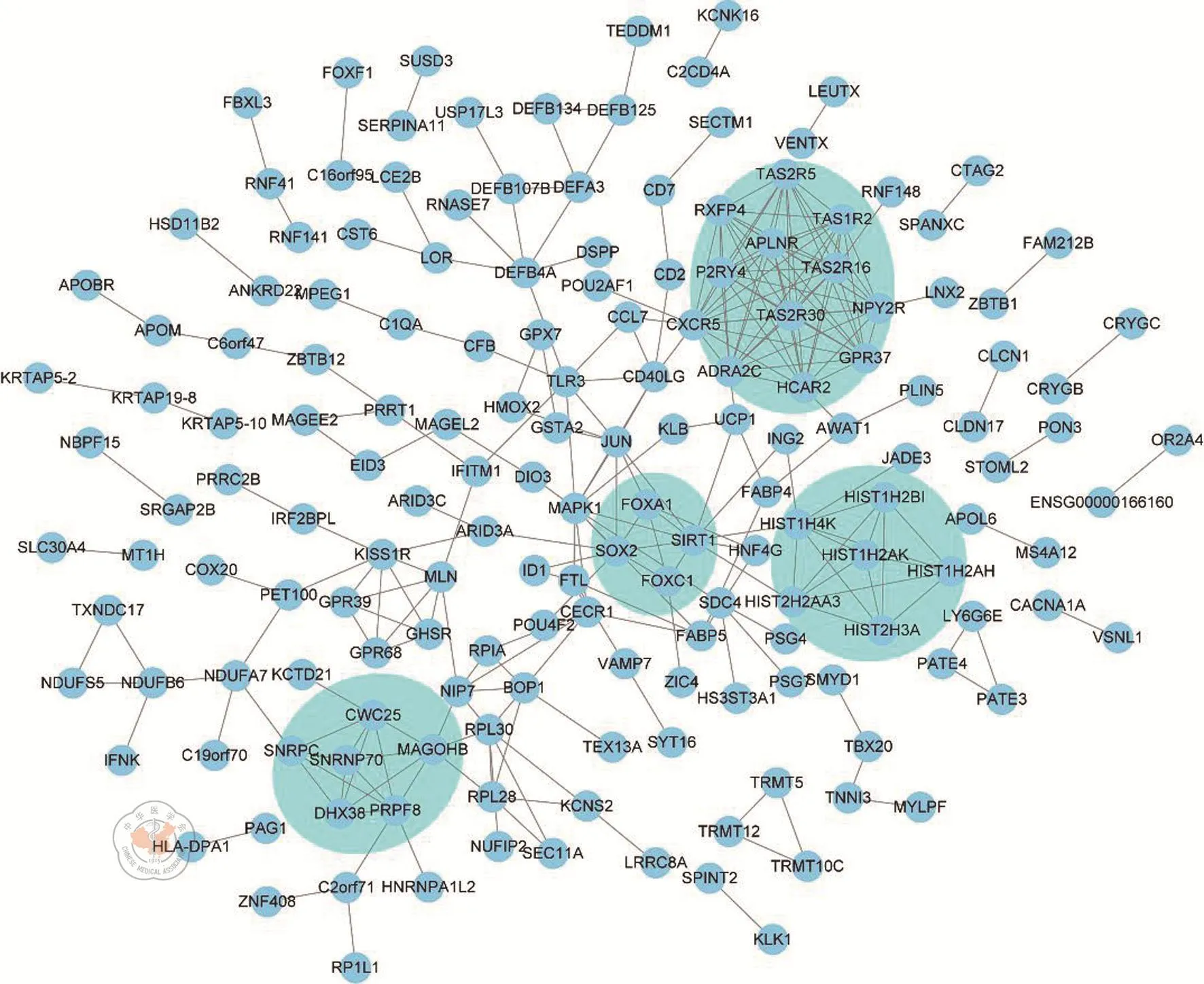
图3 模块1基因的PPI互作网络
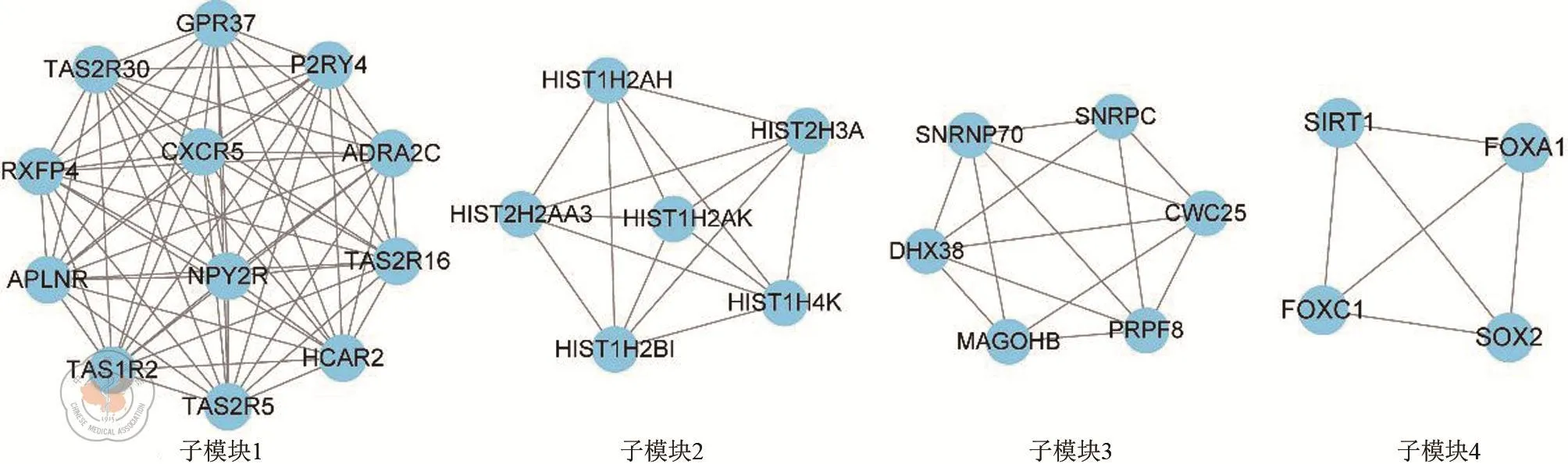
图4 模块1PPI网络中的4个子模块
三、子模块的功能(GO)富集分析
为了明确子模块的功能,我们对子模块进行GO分析。结果显示子模块1基因的功能为参与G蛋白偶联受体通路,子模块2的功能主要为染色质沉默,表观遗传学调控等,子模块3的功能为mRNA的剪接调节,子模块4的基因主要参与Notch信号通路,如图5所示。
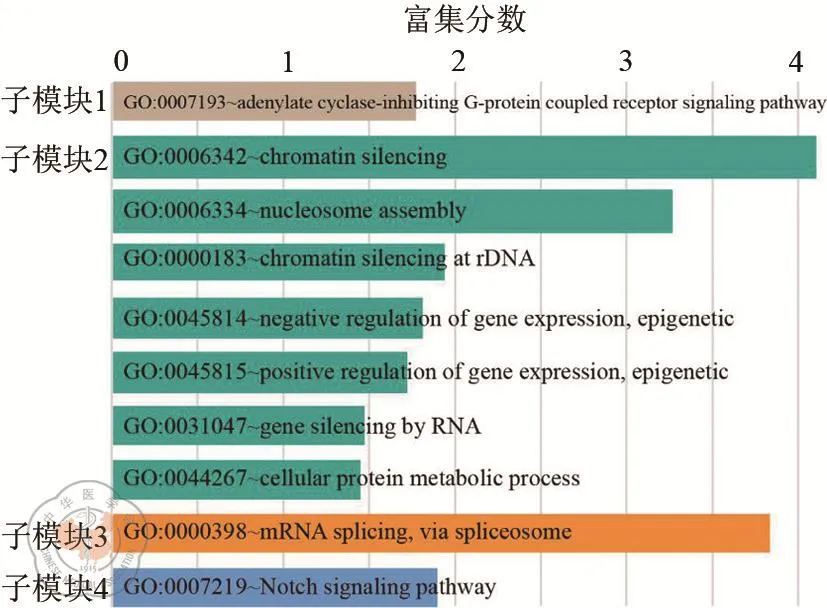
图5 子模块的功能(GO)富集分析。DAVID数据库生成的GO功能条目以条形图展示。条形图的长度表示每个条目的富集分数
四、FOXC1对结肠癌患者生存率的影响
为了了解子模块基因对临床结肠癌患者预后的影响,我们基于TCGA数据库中的594例结肠癌基因测序数据及其配对临床数据,分析了子模块基因异常表达对结肠癌患者生存率的影响。结果显示当子模块4的高表达基因FOXC1发生差异表达时,结肠癌患者的总体生存率、无进展期生存率及无病生存率均显著低于FOXC1正常表达的患者,如图6所示。
五、FOXC1的敲减效果验证
利用Real-time PCR和Western blot检测FOXC1在结肠癌细胞系HCT116中的敲减效果。Real-time PCR结果显示FOXC1-siRNA组中FOXC1的表达1.04±0.09明显低于阴性对照组0.41±0.12(t=7.047,P=0.002),如图所示。Western blot结果显示FOXC1-siRNA组中FOXC1在蛋白水平的表达明显低于对照组(t=3.592,P=0.023)如图7所示。实验结果证实FOXC1-siRNA能够有效敲减HCT116中FOXC1的表达。
六、FOXC1敲减对人结肠癌细胞系HCT116迁移和侵袭能力的影响
利用Transwell实验检测FOXC1对HCT116迁移和侵袭能力的影响。实验结果表明与阴性对照组相比,FXOC1被敲减后的FOXC1-siRNA组中HCT116的迁移能力(t=3.123,P=0.035)和侵袭能力(t=2.936,P=0.043)均受到了显著抑制,如图8所示。结果提示FOXC1可能对结肠癌肝转移有促进作用。
讨 论
肿瘤转移是一个涉及多基因变化的复杂过程,阐明肿瘤转移背后的基因改变对于肿瘤转移机制研究至关重要。经典的肿瘤转移模型表明,在原发肿瘤的发展过程中,部分细胞会发生转移相关的基因突变,当这种改变积累到一定程度后,这些细胞进而获得转移能力,最终发生肿瘤的远处转移[4]。根据这些肿瘤转移特点,GSE72718数据集收集了10年内未发生转移的结肠癌样本作为阴性对照,这些肿瘤细胞内未发生转移基因的改变。同时,收集结肠癌肝转移的肝转移灶样本作为转移组,这些肿瘤细胞均具有肿瘤转移基因的变化。而这些转移样本的配对原位结肠癌样本作为转移的过渡组,这些肿瘤细胞特点介于不转移和转移的肿瘤之间,处于转移基因逐渐改变的过程。相比简单设置两组转移和不转移样本,这种组别设置能够更加动态的而全面的挖掘结肠癌肝转移的基因变化。
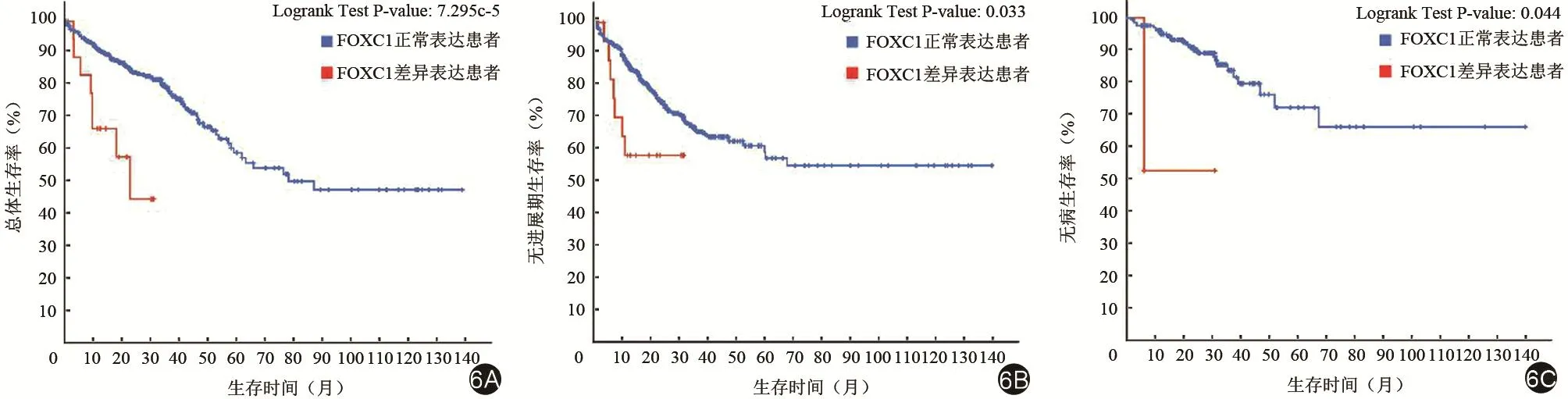
图6 大临床样本证实发生FOXC1差异表达的结肠癌患者预后较差

图7 FOXC1的敲减效果验证。7A:Real-time PCR结果显示FOXC1 mRNA在FOXC1-siRNA组中的表达明显低于对照组,*P<0.05;7B:Western blot结果显示FOXC1蛋白在FOXC1-siRNA组中的表达明显低于对照组
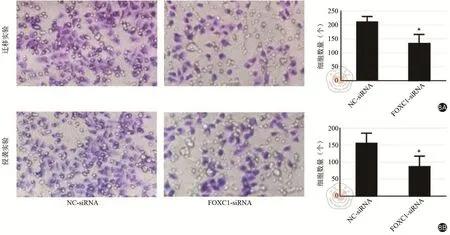
图8 Transwell实验证实FOXC1-siRNA组中HCT116细胞的迁移和侵袭能力均明显低于对照组。8A:迁移实验;8B:侵袭实验,*P<0.05
研究表明在不同疾病样本中往往存在一些具有表达共性的基因,它们协同表达并与疾病的表型关系密切[7]。基因共表达网络分析是找出这些基因的重要手段。在本研究中,我们利用WGCNA方法筛选出的5个模块中,模块1中的基因从不转移到转移(PNMCC向LMCC)的转变过程中,表达量逐渐升高或降低,提示模块1与结肠癌的肝转移过程密切相关。通过模块1基因的PPI网络可知该模块内部存在着十分复杂的基因互作关系,而网络中的核心子模块往往发挥重要作用。子模块1的功能与G蛋白偶联受体信号调控有关。研究表明G蛋白偶联受体与肿瘤转移的关系十分密切,它们不仅能够通过激活Rho GTPases和细胞骨架改变来促进肿瘤的转移,还能够为肿瘤的血管生成补充营养进而提供肿瘤转移的路径[8]。子模块2内包含众多组蛋白家族基因,如:HIST2H3A,HIST1H4K等。众所周知,组蛋白家族是表观遗传学调控的重要因子,组蛋白的乙酰化和去乙酰化修饰在肿瘤的发生发展以及肿瘤的远处转移过程中发挥重要作用[9]。因此,子模块2可能在结肠癌肝转移过程中扮演重要角色。此外,子模块4基因主要参与Notch通路。研究证实Notch通路的激活能够促进结肠癌的恶性进程,对结肠癌肝转移有重要影响[10]。子模块4中的高表达基因FOXC1,作为FOX转录因子家族的重要成员之一,经TCGA数据库临床大样本验证发现与结肠癌的预后密切相关。研究发现FOXC1参与多种肿瘤的发生发展。Ramadevi等[11]的研究证实FOXC1在胰腺癌中高表达并促进胰腺癌细胞的生长和转移。Jeff等[12]的研究发现FOXC1可以作为三阴乳腺癌的肿瘤标志物并促进乳腺癌细胞增殖。此外,FOXC1与结肠癌的关系密切,但多数研究集中在化疗药物增敏方面,它与结肠癌肝转移的关系还不明确。本研究通过分子生物学实验发现抑制FOXC1能够减少结肠癌细胞的迁移和侵袭能力,提示FOXC1可能对结肠癌肝转移有促进作用。
综上所述,本研究筛选出的结肠癌肝转移相关子模块均具有重要的促肿瘤作用,子模块基因FOXC1与结肠癌患者预后相关并具有促结肠癌转移能力。这些结果不仅证实了本次实验筛选的准确性,也为结肠癌肝转移的机制研究和临床诊疗提供新的参考。

