溶剂化效应在有机反应中的作用*
罗浩文,刘 磊,王语馨,魏宇航
(1 吉林大学药学院,吉林 长春 130012;2 吉林大学化学学院公共化学教学与研究中心,吉林 长春 130021)
各类型的有机反应,在反应过程中,绝大多数离不开溶剂提供的液体环境,这些溶剂起到的作用绝不仅仅是溶解。由于不同溶剂各方面性质的差异,比如分子的极性、得失电子的能力、形成氢键的能力、亲水性和疏水性,不同的溶剂对反应的影响也是不同的。尤其是在有机反应当中,因为有机化合物结构丰富多样,并且有机反应比无机反应更为复杂,反应步骤更多,涉及到的中间体也更多,所以有机化合物受到溶剂影响的位点更多,有机反应受到溶剂的影响程度更大。溶剂与反应分子的相互作用,形成溶剂膜的溶剂化过程,会对有机物分子的电子结构和有机分子的能量造成影响,进而对反应的反应历程以及产物的选择性造成影响。溶剂化效应指的正是反应体系中的溶剂对反应的平衡,反应速率、反应的立体结构的影响。
1 溶剂化效应的基本原理
1.1 溶剂分类
溶剂可以大致分为质子性溶剂和非质子性溶剂两大类。质子溶剂是指一类具有给出质子的能力的溶剂,这类溶剂往往会降低溶液中亲核试剂的亲核性。非质子性溶剂则与此相反。非质子性溶剂又包括偶极溶剂和非极性非质子溶剂[1-3]。偶极溶剂又称为极性非质子溶剂,这类溶剂的溶剂分子具有极性,且往往是偶极负端裸露在外,但不易给出质子。氯仿、丙酮、二甲亚砜(DMSO)、N,N-二甲基甲酰胺(DMF)和四氢呋喃(THF)都属于偶极溶剂。而非极性非质子溶剂,不具有极性也不能给出质子,例如已烷、苯和乙醚都属于非极性非质子溶剂。
1.2 溶剂化
溶剂化指的就是溶质分子在溶液体系中被溶剂分子紧密包围的过程。溶剂化发生的程度和难易程度,取决于溶剂与溶质分子相互作用的强度和溶剂分子和溶剂分子之间的相互作用强度。这些相互作用包括一些特定结构的相互作用,比如氢键,也包括分子与分子之间普遍存在的偶极与偶极之间的静电引力。假如溶剂分子和溶质分子之间的相互作用强于溶剂分子之间的相互作用,那么溶剂化便容易发生。反之,溶质分子则无法被溶剂分子很好的溶剂化。
2 溶剂化效应对化学反应产物的影响
溶剂化效应可以引起反应的区域选择性改变。区域选择性即指在有机反应中,反应物存在多个理论上的反应位点,但是只在某一个反应位点发生反应。
举一个简单的例子,比如萘环与乙酰氯在AlCl3催化下的Friedel-Crafts反应[4]。当以硝基苯作为溶剂时,得到的产物的90%都是β位的取代产物。这是因为在极性溶剂硝基苯存在的环境下,乙酰氯的C-Cl键异裂得到的酰基正离子作为亲电试剂,带正电荷的亲电试剂酰基正离子被溶剂化的程度更高,整个粒子团的体积变大,易进攻空间位阻小的β位,所以得到了β位取代的主要产物(图1)。

图1 以硝基苯为溶剂的萘环与乙酰氯的酰基化反应
当该反应以二硫化碳作为溶剂时,得到的α位和β位取代的产物比例约为3∶1。非极性溶剂二硫化碳不容易将亲电试剂酰基正离子溶剂化,并且攻击α位可以得到两个含有苯环的共振结构式,然而进攻β位只能得到一个含有苯环的共振结构式;进入α位产物更稳定,所以产物以α位为主(图2)。
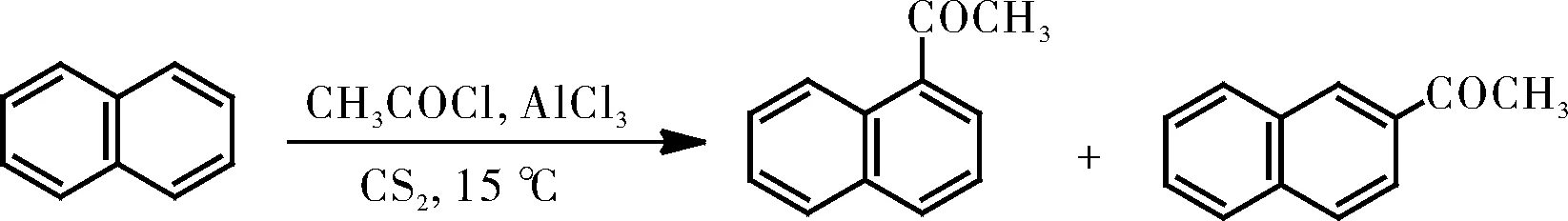
图2 以二硫化碳为溶剂的萘环与乙酰氯的酰基化反应
3 溶剂化效应对化学平衡的影响
3.1 溶剂化引起酸碱离解平衡常数(酸度)顺序的改变
溶剂化效应对酸碱理解平衡常数的影响,最明显体现在由一个电中性的酸分子在溶液中离解成阴离子和阳离子的离解平衡常数上。比如HOAc在水中解离[5]得到H3O+和AcO-(图3),当溶剂的极性越大,解离得到的离子越容易被溶剂化,离子对越容易离解成离子。

图3 醋酸的水解
3.2 溶剂化引起互变异构平衡的改变
酮式和烯醇式[6]的含量也会受到溶剂的影响,比如乙酰乙酸乙酯在非极性溶剂的环境下(图4),烯醇式的含量会提高,在乙醇中烯醇式的含量为10%~13%,而在正己烷中烯醇式的含量为49%。这是因为乙酰乙酸乙酯形成氢键的过程,实际上是键合之后的氢显示出的正电荷对电负性大的原子比如N、O的孤对电子的吸引,形成氢键后,羰基氧上的孤电子对吸引并控制住了带部分正电荷的氢,通过氢键形成六元螯合环,分子极性降低,分子在极性溶剂乙醇中溶剂化程度相对下降,而在非极性溶剂正己烷中烯醇式的含量略高。

图4 乙酰乙酸乙酯的异构化
4 溶剂化效应对有机反应中间体和立体化学的影响
4.1 溶剂对亲核取代反应的影响
4.1.1 SN1反应
对于SN1反应来说,溶剂的极性越大,对反应越有利。这一点我们可以从亲核取代反应的过渡态去考虑。SN1反应形成碳正离子时,离去基团和亲核受体处于过渡态,过渡态的正电中心和负电中心间距变大,是一个分子的极性增大的过程。此时溶剂的极性越大,与过渡态形成的偶极-偶极相互作用就越强,就能提供更多的能量辅助亲核受体过渡态的形成,有利于SN1反应。除此以外,假如溶剂是质子溶剂,那么就可以提供质子给离去基团质子化,或者与其形成氢键,有效地稳定了反应体系中的负电荷,催动离解反应的发生,有效地提高了反应决速步的反应速率,有利于SN1反应。
4.1.2 SN2反应
由SN2反应的反应机理可知,反应的过渡态形成的过程,是由电荷比较密集的亲核受体或者是亲核试剂形成电荷被分散的中间过渡态的过程。溶剂在攻击底物形成过渡态的过程中,需要克服原本溶液中亲核受体和亲核试剂与溶剂分子之间的相互作用。溶液的极性越大,形成过渡态需要克服的阻力越大。所以,在一般情况下,溶剂的极性增强,不利于SN2反应。
当我们具体考虑溶剂对SN2反应的影响程度时,则要根据具体的反应类型来分析。对于形成过渡态时电荷产生的反应,比如叔胺的取代,溶剂极性的变化就对其影响很大;对于形成过渡态时电荷分散的反应,比如简单的卤代烃和氢氧根离子的反应,形成中间体时,电荷被分散,此时极性的增大对于反应的影响就比较小。除此以外,也有一些特别的SN2反应的在溶剂极性增大时反而对反应有利,反应式[7]如图5所示。
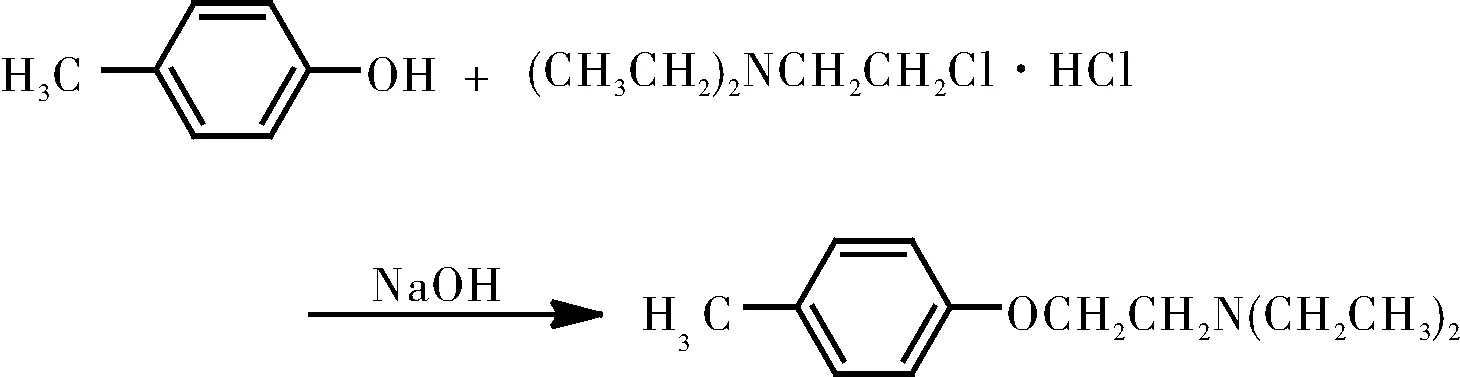
图5 2-二乙氨基乙基-4-甲基醚的合成
此处我们考虑的不应该只是单纯的溶剂效应,还需要考虑中间产物对甲苯酚钠在溶剂体系中的解离度。对甲基苯酚钠的在水中的解离度远远大于其在乙醇中的解离度,这意味着在水中可以得到的反应的亲核试剂更多,所以在极性更大的水溶液中,反而利于反应的发生。
4.1.3 分子内亲核取代反应
对于分子内亲核取代反应来说,不同类型的溶剂对反应有不同的影响,以2-丁醇和亚硫酰氯的反应为例,不同溶剂得到不同产物。用乙醚做溶剂时,发生分子内取代反应,得到的主要是构型保持的产物,其反应式见图6,机理见图7。

图6 2-丁醇与二氯亚砜反应得到构型保持产物

图7 2-丁醇与二氯亚砜反应的反应机理
而用吡啶做溶剂的时候得到的是构型翻转的产物(图8)。

图8 2-丁醇与二氯亚砜反应得到构型翻转产物
这是因为反应的中间产物氯化氢和氯代亚硫酸酯可以和吡啶反应[8],产生游离的氯离子。氯代亚硫酸酯与吡啶反应后,一方面令反应无法按照分子内亲核取代的机理来进行,另一方面增大了空间位阻,使得游离的氯离子更倾向于从背面进攻,最终得到了构型翻转的产物,机理见图9。

图9 游离的氯离子从背面进攻反应的中间产物
4.1.4 两可亲核试剂参与的亲核取代反应
两可亲核试剂即试剂分子上的亲核取代的进攻原子有2个[9]的试剂,比如β-萘酚钠盐[10-11],在不同的条件下,α位的C端和O端都有亲核进攻的机会。反应式如图10所示。

图10 β-萘酚钠盐与苄基溴在不同溶剂下的反应
在酸性较强的质子溶剂2,2,2-三氟乙醇中,由于β-萘酚钠盐的氧原子容易和溶剂形成氢键,亲核性降低,所以由α位的C进攻。但在DMF溶剂中,由于DMF溶剂的偶极负端是裸露在外的,所以对其它分子的偶极正端和阳离子有比较好的溶剂化效果,此时对β-萘酚钠离子有较好的溶剂化作用,利于得到β-萘酚钠离子,有利于从O端进行亲核取代反应。
4.1.5 亲核取代反应和消除反应的竞争
亲核取代反应和消除反应常常会在一个反应体系中同时发生,溶剂可以影响这两个反应的选择性。对于SN1和E1这两个反应的竞争,溶剂对反应的影响和影响程度同样取决于这两个反应的过渡态的差异,对于SN1的碳正离子过渡态而言,其电荷比较集中,容易被极性溶剂溶剂化,极性大的溶剂有利于SN1反应的进行,相比较而言,溶剂极性小有利于消除产物的生成。对于SN2和E2这两个反应的竞争,我们也从反应的过渡态进行分析,E2反应的过渡态,偶极正端和偶极负端的距离更大,电荷分布更加的分散。SN2反应的偶极正端和偶极负端的距离更短,过渡态电荷分布更为集中,更容易被极性溶剂极化,所以极性溶剂有利于SN2反应的进行。
汤青云的实验结果[12]也证明了上面的结论。
在叔丁基溴与氢氧化钠的反应中(图11),发生了SN1反应和E1反应的竞争。采用纯乙醇和80%乙醇得到的消除产物的产率出现了明显的差异,加入分子极性更强的水使得消除产物的产率明显的下降了。在纯乙醇溶剂环境中,消除产物的产率为19%,而在80%的乙醇水溶剂中,消除产物的产率下降至12.6%。

图11 叔丁基溴与氢氧化钠在不同溶剂中的反应
2-溴丙烷与氢氧化钠的反应中(图12),发生了SN2反应和E2反应的竞争。加入的水分子可以更好的和中间体的碳正离子发生溶剂化,使得取代产物的比例增多,消除产物的产率从71%下降到了59%。综上可知,在SN1与E1的竞争以及SN2与E2的竞争中,极性大的水有利于过渡态电荷更集中的SN1与SN2反应发生。

图12 2-溴丙烷与氢氧化钠在不同溶剂中的反应
4.2 溶剂对亲电加成反应的影响
对于亲电加成反应[13],一般有两种机理,碳正离子机理或环鎓离子机理,中间体分别为碳正离子中间体(图13)和环鎓离子中间体(图14)。

图13 碳正离子中间体
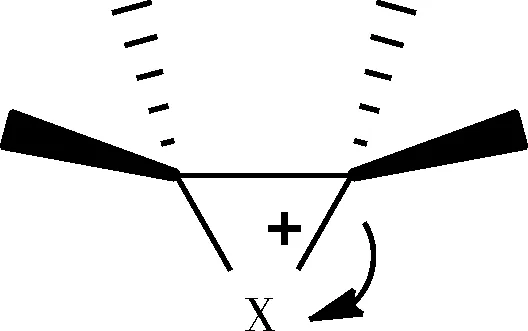
图14 环鎓离子中间体
理论上认为在一个亲电加成反应中,两种机理都有可能发生,但是两种路径得到的产物比例取决于两个过渡态的稳定性,过渡态能量越低,反应越容易发生。
在极性溶剂中,由于碳正离子机理的过渡态产生的碳正离子电荷集中,与溶剂分子的溶剂化程度更高,过渡态的能量更低,所以,碳正离子中间体比环鎓离子在中间体的溶剂化程度更好。极性溶剂对碳正离子机理有利,得到的产物也以顺式加成为主。反之,在非极性溶剂中,由于溶剂化的程度弱,并且环鎓离子有效地分散了电荷,降低了中间体的能量,所以非极性溶剂往往对环鎓离子机理有利,得到的产物也以反式加成为主。
5 结 语
本文论述了溶剂分类、溶质-溶剂分子间相互作用、溶剂化作用的基本原理、溶剂化效应对化学反应产物的影响、溶剂化效应对化学平衡的影响、溶剂对亲核取代反应的影响、溶剂对两可亲核试剂参与的亲核取代反应的影响、溶剂对分子内亲核取代反应的影响、溶剂对亲核取代反应和消除反应的竞争的影响和溶剂对亲电加成反应的影响。
溶剂通过影响有机反应中间体以及过渡态,进而影响有机反应结果。对于不同类型的有机反应,分析溶剂化效应的角度都不一样。例如在考虑溶剂对简单的亲核取代反应和分子内亲核取代反应的影响时,需综合考虑了溶剂对亲核试剂和反应的中间体的影响。对于两可亲核试剂参与的反应则考虑氢键的形成以及溶剂对溶质的解离效果。对于亲核取代反应和消除反应的竞争,则针对反应的过渡态进行分析。这些实例充分的说明了,我们需要仔细分析溶液体系中溶剂分子和溶质分子可能发生的电荷相互作用,充分考虑各方面对反应影响程度,包括反应的速率、反应的空间效应,结合反应的机理和特点,合理地解释反应的机理和反应产物。
——碳正离子的产生及稳定性比较

