以电极电势书写能斯特方程
柴佳丽,马剑琪
(陕西理工大学,陕西汉中 723000)
电池电动势的能斯特方程阐明了可逆电池电动势E与电极本性、温度T、参与电池反应各物质的浓度或活度三者之间的关系,也反映了电池在标准状态下与非标准状态下的电动势关系[1]。能斯特方程的应用非常广泛,既可以判断化学反应前进的方向和程度,对有氢离子或氢氧根离子参加的电池反应,也可以研究酸碱度对电池电动势的影响等。对学习电化学的初学者,由于电动势产生的本质抽象,难以深刻理解,加之各种辅导教材对能斯特方程的表述存在差异,书写能斯特方程时对反应体系中各物质的浓度与电动势的关系不能很好掌握,尤其对于一些复杂的电池反应,例如酸性高锰酸钾与草酸、酸性重铬酸钾与氯化亚铁反应等,其反应物和生成物比较复杂,学生直接依据电池的总反应书写能斯特方程很容易出错。但是能够准确书写并深入理解能斯特方程在电化学学习中又是非常重要的。为了解决这一问题,本文结合具体实例,根据还原电极电势和电动势的定义,就可以达到正确书写能斯特方程的目的。
1 还原电极电势
原电池是由两个不同且相对独立的电极、电解液等构成,正、负电极分别起到还原、氧化作用。在实际实验操作中,某一电极的电极电势φ的具体数值无法测量,但在两个电极组成的电池中,其电势差是可以测量的[1]。因此,选择一个电极作为参照电极,即可测得另一电极的电极电势。在标准状态时,规定在任意温度下的氢电极电势为零。氢标准电极可与任一电极都组成原电池,在这样的原电池中,认为氢标准电极已发生了失电子的氧化反应,反应式为:H2-2e-=2H+,当待测电极与标准氢电极构成原电池时,认为待测电极发生得电子的还原反应,实际测得的电池电动势即为待测电极的电极电势定义为还原电极电势,还原电极电势为正值,表示电极与氢电极组成原电池时,该电极发生的是自发进行的还原反应;还原电极电势为负值,表示该电极与氢电极组成原电池时,该电极实际上发生的是非自发进行的还原反应,电池电动势即为该电极电势的负值[2]。
电极电势(φ)的影响因素有内因和外因,内因是电极材料本身的性质,例如金属电极电势的大小与金属的活泼性密切相关,金属越活泼,越容易失去电子,则电极电势越低,反之,则越高。外因是反应时所处温度下参与电极反应各物质的浓度大小。
如对于一个有两种反应物参加的电池反应:
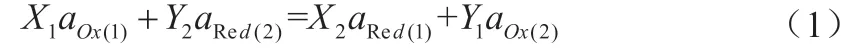
X1、X2为正极反应中反应物、生成物的计量数,Y1、Y2为负极反应中反应物、生成物的计量数,aOx表示氧化型物质,aRed表示还原型物质,z表示得失电子的计量数。对于有三种、四种等多种反应物参加的电池反应,原理相似。
将电池反应(1)拆分成两个电极反应,认为正、负极都发生得到电子的还原反应,高价态物质作反应物,低价态物质作生成物,并将其配平。即:
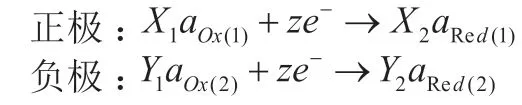
根据正、负极的电极反应,分别写出正、负极的电极电势的能斯特方程。
正极的电极电势为:
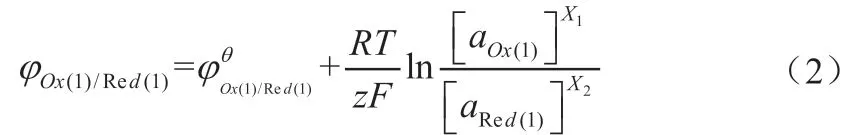
负极的电极电势为:
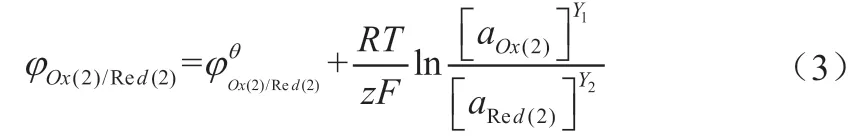
式(2)和式(3)分别为正、负极电极电势的能斯特方程,表示电极电势在标准状态下与非标准状态下反应体系中各物质浓度的关系[3-4]。φ为非标准电极电势;φθ为标准电极电势,[aOx]、[aRed]分别表示还原反应中氧化型和还原型物质的摩尔浓度,F(96 500C/mol)为法拉第常数,R(8.314J/mol)为气体常数,T是绝对温度,如果有气体参加反应,则用相对分压表示(p/pθ)。在使用过程中应该注意,对于纯固体,其浓度为“1”,在能斯特方程中可以省略不写。
经查阅资料发现,很多教材及辅导资料中电极电势能斯特方程中的标准电极后面的符号为“-”,而将还原型物质写在对数项的分子,氧化型物质写在对数项的分母。本文为了书写方便与统一,规定电极电势能斯特方程中的标准电极后面的符号都为“+”,将对应的氧化型物质写在对数项的分子,还原型物质写在对数项的分母。
2 电池电动势
电池电动势可以借助高低不同的水位箱来帮助初学者理解,正极电极电势类似于高水位,负极电极电势类似于低水位,高水位与低水位之间的水位差类似于电池中正、负极的电极电势之差即电池电动势。自然状态下,高水位的水向低水位流动,高水位降低,低水位升高,水位差逐渐减小直至高低水位相平;对应在原电池中,随着原电池反应的进行,正极反应中反应物浓度减小,生成物浓度增大,正极的电极电势逐渐降低;负极反应中反应物浓度增大,生成物浓度减小,负极的电极电势逐渐升高。当正、负两极的电极电势相等时,电势差即电动势E等于零,即电池电动势等于零,电池反应达到了平衡状态。
在式(2)和式(3)中,随着电池反应的进行,正极反应中氧化型物质浓度逐渐减小,还原型物质浓度逐渐增大,正极的电极电势越来越小;负极反应中氧化型物质浓度逐渐增大,还原型物质浓度逐渐减小,正极的电极电势越来越大。电势差即电动势为正、负极板的电极电势之差,
根据E=φ+-φ-及电池反应(1),可由正负电极的电极电势能斯特方程(2)和(3),来表示电池能斯特方程。用公式表示为:

根据电动势的定义得出式(4),E为某电池在任意条件下的电池电动势,Eθ为该电池的标准电池电动势。
电极反应比电池反应更为简单,先分别写出正、负极的电极反应以及还原电极电势能斯特方程,经做差得到电池电动势能斯特方程。
3 能斯特方程书写举例
3.1 铜锌原电池
铜锌原电池的电池反应为:Zn+Cu2+=Zn2++Cu。将电池反应拆分为两个电极反应,认为都发生还原反应,电极反应如下:
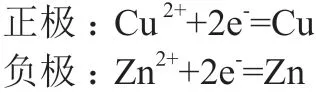
分别写出正、负极的还原电极电势能斯特方程,根据式(2)和式(3)得:
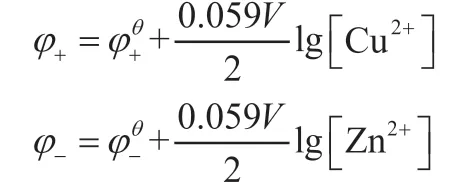
根据电动势的定义E=φ+-φ-,得:
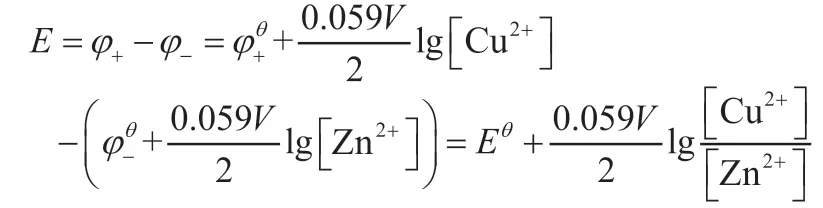
以电池电动势书写能斯特方程:
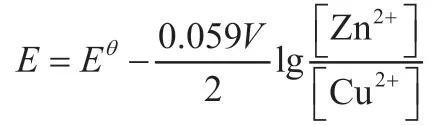
3.2 草酸与酸性高锰酸钾组成的原电池[6]
在酸性条件下,草酸与高锰酸钾构成的原电池总反应为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。以电极电势书写能斯特方程,将总反应拆分为两个电极反应,认为每极都发生还原反应,电极反应如下:
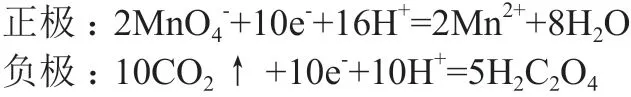
分别写出正、负极的还原电极电势能斯特方程,根据公式(2)和(3)得:
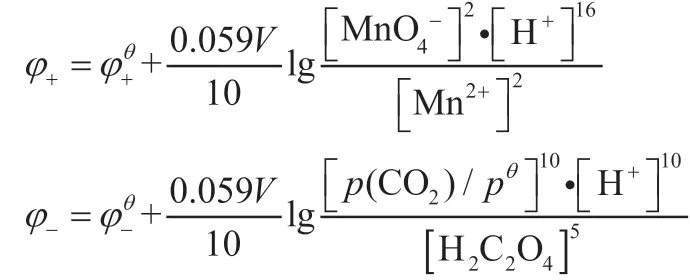
根据电动势的定义E=φ+-φ-,得:

以电池电动势书写能斯特方程:
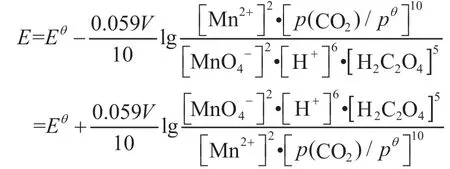
3.3 重铬酸钾与氯化亚铁组成的原电池
在酸性重铬酸钾与氯化亚铁组成的原电池中,电池反应式为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。以电极电势书写能斯特方程,将总反应拆分为两个电极反应,认为每一极都发生还原反应:
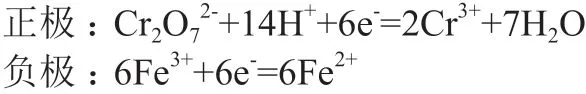
分别写出正、负极的还原电极电势能斯特方程,根据公式(2)和(3)得:
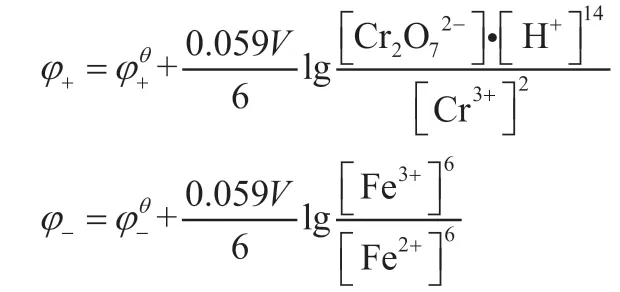
根据电动势的定义E=φ+-φ-,得:
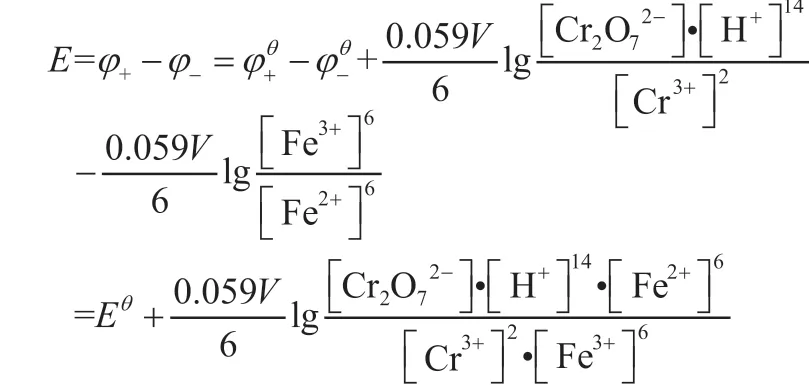
电池电动势书写能斯特方程:
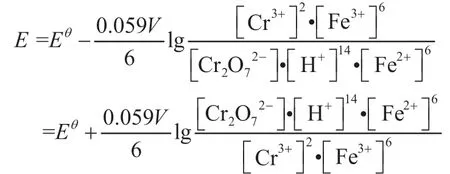
对于类似后两者这样的复杂的电池反应中,H+和OH-在反应过程中不发生电子得失,但实际参与了电池反应。如初学者直接写出电池的能斯特方程时,容易遗漏H+、OH-且对反应体系中各物质浓度写在对数项的分子还是分母出现混乱等,如以电极电势书写能斯特方程,先写出每一极的电极反应,并认为都发生还原反应,再写出正、负极的电极电势的能斯特方程,根据电动势的定义可得到电池电动势能斯特方程。利用这种方法不论是简单的电池反应,还是复杂的电池反应,都不容易出错,可达到正确书写能斯特方程的目的。
4 结束语
针对初学者在书写能斯特方程时,不能准确判断反应体系中各物质浓度应处于对数项的分子还是分母,尤其对一些复杂的电池反 应很容易出错,为此提出了以电极电势书写能斯特方程。该方法解决了复杂反应中能斯特方程书写容易出错的问题,应用方便,使初学者能更清晰地掌握和使用能斯特方程,并且对任一复杂的电池反应利用此方法都可以轻松得到电池电动势的能斯特方程。

