生物炭-微生物复合材料修复Cr(Ⅵ)污染土壤条件优化及促生效果*
姜庆宏 宋玉艳 韩剑宏 张连科 张铁军 王维大
(内蒙古科技大学能源与环境学院,内蒙古 包头 014010)
铬盐系列产品广泛应用于众多工业,如冶金、制革、颜料、军工等[1]。含铬废水、废渣排放造成土壤污染[2]。据估算,我国因铬渣造成的土壤污染面积达到500万 m2[3]。土壤中的铬一般以Cr(Ⅵ)和Cr(Ⅲ)的形式存在,Cr(Ⅵ)具有更强的移动性和生物可利用性[4]。若人类长期生活在含有Cr(Ⅵ)的环境中,会导致溃疡、皮肤刺激、肝损伤,严重时还会导致呼吸道癌[5-6]。
针对铬污染土壤,已报道的修复技术主要有客土法、化学还原法、电动修复法和微生物修复法[7-10]。其中微生物修复法具有高效、清洁和经济的优点,已成为研究热点。微生物修复中,筛选适应修复地环境的菌种至关重要,目前已经筛选出很多具有还原作用的菌株[11-14]。但微生物的生存及代谢活动易受到环境影响,修复效果难以保证。相比而言,利用固定化微生物技术制备的复合材料将游离的细胞限制在特定空间里,使其具有活性高、耐受性强、保存时间长、能抵抗外界胁迫等优点[15-18],能更好地满足土壤铬污染治理的迫切需求。
本研究以从西北寒旱区铬渣堆场筛选的对铬具有还原性的微球菌属(Micrococcus)菌株为固定化菌株,以玉米秸秆生物炭为载体制备生物炭-微生物复合材料(BC-MT),优化了BC-MT进行铬污染土壤修复的条件,并通过盆栽实验,研究了BC-MT对植物生长、生化指标的影响,以期为BC-MT在铬污染土壤修复上的应用提供理论和实验依据。
1 材料与方法
1.1 供试土壤
供试土壤取自内蒙古科技大学校园花坛,挑选出植物残体及石子后,于阴凉处风干并磨碎过2 mm筛。将一定量的K2Cr2O7(分析纯)溶解于去离子水,喷洒到供试土壤中,搅拌均匀,置于室温老化3个月,待用。土壤基本理化性质见表1。
1.2 供试菌种
所用菌种为前期筛选出的铬还原菌——藤黄微球菌(Micrococcusluteus)。
1.3 生物炭的制备
将玉米秸秆粉碎后放入坩埚中,置于马弗炉(SX-5-12)内500 ℃缺氧热解3 h,待马弗炉温度降至室温后取出黑色固体,磨碎,过100目筛后得到生物炭。
1.4 BC-MT的制备
取活化24 h的菌液,采用吸附固定的方法,将生物炭和菌液以1 g∶100 mL混合于锥形瓶中,于30 ℃、150 r/min振荡培养24 h后离心取上清液,用无菌水充分清洗后再经过真空冷冻干燥得到BC-MT。
1.5 实验方法
1.5.1 BC-MT的生物量测定
取1 g BC-MT于锥形瓶中,加入100 mL无菌水,30 ℃、150 r/min培养24 h后取1 mL上层菌液,稀释后涂布平板,培养,计数。游离菌的培养液中细菌计数方法类似。计算得出,1 g BC-MT与5.54 mL游离菌菌液的细菌数相同[19]1029。
1.5.2 生物炭对微生物的吸附实验
取1 g生物炭于锥形瓶中,灭菌后接种1 mL菌液,置于30 ℃、150 r/min振荡培养,每隔6 h进行取样,离心后弃其上清液,重复离心3次。用无菌生理盐水洗涤下层固体,收集上清液定容到50 mL。
利用比浊法测定微生物生物量,将收集的溶液置于紫外分光光度计下,测其波长600 nm处吸光度(OD600),即得到微生物生物量[20]。根据OD600随时间的变化绘制生物炭的吸附曲线,确定最佳吸附时间。
1.5.3 BC-MT修复条件优化实验
考察BC-MT投加量、氮源投加量、土壤含水率3个因素对Cr(Ⅵ)去除的影响,分别确定BC-MT最佳去除条件。
(1) 设置BC-MT投加量为1%(质量分数,下同)、3%、5%、7%,每天浇水、翻耕,修复25 d,定期测定土壤中Cr(Ⅵ)含量,确定最佳投加量。
(2) 在最佳BC-MT投加量的基础上,调节土壤氮源浓度,向土壤中加入不同浓度的蛋白胨液体培养基,使土壤中的氮源投加量分别为5、10、15、20g/kg,修复25 d,每天浇水、翻耕,定期测定土壤中Cr(Ⅵ)含量,确定最佳氮源投加量。
(3) 在最佳BC-MT投加量和氮源投加量的基础上,设置土壤含水率为8%、14%、18%、23%,修复25 d,每天浇水、翻耕,定期测定土壤中Cr(Ⅵ)含量,确定最佳土壤含水率。
1.5.4 对比实验
在1.5.3节得出的最佳条件的基础上,施加BC-MT、生物炭、微生物菌液分别修复25 d,比较Cr(Ⅵ)去除率、可提取态铬。
1.6 盆栽实验
在花盆(下径11 cm、上径13 cm、高12 cm)中装入500 g供试土壤,每盆播种经30%(质量分数)H2O2表面杀菌的玉米种子6株,室温下培养12周。检测植物的生长和生化指标,并测定植物地上、地下部分的重金属含量。具体实验设置见表2。

表1 供试土壤理化性质
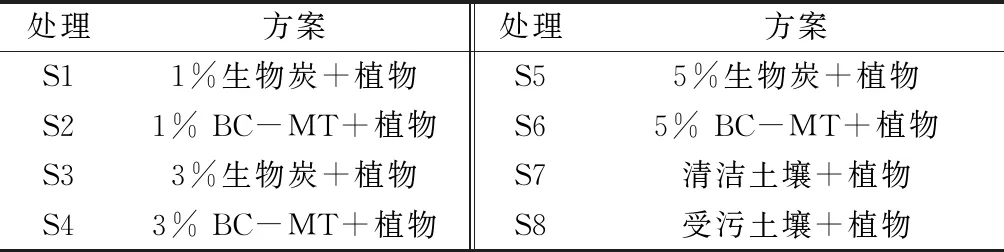
表2 盆栽实验处理方案1)
1.7 分析方法
采用二苯碳酰二肼分光光度法于540 nm波长处测定Cr(Ⅵ)浓度[21]。采用固体废物毒性浸出实验浸提土壤中可提取态重金属;碱解氮含量测定采用碱扩散法;生物炭中有机质含量测定采用重铬酸钾容量法[22]。pH测定参照《木质活性炭试验方法 pH值的测定》(GB/T 12496.7—1999)。植物重金属含量经HNO3-HCIO4消解后测定[23]。叶绿素测定采用丙酮/无水乙醇法;可溶性糖测定采用蒽酮比色法[24]。
2 结果与讨论
2.1 BC-MT表征
2.1.1 元素组成与微观形貌
生物炭的性质及元素组成如表3所示。生物炭中含有微生物生长所需的基本营养元素,能够为微生物提供良好的定居环境。图1为藤黄微球菌与BC-MT扫描电镜图。BC-MT的生物炭上附着了大量藤黄微球菌。生物炭因比表面积大、孔隙结构发达、营养元素丰富,表面及孔道附着了大量微生物,这些孔隙还能够成为微生物在代谢过程中氧气、营养物质及污染底物的输送通道,在Cr(Ⅵ)的去除过程中保护微生物免受重金属铬的毒害,是微生物理想的生存场所。

表3 生物炭性质及元素组成

图1 藤黄微球菌和BC-MT的扫描电镜图Fig.1 Scanning electron microscope images of Micrococcus luteus and BC-MT
2.1.2 生物炭对微生物的吸附固定
土壤中微生物固定的数量影响着Cr(Ⅵ)的去除。图2为生物炭对微生物的吸附时间曲线。随着固定化时间延长,OD600也随之增高;当固定化时间为24 h时,OD600达到0.43,随后呈下降趋势,表示生物炭中的微生物量开始减少。固定化时间短,微生物繁殖数量少,BC-MT的去除能力降低。固定化时间过长,微生物在生物炭中快速繁殖堆积,形成挂膜,BC-MT外层细菌脱落,吸附量变小[25]。因此,确定最佳固定化时间为24 h。
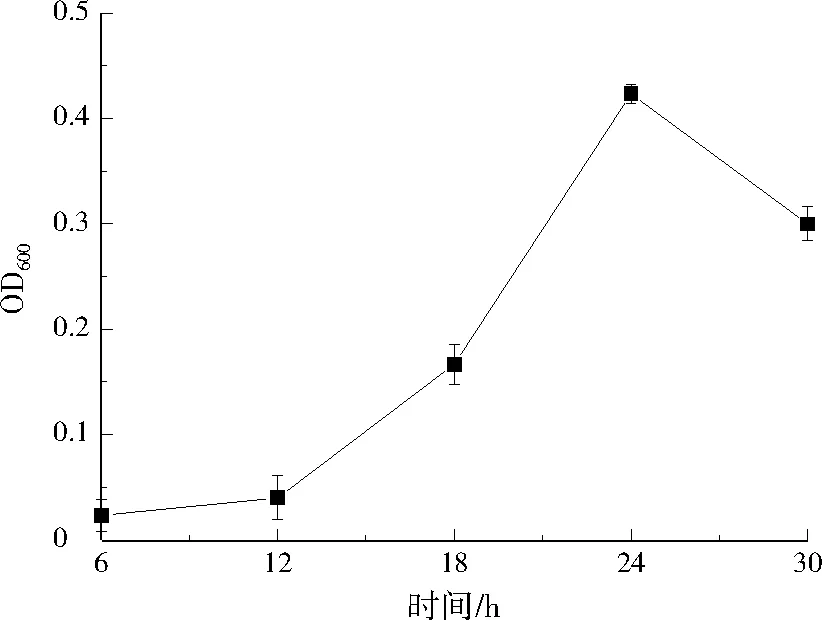
图2 生物炭吸附微生物随固定化时间的变化Fig.2 Adsorption of microbial onto biochar varied with immobilization time
2.2 BC-MT修复铬污染土壤条件优化
2.2.1 BC-MT投加量的影响
在不同BC-MT投加量条件下修复铬污染土壤,Cr(Ⅵ)去除率如图3所示。不同投加量下,Cr(Ⅵ)去除率伴随着时间的延长而增加。BC-MT投加量为1%、3%、5%、7%,修复25 d,Cr(Ⅵ)去除率分别为50.81%、60.20%、56.53%、55.91%,BC-MT投加量为3%时的Cr(Ⅵ)去除率最高。铬还原菌在载体的保护下能够快速适应环境,大量繁殖,所以投加BC-MT能够提高Cr(Ⅵ)的去除能力。BC-MT投加量过低,接入土壤中因不适应环境而死亡的微生物占比较大,导致Cr(Ⅵ)去除率较低;但是当BC-MT投加量过高时,微生物的快速繁殖会造成种群之间对氧气、空间、营养物质的相互竞争,影响BC-MT的去除性能[19]1031。所以适宜的投加量对铬污染土壤的修复有重要作用,最佳BC-MT投加量为3%。
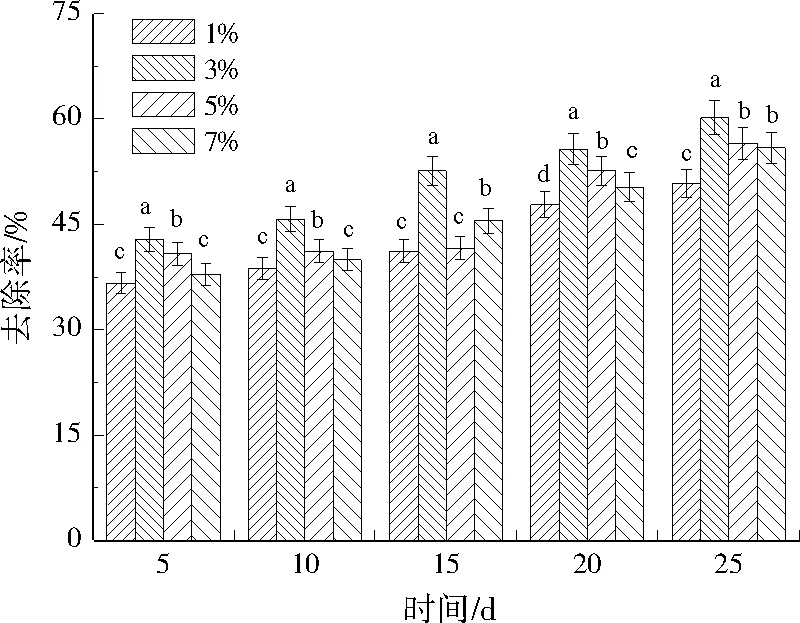
注:不同处理的修复效果差异性遵从多重比较字母标记法,下同。
2.2.2 氮源投加量的影响
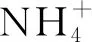
在不同氮源投加量条件下,Cr(Ⅵ)去除率如图4所示。BC-MT对Cr(Ⅵ)的去除率大体上随着时间延长不断增大,补充氮源对去除效果提升显著。当氮源投加量为10 g/kg时,修复25 d,去除率最高,达到54.90%。继续提高氮源投加量,去除率并未随之升高,因此,最佳氮源投加量选择10 g/kg。
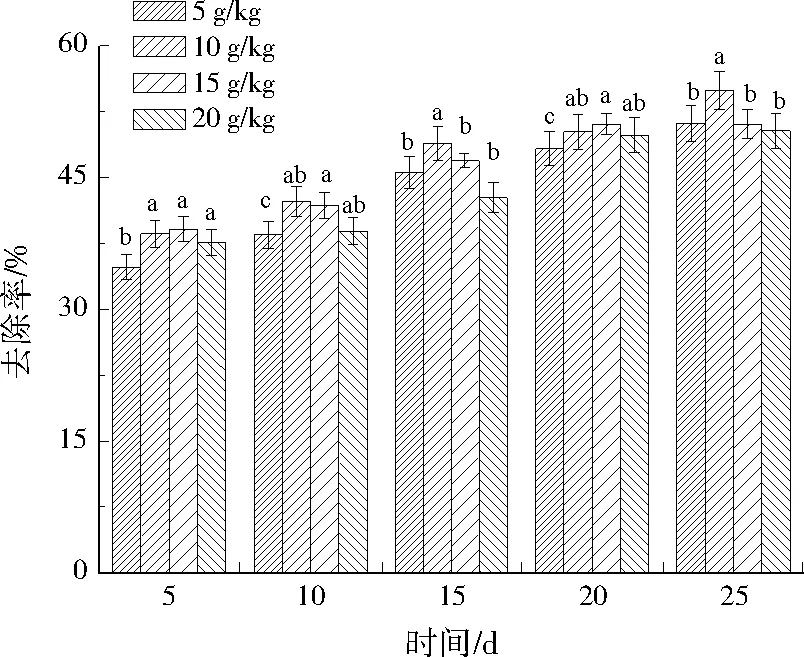
图4 不同氮源投加量对修复效果的影响Fig.4 Effect of different nitrogen sources dosage on repairing result
2.2.3 土壤含水率的影响
含水率是限制微生物生长活动的因素,微生物的繁殖离不开水,土壤含水率过低,不能满足微生物的生长要求,代谢活动受限,影响对Cr(Ⅵ)的去除。在不同土壤含水率条件下,Cr(Ⅵ)去除率如图5所示。BC-MT随着时间的延长,对Cr(Ⅵ)的去除率呈不同程度升高。土壤含水率为14%时,去除率最大达到60.01%;土壤含水率为23%时,去除率最低,实验中还可以观察到土壤已经呈泥浆状态,妨碍微生物的有氧呼吸,使好氧微生物因缺氧而死亡,最高去除率仅为48.36%。因此,BC-MT修复铬污染土壤的最佳土壤含水率应为14%。
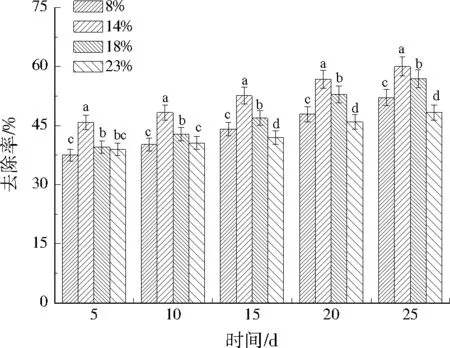
图5 不同土壤含水率对修复效果的影响Fig.5 Effect of different soil moisture content on repairing result
2.2.4 对比实验结果
铬污染土壤经BC-MT组、生物炭组、微生物菌液组及对照组的修复结果如图6、图7所示。对照组随着时间延长,去除率无显著变化,生物炭组、微生物菌液组均能去除Cr(Ⅵ)。生物炭组在前期去除速率较快,5 d去除率达到了15.06%,后期处理效果不显著,25 d去除率为45.94%。而微生物菌液组的5 d去除率仅为10.40%,但15 d去除率达到了40.78%,25 d去除率为50.62%。这可能是由于生物炭进入土壤中可以直接快速作用于Cr(Ⅵ),而微生物则需要时间适应土壤环境,而适应环境的微生物在后期起到了作用。BC-MT组综合了生物炭组与微生物菌液组的优点,其5 d去除率达到了18.50%,25 d去除率达到64.35%,可提取态铬降至7.70 mg/L。生物炭组、微生物菌液组处理25 d,可提取态铬分别降至10.80、11.50 mg/L。因此,各处理组均有降低重金属生物有效性的能力,BC-MT组效果最好。
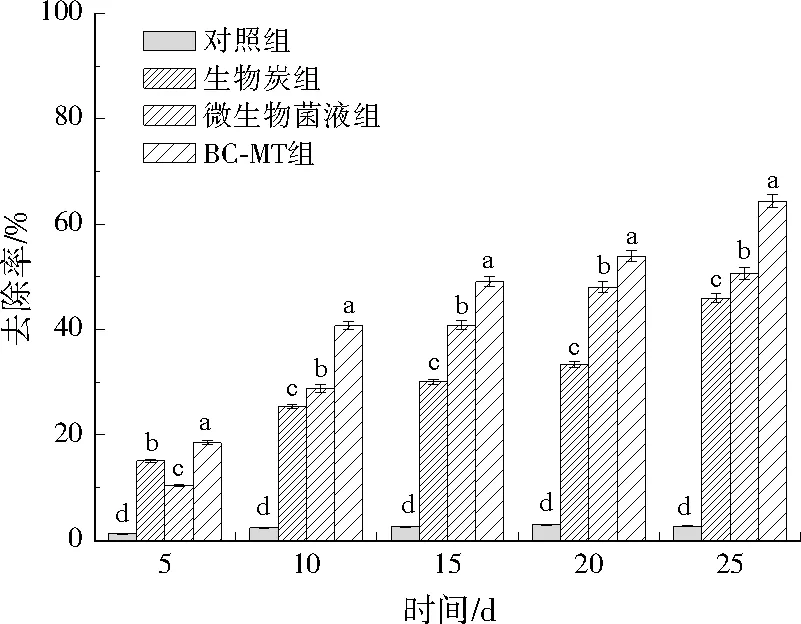
图6 不同处理组的Cr(Ⅵ)去除率变化Fig.6 Changes of Cr(Ⅵ) removal rate in different treatment groups
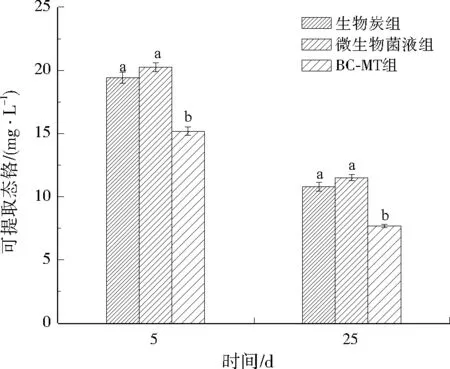
图7 不同处理组的可提取态铬质量浓度Fig.7 Changes of extractable chromium concentration in different treatment groups
2.3 盆栽实验结果
2.3.1 各处理组对植物地上、地下铬积累的影响
S5、S6处理的植物发芽后干枯死亡,无法检测植物各项指标,所以不再讨论S5、S6。这可能是因为生物炭含量过高导致土壤营养失调[27]。有研究表明,适当施加生物炭能够促进植物生长,不会造成土壤中总氮损失,反之则会引起NH3挥发,总氮含量下降,降低对植物生长的促进作用[28]。
各处理组对植物地上、地下铬积累的影响如图8所示。与S8(作为对照)相比,添加3% BC-MT(S4)时,植物地上、地下部分总铬分别降低了65.15%、49.76%,Cr(Ⅵ)分别降低了94.11%、87.74%。说明适量的BC-MT能够有效降低植物中总铬及Cr(Ⅵ)含量,这是因为生物炭和细菌都具有与Cr(Ⅵ)发生络合反应的官能团,生成稳定的络合物,促进植物生长[29]。S8虽然没有做任何处理,Cr(Ⅵ)仍然有所降低,这可能与植物的自然毒性反应有关。各个处理均减少了植物根部对铬的吸收转移,降低了铬通过食物链对人体造成危害的风险。
2.3.2 各处理对植物生长及生化指标的影响
各处理组对植物生长及生化指标的影响如图9所示。植物株高、生物量、可溶性糖、叶绿素基本上均表现为S7>S4>S3>S2>S1>S8。S7的植物能够生长到45.6 cm,生物量(以干重计,下同)为254 mg。S8的植物仅能生长至21.2 cm,生物量为50 mg。生物量变化趋势与株高相似。
铬的毒性抑制了植物的生长,当添加生物炭和BC-MT时,植物的生长得到了明显改善。有研究表明,生物炭对土壤的理化性质具有积极的影响,生物炭可以增加土壤水分和养分的保持能力,从而促进植物的生长[30]。而铬还原菌能够降低铬毒性,提高玉米对Cr(Ⅵ)的抗逆性。FAISAL等[31]研究表明,添加假单胞菌属(Pseudomonas)、固氮螺菌属(Azospirillum)和农杆菌属(Agrobacterium)细菌能够促进小麦、玉米和豆类植物的生长和养分吸收。
由于重金属的毒性,植物的光合机制受到影响,叶绿体结构改变,气孔关闭,植物细胞中CO2固定、电子传递、光合磷酸化、酶活性等发生变化[32],所以在铬污染土壤中植物的叶绿素含量减少。相比S8,添加3% BC-MT(S4)可以减少铬的毒性,株高增加了17.7 cm,生物量增加了132 mg,叶绿素增加了4.65 mg/g,可溶性糖增加了1.69 mg/g。施加BC-MT能够最大化促进植物生长,减低铬对植物的胁迫。
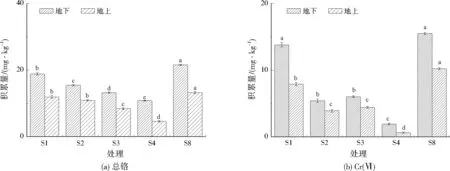
图8 各处理对植物地上、地下铬积累的影响Fig.8 The effect of each treatment group on the accumulation of aboveground and underground chromium in plants
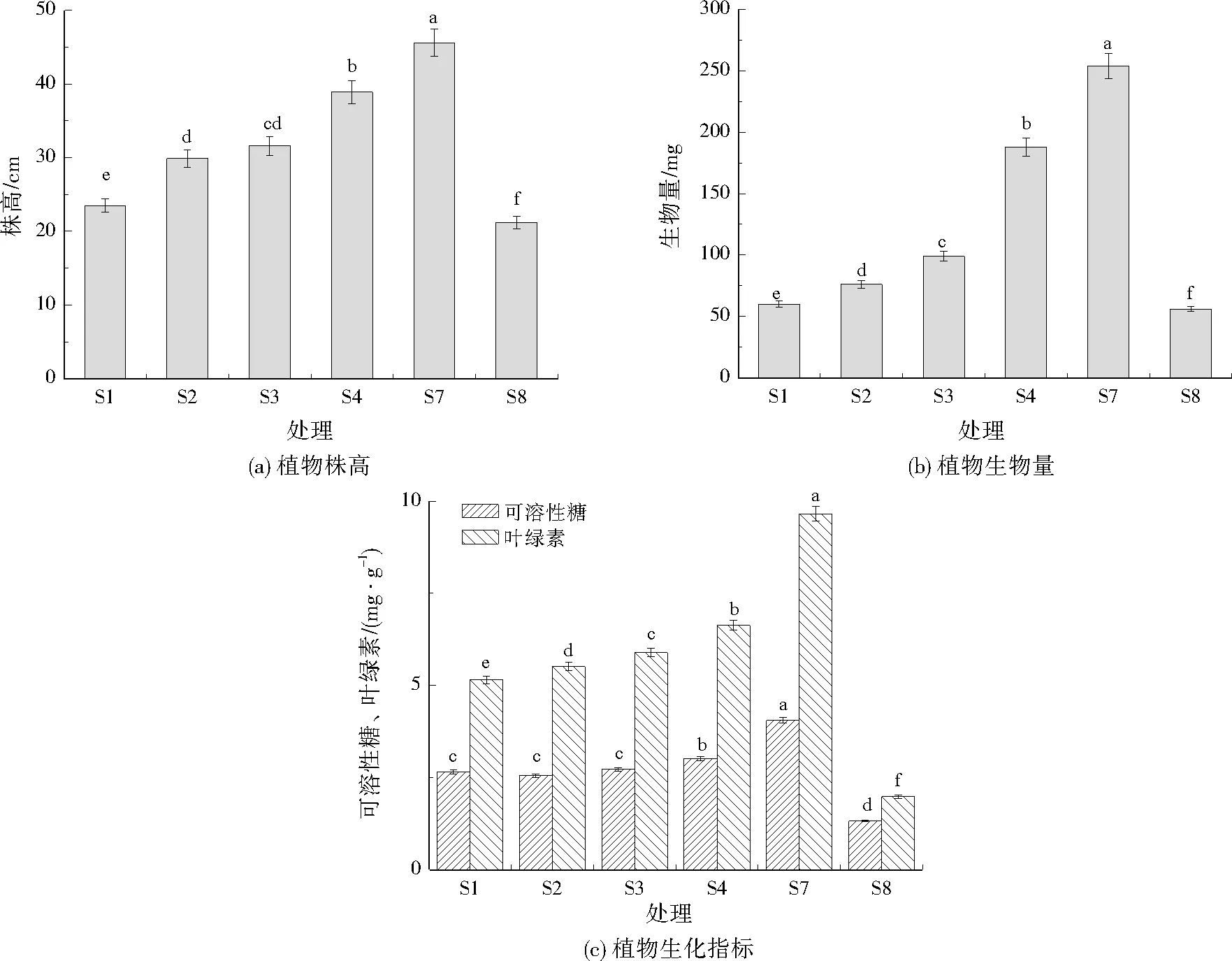
图9 各处理对植物生长、生化指标的影响Fig.9 Effects of different treatments on plant growth and biochemical indices
3 结 论
(1) BC-MT修复铬污染土壤最佳条件为:BC-MT投加量3%,氮源投加量10 g/kg、土壤含水率14%。生物炭、微生物菌液、BC-MT在最优条件下修复25 d的Cr(Ⅵ)去除率分别为45.94%、50.62%、64.35%,BC-MT修复效果最为显著。
(2) 施加3% BC-MT对铬污染土壤中玉米生长有明显的促生作用,植物地上、地下部分总铬分别降低了65.15%、49.76%,Cr(Ⅵ)分别降低了94.11%、87.74%;植物株高增加了17.7 cm,生物量增加了132 mg,叶绿素增加了4.65 mg/g,可溶性糖增加了1.69 mg/g。

