CdS纳米粒子对染料的光催化降解及其对大肠杆菌生物毒性的研究*
王健淇 赵 敏 王 赫 袁 月 闫新元 崔岱宗
(东北林业大学生命科学学院,黑龙江 哈尔滨 150040)
染料已广泛用于印染、纺织、食品、药品和化妆品等行业[1]。现在人工合成的染料已超过10万种,全球每年生产的染料总量超过70万t[2]。全世界每年约有3万t染料未经任何处理即随废水排放到环境中,对环境造成严重污染。纺织业、造纸业及印刷业等行业排放的染料废水是主要污染源。解决染料废水的处理问题迫在眉睫,寻求治理染料污染的有效且经济的处理新技术已受到科研工作者们的极高关注[3]。
目前,处理染料废水的方法主要有物理法、化学法和生物法[4]。其中,化学法能快速、高效地去除种类更多的污染物,特别是生物法不能有效降解的一些结构复杂的污染物。化学处理设备容易操作,也容易实现自动检测和控制,而且处理后一些污染物能回收利用。化学处理系统能实现一些工业用水的闭路循环,在水和其他资源日渐短缺的现状下,化学法将获得更大的发展[5]。
近年来,光催化剂在催化降解染料废水工艺中得到了广泛应用。WELDERFAEL等[6]尝试通过化学沉淀法制备Ag和N共掺杂的ZnO光催化剂降解亚甲基蓝。RUZIMURADOV等[7]成功制备了N-La共掺杂SrTiO3-TiO2复合光催化剂降解罗丹明B。
研究表明,TiO2型、CdS型、钙钛矿型、Bi2O3型等类型光催化剂均广泛应用于不同类型污染物的光催化降解中,其中CdS作为一种氧化还原型半导体材料,其优越的光催化性能近些年来引起广泛关注[8]。与其他半导体材料相比,CdS具有更合适的价带导带位置;相对于其他导带材料,CdS还原电位足够低,还原能力较强。CdS是一种Ⅱ~Ⅵ族半导体催化剂,带隙为2.4 eV,是一种窄带隙半导体,与TiO2、ZnS等只能在紫外光区被激发的半导体相比,CdS的发射光谱范围广,大都集中在400~600 nm,吸收范围较大,也可吸收可见光[9]。当前CdS纳米粒子在可见光下作为光催化剂,其出色的降解能力已逐渐被人们所关注[10-11]。染料废水色度高,染料质量浓度一般为5~1 500 mg/L[12]。CdS纳米粒子在可见光的照射下将脂肪族化合物、芳烃、聚合物、染料等有机污染物降解为小分子物质甚至可完全矿化为CO2、水和矿物酸。在污染物降解过程中没有废渣需要处理,并且反应温度和压力等条件温和[13]。因此,将CdS纳米粒子作为光催化剂用于染料光催化降解中,探索染料光催化降解特性,为治理污水起到了重要作用。
CdS纳米粒子的制备主要有物理法、生物法、化学法。物理法制备工艺简单,产物颗粒易控,但制备的纳米粒子处于离散胶体状态,难以收集。生物法实现了绿色化工生产,避免了外部还原剂或溶液造成的二次污染。然而,由于微生物的生理活性受到环境因素的影响,实现纳米粒子产品的单分散性、均匀性及大规模生产CdS纳米粒子仍然颇具挑战性。化学法通过控制溶液中沉淀剂的浓度,使沉淀缓慢增加直至处于平衡状态,且沉淀能在整个溶液中出现,克服了由外加沉淀剂造成沉淀剂的局部不均匀性而导致沉淀不能在整个溶液中均匀出现的弊端。沉淀法制备速度快、方法简单、易大规模生产,已获得广泛应用[14-15]。
金属纳米颗粒已广泛应用于医疗、环境保护、新能源等行业,大量的纳米颗粒被释放到环境中。已有报道显示,CdS纳米粒子对原核和真核生物均可产生毒性,但CdS纳米粒子对细胞的生物毒性机制尚未完全确定[16-18];在CdS纳米粒子存在的情况下,大肠杆菌(Escherichiacoli)细胞形态由球状转变为丝状;在CdS纳米粒子作用下,大肠杆菌细胞内活性氧含量明显增加,细胞活力与活性氧水平呈负相关,氧化应激可能是纳米粒子对大肠杆菌细胞产生生物毒性的关键原因[19-20]。
本研究采用化学沉淀法,以3-巯基丙酸(MPA)作为封端剂制备CdS纳米粒子,通过傅立叶红外光谱(FTIR)、X射线衍射(XRD)分析CdS纳米粒子的表观特征及结构,并将其应用于对具有不同化学结构合成染料的脱色研究,考查CdS纳米粒子在可见光的催化下对染料的脱色特性,初步探讨CdS纳米粒子对微生物的毒性。
1 材料与方法
1.1 主要药品
CdCl2、Na2S、MPA(纯度≥98.0%)、超氧化物歧化(SOD)酶试剂盒(G0101F)、过氧化氢酶试剂盒、BCA蛋白含量测定试剂盒等均外购;甲基橙(最大吸收波长(λmax)=464 nm)、考马斯亮蓝(λmax=557 nm)、刚果红(λmax=527 nm)等均为分析纯。
1.2 CdS纳米粒子的制备
25 mL水溶液中加入635 μL的MPA溶液,以5 mL/min的速度将MPA溶液缓慢滴入25 mL CdCl2(1.14 g) 溶液并持续机械搅拌30 min。将1.2 g Na2S溶于50 mL水中,以5 mL/min的速度加入到之前的混合液,于1 000 r/min下匀速搅拌4 h,直到形成含有CdS纳米粒子的黄色溶液。8 000 r/min下离心5 min,弃上清液。将CdS纳米粒子用去离子水润洗,重悬,重复操作3次。将CdS纳米粒子收集后,于70 ℃真空干燥8 h,于黑暗条件下室温密闭保存待用。
1.3 CdS纳米粒子表征方法
采用FTIR和XRD等技术对CdS纳米粒子的形态、晶体组成和官能团结构进行分析。
将充分干燥的新制备CdS纳米粒子在玻璃测定模具中进行压片,压片平齐,将样品置于XRD仪(X’Pert3Powder)中,扫描范围10°~80°,扫描速度10°/min。
将溴化钾研磨成粉末,压成片,作为背景。将CdS纳米粒子研磨,加入一定量的酒精,在超声清洗仪(KQ-500DE)中超声10 min,吸取一滴混合液体,滴加到溴化钾片上,放入FTIR仪(Nicolet iS50),测量范围400~4 000 cm-1。
1.4 CdS纳米粒子对合成染料脱色效果
1.4.1 CdS纳米粒子对染料光催化能力的测定
分别配制不同种类的染料甲基橙、刚果红、考马斯亮蓝溶液,质量浓度均为20 mg/L,将30 mg的CdS纳米粒子加入含有12 mL染料的石英试管中,漩涡振荡3 min,然后超声30 min,使CdS纳米粒子在降解体系中分散均匀。将黑暗组石英试管用锡箔纸包好,光照组和黑暗组分别放在摇床上,于30 ℃、120 r/min下持续振荡,间隔时间(0~4 h)内取样2 mL,10 000 r/min离心2 min后取上清液,测定吸光度。测完吸光度后将2 mL样品倒回试管,保持脱色体系不变,进行下一步的脱色。
1.4.2 CdS纳米粒子对染料的连续脱色能力测定
构建如1.4.1节所述脱色体系,脱色处理 120 min后,将溶液10 000 r/min 离心2 min取上清液继续加入染料,120 min后重新测定染料的脱色率,重复上述步骤若干循环,直至染料不能再脱色。
1.4.3 CdS纳米粒子对不同浓度染料脱色能力的测定
取石英试管,分别加入20、30、40、50、100 mg/L的甲基橙溶液12 mL,每个浓度各两个。每个石英试管中加入30 mg CdS纳米粒子,漩涡振荡,80 W超声30 min之后,取出2 mL,以蒸馏水作为对照,在464 nm下测定初始吸光度。再将所有试管放入160 r/min的摇床上,用30 W、50 Hz、6 000 K的光源照射6 h,以蒸馏水作为对照,在464 nm下测定吸光度。
1.5 CdS纳米粒子对大肠杆菌细胞的生物毒性
选用大肠杆菌作为模式微生物,考察菌体暴露于不同浓度的CdS纳米粒子溶液中时所受到的生物毒性。
1.5.1 大肠杆菌的复苏
对实验室保存的大肠杆菌菌种进行平板划线,37 ℃培养过夜,挑取单菌落,接种到LB培养基中,在37 ℃、180 r/min下振荡培养4 h后,分装至1.5 mL离心管中,每管加入600 μL菌液和400 μL 50%(质量分数)甘油,-20 ℃冰箱中保存备用。
将保存的甘油菌于30 ℃、180 r/min下振荡过夜培养,8 000 r/min离心3 min,灭菌蒸馏水洗涤3次,每次洗涤后8 000 r/min离心3 min。清洗后,用3 mL灭菌蒸馏水重悬,更换至新鲜的LB培养基中。
1.5.2 大肠杆菌的培养
将复苏后的大肠杆菌以接种量1%(体积分数)接种至LB液体培养基中,于37 ℃、150 r/min下振荡培养8 h。将菌液于8 000 r/min离心3 min,收集菌体,用灭菌蒸馏水润洗3次后,加菌至磷酸缓冲盐(PBS)缓冲液重悬,使菌液在600 nm波长处吸光度(OD600)为0.8,对菌液进行分装,每瓶3 mL菌液。向各瓶菌液中分别加入20、100、200 mg/L CdS纳米粒子溶液,以体系中不加入CdS纳米粒子的菌液作为对照。将各瓶菌液于37 ℃、150 r/min下避光振荡孵育12 h。
1.5.3 大肠杆菌的平板计数和酶活性的测定
加菌至PBS缓冲液,调至OD600=0.8,分别加入0(对照)、20、100、200 mg/L CdS纳米粒子,37 ℃恒温振荡培养12 h,测定OD600。取培养液进行稀释(稀释倍数为104~106),取50 μL涂布,37 ℃过夜培养,数单菌落,进行生物毒性对比。
依照过氧化氢酶试剂盒、SOD酶试剂盒和BCA蛋白含量测定试剂盒使用说明进行酶活检测。
2 结果与分析
2.1 CdS纳米粒子表征结果
如图1所示,CdS纳米粒子在27.36°、45.83°处分别存在2个衍射峰。与标准CdS图谱比对,27.36°、45.83°分别对应CdS纳米粒子立方晶型的(111)晶面、六面晶型的(103)晶面。可见,本研究所制得的CdS纳米粒子为立方和六面晶型的混合物。
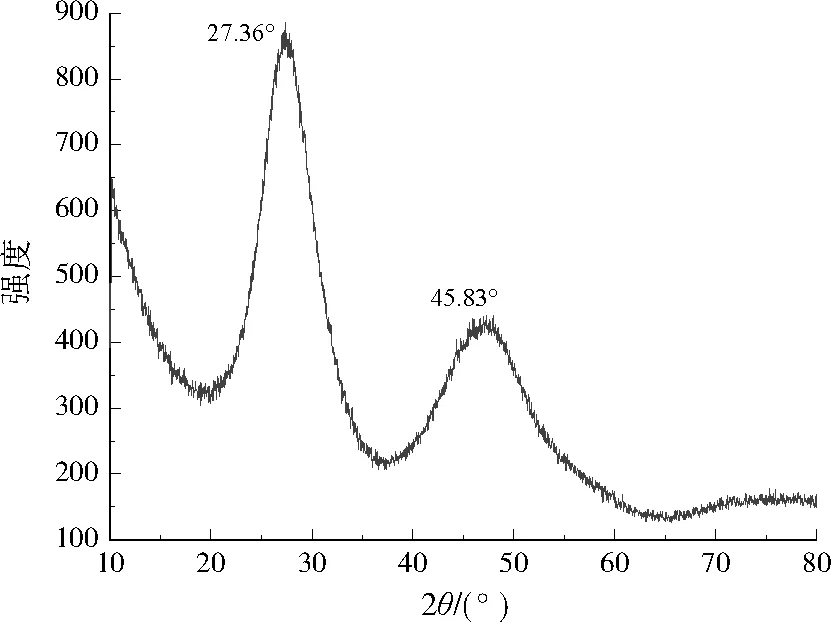
图1 CdS纳米粒子的XRD分析Fig.1 XRD analysis of CdS nanoparticles
由图2可见,636、840 cm-1是典型Cd—S红外吸收特征,说明有CdS纳米粒子产生;1 400 cm-1可能是亚甲基对称变形振动吸收峰;1 530 cm-1可能是亚甲基弯曲振动吸收峰,2 920 cm-1可能是亚甲基伸缩振动吸收峰;1 700 cm-1是羰基振动吸收峰,说明化合物可能存在C=O。这些吸收峰说明充分洗涤后的纳米晶表面依然存在亚甲基、羰基等杂质化学基团,可能是在制备中残留。未发现游离巯基在2 500、2 600 cm-1的特征吸收峰,说明巯基应不是以简单的物理吸附,而是以化学键的形式和纳米晶表面Cd相结合。
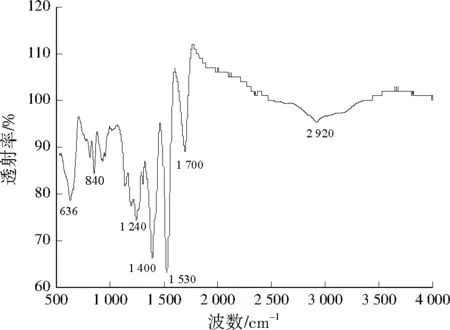
图2 CdS纳米粒子的FTIR分析Fig.2 FTIR analysis of CdS nanoparticles
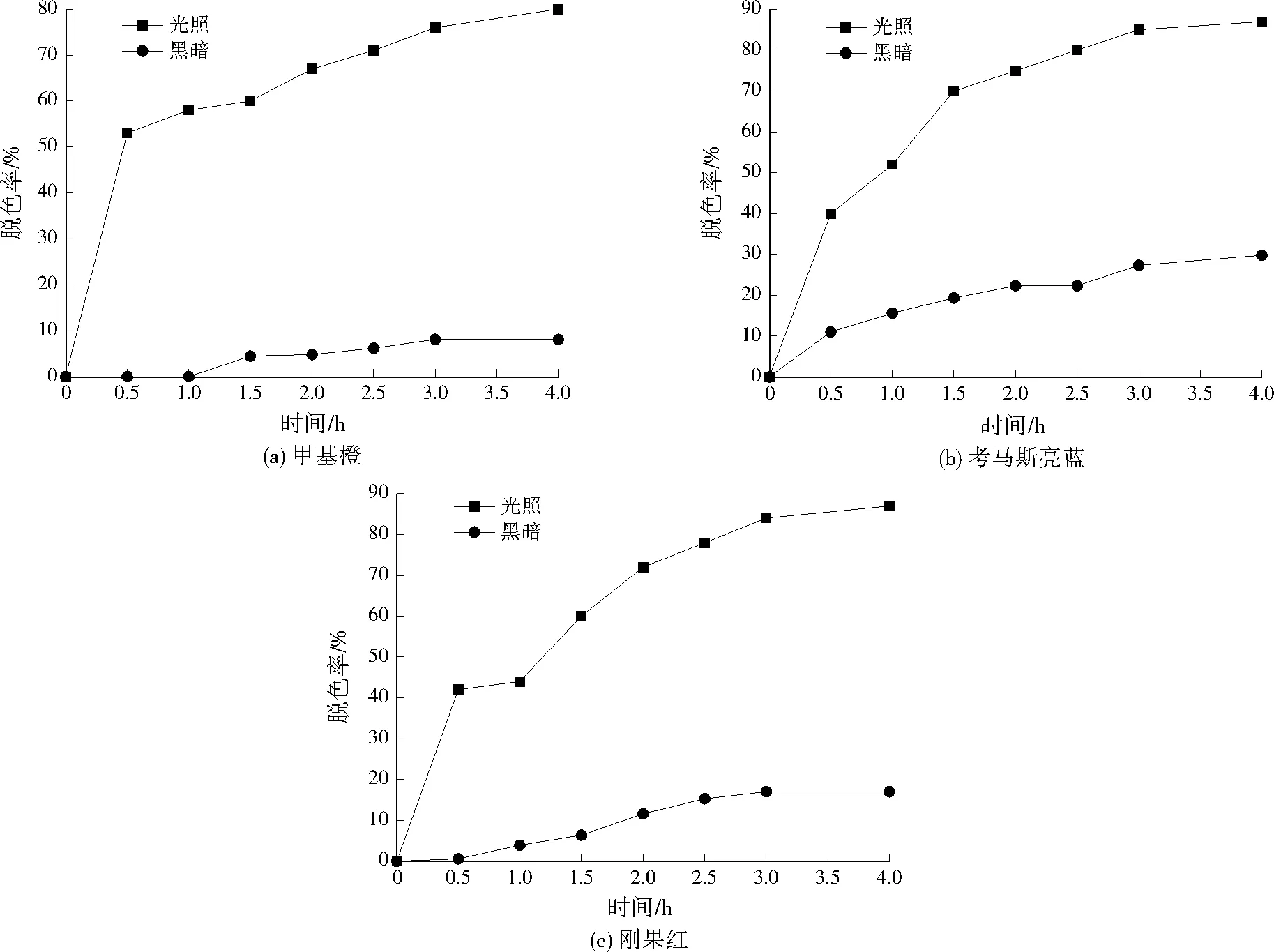
图3 CdS纳米粒子对不同染料的脱色处理Fig.3 Decolorization of different dyes by using CdS nanoparticles
2.2 CdS纳米粒子对不同染料的可见光催化脱色效果
如图3所示,光照条件下,甲基橙、考马斯亮蓝及刚果红脱色率均随着时间的延长而逐渐增加,4 h时3种染料的脱色率均为70%以上,而黑暗条件下均不超过30%,这表明,CdS纳米粒子可在可见光照射条件下高效催化各类染料脱色,此外材料本身对染料的吸附脱色作用有限。
2.2.1 CdS纳米粒子光催化对连续投加染料的降解能力
由表1可见,CdS纳米粒子在第1次光催化循环内对体系中甲基橙的脱色率为64%,第2、3次分别可达到51%、36%。而作为对照的黑暗组处理在4次循环中染料均未有明显脱色。这表明,本研究所合成的CdS纳米粒子有能力对连续添加的染料进行降解。

表1 CdS纳米粒子对甲基橙的连续脱色
2.2.2 CdS纳米粒子对不同浓度染料的脱色结果
前期实验中,当甲基橙质量浓度为5、10 mg/L时,CdS纳米粒子对甲基橙的吸附率分别为20%、26%,使甲基橙初始吸光度很小,导致甲基橙脱色实验误差加大,因此后续实验从20 mg/L开始进行考察。由表2可看出,甲基橙溶液浓度越高脱色率越低。光照条件下,当甲基橙质量浓度为20 mg/L时,CdS纳米粒子对甲基橙脱色率为80%;当甲基橙质量浓度为30、40、50 mg/L时,脱色率分别为78%、69%、55%。黑暗条件下,CdS纳米粒子对100 mg/L以上的甲基橙的脱色率基本为0。
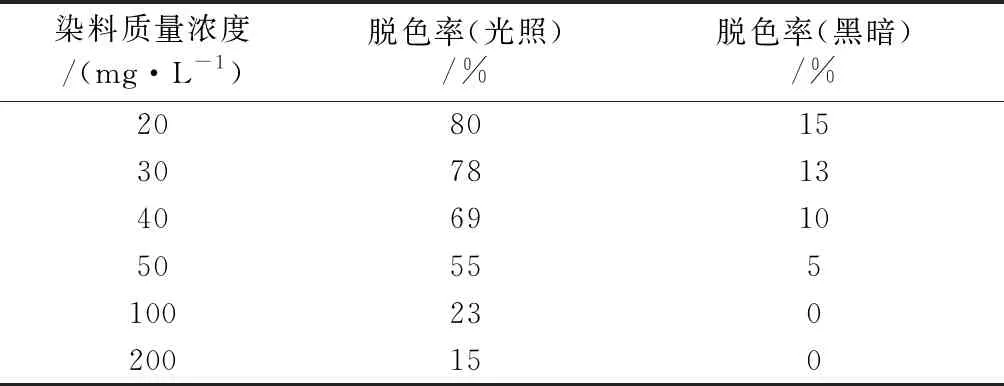
表2 CdS纳米粒子对不同质量浓度甲基橙的脱色

表3 CdS纳米粒子质量浓度对大肠杆菌、SOD酶活性和过氧化氢酶活性的影响
2.3 CdS纳米粒子对生物毒性的研究
由表3可看出,100、200 mg/L CdS纳米粒子的细菌数不在同一数量级,高浓度CdS纳米粒子抑制了大肠杆菌的生长;20 mg/L CdS纳米粒子的细菌数数量级与对照没有明显差异。SOD酶活性均比对照高,CdS纳米粒子为20、100、200 mg/L时比对照提升了4%、43%、103%。随着CdS纳米粒子浓度升高,过氧化氢酶活性先升高,当CdS纳米粒子达到200 mg/L时下降,可能是高浓度的CdS纳米粒子对大肠杆菌生物毒性过强,导致杀死大部分细胞,从而也导致细菌数下降;不同浓度 CdS纳米粒子下过氧化氢酶活性均比对照高。综上所述,CdS纳米粒子浓度越高,对大肠杆菌生物毒性越大。
3 结 论
(1) 采用化学沉积法合成的CdS纳米粒子为立方和六面晶型的混合物。
(2) 光照条件下,4 h时甲基橙、考马斯亮蓝及刚果红脱色率均为70%以上;黑暗条件下均不超过30%。CdS纳米粒子可在可见光照射条件下高效催化各类染料脱色。
(3) CdS纳米粒子在第1次光催化循环内对体系中甲基橙的脱色率为64%,第2、3次分别可达到51%、36%。CdS纳米粒子有能力对连续添加的染料进行降解。
(4) CdS纳米粒子对大肠杆菌具有较高生物毒性,且CdS纳米粒子浓度越高,对大肠杆菌生物毒性越大。

