新型大孔径介孔二氧化硅吸附牛血清蛋白的性能研究
庞 明,牟 渊,刘俊翔,陈利群,周 彬
(1 嘉兴求源检测技术有限公司,浙江 嘉兴 314001;2 嘉兴港区(综合保税区)生态环境监测站,浙江 嘉兴 314201)
自从1992年mobil公司发明MCM-41以来,介孔二氧化硅材料(mesoporous silica,MS)在这二十几年的时间里经历了飞速的发展。由于具有高比表面积、大孔容、优异的生物相容性、可修饰的表面以及可调节的孔径(2~50 nm),MS被广泛应用于催化[1]、蛋白吸附分离[2-4]、光学[5]以及生物医药[6-8]等领域。除此之外,研究表明将蛋白装载在介孔当中能够提高蛋白的热稳定性,因此MS在蛋白装载领域具有巨大的应用潜力。相比于药物分子,蛋白分子具有较大的分子尺寸,因此需要合成具有大介孔尺寸的MS。目前常见的合成大孔MS的方法是在合成过程中加入有机溶剂(如1,3,5-三甲苯)作为扩孔剂[9]。虽然使用这种方法合成的MS具有大孔径和高孔容,但是有机溶剂的加入使合成过程变得复杂。
绝大多数MS的合成过程都是硅酸物种与有机模板作用形成有机无机复合物,然后将有机模板去除得到相应的介孔结构。高温煅烧[10]和有机溶剂萃取[11-12]是两种常见的去除有机模板的方法。虽然高温煅烧能够彻底去除有机模板,但是在高温下(550 ℃)有机模板脱除的同时材料内外表面的大量Si-OH也会随之消失。大量Si-OH的存在不仅能够增强MS的亲水性,更重要的是能够使MS的功能化变的容易,因此在MS的应用中起到关键作用。有机溶剂萃取在较低温度(< 100 ℃)下进行,可以避免Si-OH的失去,但是即使重复多次也不能够将有机模板完全去除。目前还没有一种方法能够合成出不带有机模板的MS。
本文利用简单的一步法创新地合成了不带模板剂的新型大孔径介孔氧化硅(large pore mesoporous silica,LPMS)。然后对LPMS的合成机理进行了阐释。最后,选择牛血清蛋白(BSA)作为模型蛋白研究LPMS对蛋白的吸附能力,研究的LPMS的吸附动力学和吸附等温线。
1 实 验
1.1 试剂及仪器
嵌段共聚物PEO20-PPO70-PEO20(P123),BASF;牛血清蛋白(Bovine serum albumin,BSA),Aldrich;正硅酸乙酯、浓盐酸、无水乙醇、醋酸,上海凌锋化学试剂有限公司(均为分析纯);去离子水,自制。
S-4800扫描电子显微镜(SEM,加速电压1.0 kV);X射线衍射光谱仪,比表面积和孔尺寸分析仪(Micromeritics Tristar II 3020);FT-IR傅里叶红外分析仪,Nicolet;NETZSCH STA 409PC热重分析仪,TGA。
1.2 大孔径介孔二氧化硅的制备
制备LPMS的具体步骤如下:首先2.0 g P123溶解在70 mL去离子水和20 mL HCl(2 mol/L)的混合溶液中,将1.2 g TEOS加入上述溶液后,在室温下剧烈搅拌30 min。得到的混合物转移到100 mL聚四氟乙烯内衬的高温高压反应釜内,在80 ℃下处理6 h后,将温度升至160 ℃并保持12 h。通过抽滤得到产物,并用大量去离子水和乙醇洗涤,在100 ℃下真空干燥过夜,即的到白色LPMS粉末。作为对比将干燥后的LPMS在马弗炉中550 ℃下煅烧6 h,升温速率为1.5 ℃/min,得到的样品命名为LPMS-cal。
1.3 牛血清蛋白吸附性能研究
静态吸附实验:20 mg LPMS和LPMS-cal加入到20 mL装有不同BSA浓度的罗口瓶中(浓度范围0.10~0.60 mg/mL),吸附一定时间后,离心分离,用UV-vis光谱测定BSA的平衡浓度,计算LPMS和LPMS-cal对BSA的吸附容量。动态吸附实验:通过测定不同吸附时间下的吸附容量来研究LPMS和LPMS-cal的动力学模型。20 mg LPMS/LPMS-cal加入到20 mL装有固定BSA浓度的罗口瓶中,吸附时间为5~120 min,用UV-vis光谱测定不同吸附时间下的吸附容量。LPMS和LPMS-cal的吸附动力学用准一、二级动力学模型进行拟合。吸附等温线用Langmiur和Freundlich模型进行拟合。
两种动力学模型的方程表达式为:
准一级动力学模型:
ln(qe-qt)=lnqe-k1t
(1)
准二级动力学模型:
(2)
其中:qe为LPMS/LPMS-cal的平衡吸附容量,mg/g;qt为时间t时的吸附容量,mg/g。k1和k2分别是准一级、准二级吸附速率常数。
Langmiur模型的线性数学表达式表示为:
(3)
Ce是BSA的平衡浓度,mg/L;qe是平衡时的吸附容量,mg/g;kL为Langmuir 常数,L/mg;qmax代表最大吸附容量,mg/g。
Freundlich吸附等式的线性形式如下:
logqe=logkF+(n)logCe
(4)
kF是Freundlich 常数,mmol1-n·Ln·g-1;n是吸附强度。
2 结果与讨论
2.1 LPMS的表征
图1a,b是LPMS不同倍数的SEM照片。通过低倍SEM照片(图1a)可以看出LPMS是一种类球形的颗粒,尺寸大约在5~10 μm,而在高倍的SEM照片(图1b)中可以清晰观察到LPMS表面的介孔结构。

图1 LPMS不同倍数的SEM照片(a,b)和LPMS的广角XRD图谱(c)
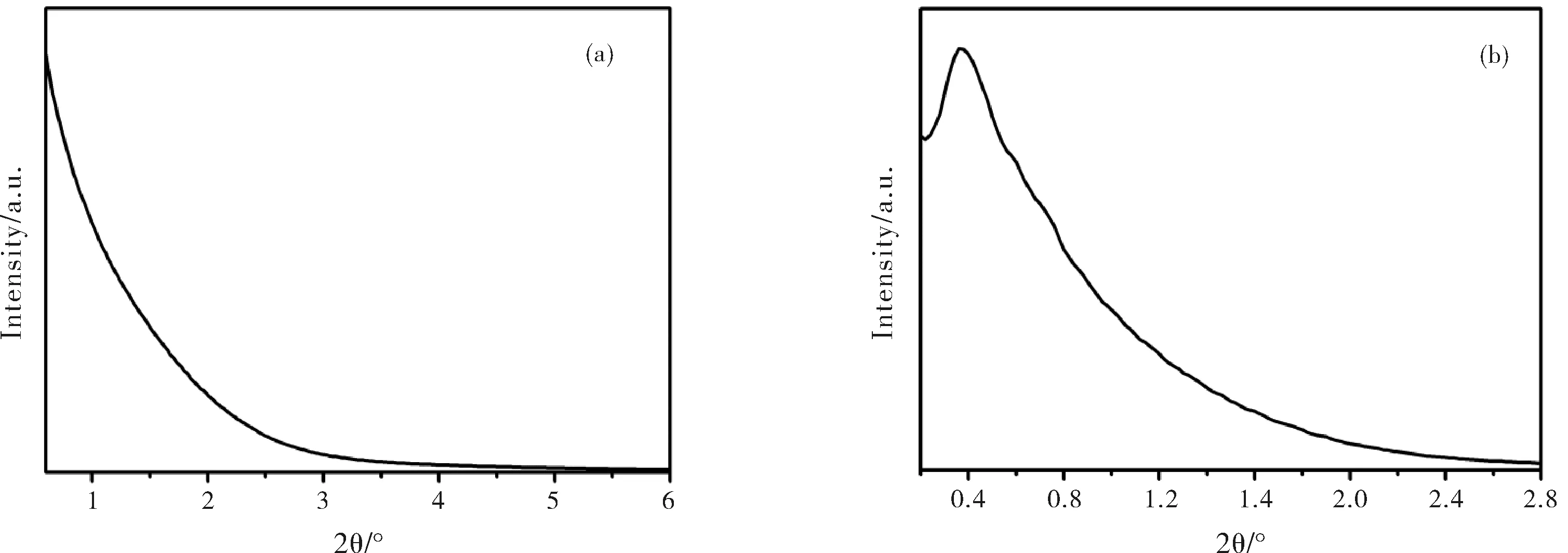
图2 LPMS的小角X射线衍射(a)和小角X射线散射(b)
图1c为LPMS的广角XRD谱图,可以看出LPMS在22°左右有一个宽化的衍射峰,这表明LPMS是典型的无定形态SiO2。图2a为LPMS的SAXRD图谱,通过SAXRD图谱可以观察到LPMS在0.6°~6°没有衍射峰;图2b为LPMS的SXRS图谱,可以观察到在0.4°左右出现了明显的散射峰。由布拉格方程原理可知,当介孔材料的介孔尺寸增大时,衍射峰向小角移动,因此可以进一步证明LPMS的大孔结构。
图3a是LPMS和LPMS-cal的红外谱图。由文献可知,P123的红外特征峰为C-H的伸缩振动峰(2860~2976 cm-1)和弯曲振动峰(1350~1460 cm-1)。而在LPMS和LPMS-cal的红外图谱上只观察到了Si-O-Si的特征峰(1085、800以及470 cm-1)和Si-OH的特征峰(960 cm-1),并没有观察到C-H的特征峰,这表明样品中均不含有机模板剂。更为重要的是LPMS的Si-OH特征峰强度明显强于LPMS-cal,这是由于高温煅烧造成了LPMS-cal内外表面大量Si-OH损失。和无机骨架相比,有机模板分解温度低,因此TG是一种判断介孔材料中有机模板含量的有效方法。对于传统的介孔二氧化硅材料(如SBA-15、MCM-41等),在没有去除有机模板之前材料的热失重主要分为两个阶段:(1)150 ℃之前,失重主要来自于吸附的水分子的脱除;(2)180 ℃以后,失重主要来自于有机模板分解,有一少部分是由于Si-OH的缩合造成硅骨架失去结构水,由有机模板分解造成的热失重一般在50%左右[13-14]。图3b是煅烧前后样品的TG曲线,可以看出热重曲线也分为150 ℃之前和180 ℃之后两个阶段,但LPMS和LPMS-cal在180 ℃以后的失重分别仅为7.2%和4.1%,远远低于50%,进一步证明制备的介孔材料中不含有机模板。LPMS在180 ℃以后的失重略大于LPMS-cal,这是由于LPMS内外表面的Si-OH数量比LPMS-cal多造成的。图3c是样品的氮气吸附脱附等温线,可以看出煅烧前后的样品等温线基本一致,都是典型的IV型等温线,迟滞环为H1型,并且迟滞环的位置在相对压力较高的区域(0.8~0.9),这表明LPMS具有分布窄且尺寸大的介孔结构。图3d是由吸附分支计算得到的BJH孔径分布图,可以看出煅烧前后LPMS孔径分布均比较窄,但LPMS-cal的孔径(20.3 nm)略小于LPMS的孔径(22.8 nm),这是由于高温煅烧会造成硅骨架进一步收缩,从而导致孔径略有减少。除此之外,LPMS和LPMS-cal的比表面积和孔容基本一致(表1)。氮气吸附脱附分析结果表明,在LPMS的合成过程中有机模板已经被脱除,得到的LPMS已经具有良好的介孔结构,不需要通过后处理去除有机模板来得到介孔结构。

表1 样品的介孔结构参数
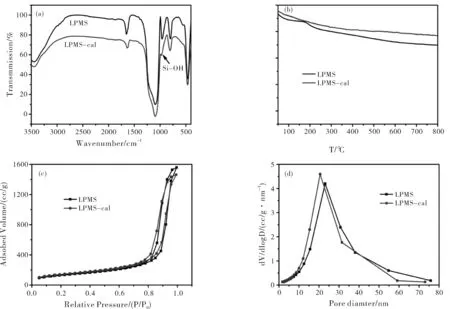
图3 LPMS和LPMS-cal的红外谱图(a);热重曲线(b);氮气吸附脱附等温线(c)和孔径分布图(d)
2.2 LPMS合成机理探讨
LPMS的合成体系与SBA-15相似,都是利用TEOS作为硅源,以及非离子三嵌段共聚物(P123)作为有机模板,P123在溶液中形成胶束,胶束内核为疏水的PPO,而外面则是亲水的PEO,在酸催化作用下TEOS水解并通过氢键与P123胶束亲水端相结合形成有机无机复合体,最后去除有机模板得到具有介孔结构的无定形SiO2。虽然合成体系相似,但是合成出的材料却有很大区别,(1)LPMS不仅具有大孔径和高孔容,并且模板剂在合成过程中被完全脱除。孔径的增大有以下两点原因:①80 ℃反应过程中硅酸物种和P123胶束已经形成有机无机复合物,当温度升高到160 ℃后,胶束的亲水端PEO的亲水性变得更弱,而疏水内核PPO的疏水性则相应增强,导致PEO部分收回到胶束内部并与疏水内核PPO靠近,这样整个胶束的疏水部分变大。由于介孔孔径大小主要依赖于疏水部分的链长,胶束疏水部分变大最终导致介孔孔径变大;②随着160 ℃水热时间的增加,有机模板逐渐脱除,在脱除过程中会造成孔道合并,因此介孔孔径会进一步增大,最终得到不含有机模板的大孔径介孔氧化硅LPMS。
(2)体系的酸浓度不同。由于比SBA-15合成反应温度高很多,如果继续使用相同的酸浓度合成LPMS,那么硅酸物种的水解聚合过快会严重影响与有机模板的共组过程。因此降低酸浓度改善了硅酸物种的水解聚合,这样能够与整个共组过程相匹配,很好的形成有机无机复合物,从而形成介孔结构。
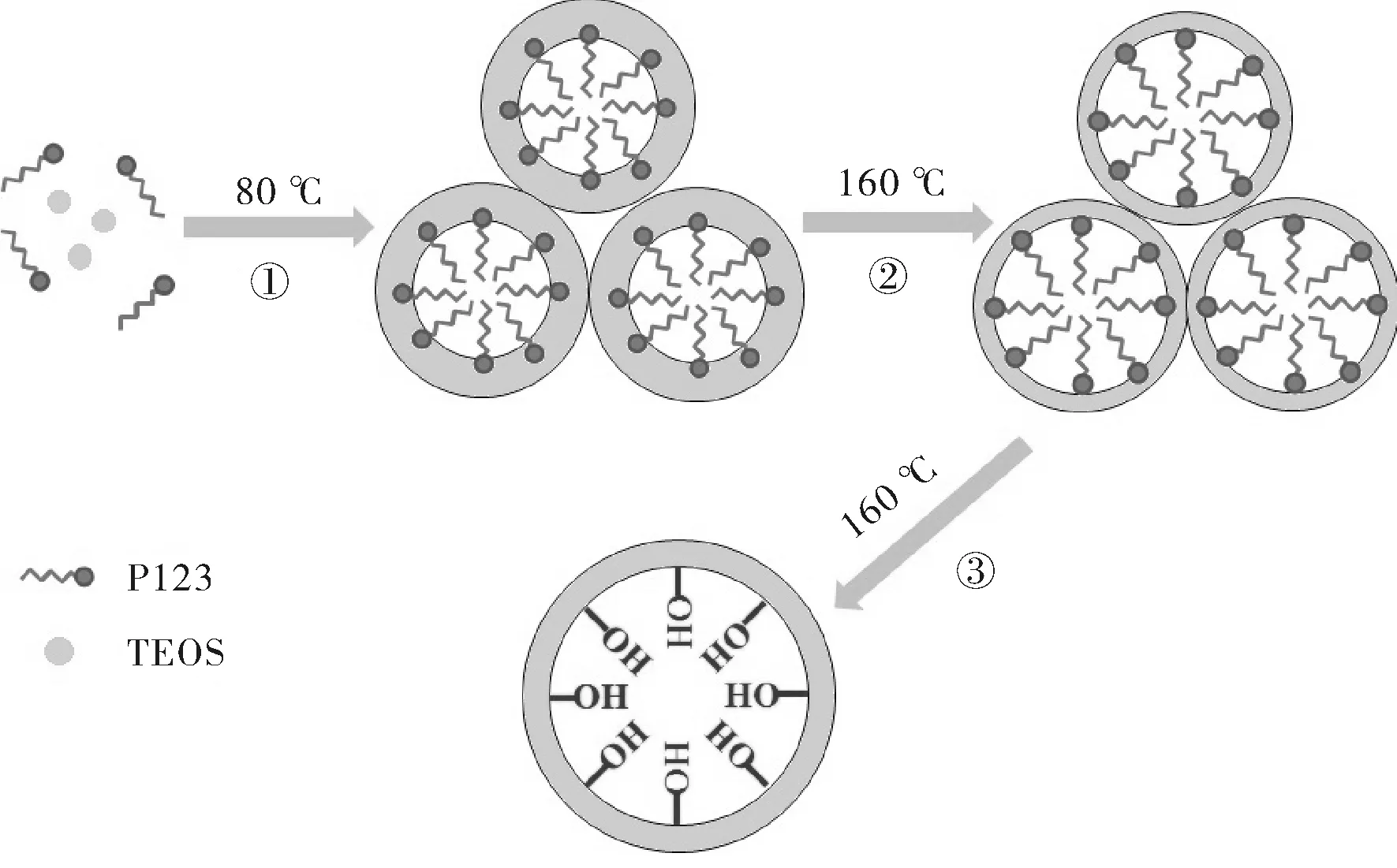
图4 LPMS合成的机理图
图4是LPMS的合成示意图。①是硅酸物种和P123胶束在酸性溶液中80 ℃水热下形成有机无机复合物的过程,即形成介孔结构的过程;②是在160 ℃水热初期由于亲水端PEO的亲水性降低,疏水端PPO的疏水性增强,导致PEO部分收回到胶束内部并与疏水内核PPO靠近,使胶束的疏水部分变大;③是随着160 ℃水热时间的增加模板剂逐渐脱除,介孔孔道合并形成更大尺寸的介孔,最终得到不含有机模板的大孔介孔二氧化硅LPMS,同时在内外表面保留了大量Si-OH。
2.3 牛血清蛋白的吸附性能研究
2.3.1 吸附动力学研究
LPMS和LPMS-cal的吸附动力学曲线如图5a所示。从图5中可以看到,在开始的50分钟内LPMS和LPMS-cal对BSA的吸附表现出较快的吸附动力学,并且在接下来的20分钟内吸附达到饱和。相比而言,LPMS-cal每个时间下的吸附容量都远远低于LPMS,而吸附达到平和时,LPMS和LPMS-cal的吸附容量分别达到了184.2 mg/g和140.8 mg/g,说明LPMS表面具有更多的硅羟基,能更加快速吸附并且高容量的吸附BSA。
实验数据用准一级、准二级吸附动力学模型拟合的参数列于表2。通过对比两种模型的线性相关系数R2和拟合得到的曲线可以发现准二级动力学模型都能够描述LPMS和LPMS-cal吸附BSA的动力学过程(R2>0.99)。由准二级动力学拟合数据得到的LPMS和LPMS-cal的饱和吸附容量(183.8 mg/g和143.2 mg/g)与实验测得的饱和吸附容量(184.2 mg/g和140.8 mg/g)非常接近,进一步说明LPMS和LPMS-cal吸附BSA主要是化学吸附过程。

图5 LPMS和LPMS-cal的吸附动力学(a);准一级动力学模型拟合曲线(b);准二级动力学模型拟合曲线(c)

表2 LPMS and LPMS-cal对BSA的吸附动力学参数
2.3.2 吸附等温线研究
考察了LPMS和LPMS-cal吸附BSA的吸附等温线(图6)。从结果图中可以看到LPMS和LPMS-cal对BSA的吸附容量随着BSA初始浓度的增加而增加,当初始浓度为0.5 mg/mL时吸附达到饱和,最大吸附容量分别为193.2 mg/g和143.8 mg/g。相比而言,LPMS的吸附容量比LPMS-cal的吸附容量要大,研究表明LPMS表面Si-OH能够与蛋白中的NH2形成氢键作用,因此大量Si-OH的存在有利于蛋白的吸附。两种常用的等温线模型对数据进行回归分析,回归曲线见图7所示。计算所得相关参数列于表3,对比这两种等温模型得到的R2以及饱和吸附容量可知Freundlich模型能更好的描述LPMS和LPMS-cal对BSA的吸附过程,吸附数据对Freundlich模型有更好的一致性(R2>0.98),说明LPMS和LPMS-cal吸附BSA是多分子的均匀吸附。
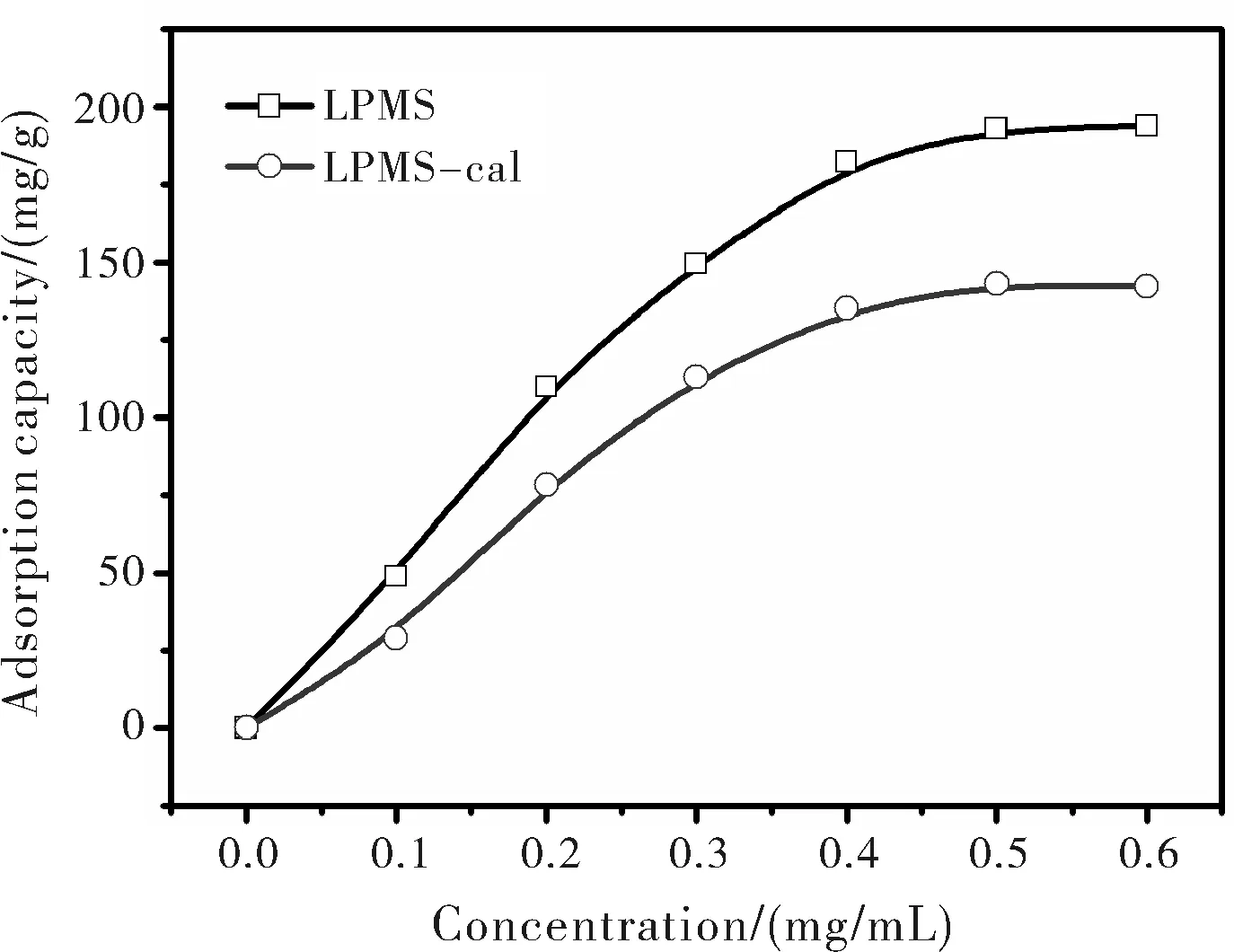
图6 LPMS和LPMS-cal在不同浓度BSA溶液中的蛋白吸附量
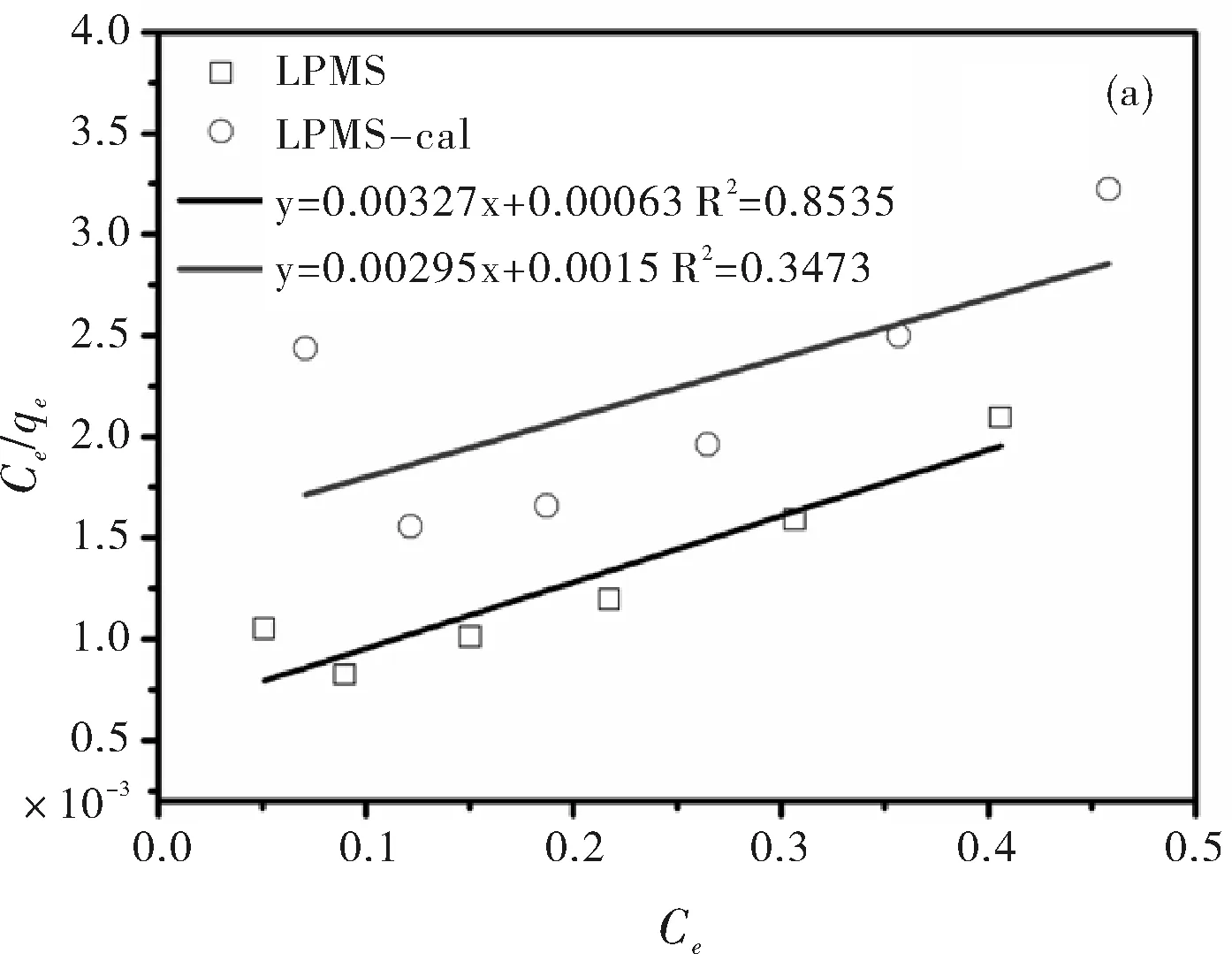

图7 Langmuir(a)和Freundlich(b)吸附等温线方程对实验数据的拟合图

表3 LPMS和LPMS-cal吸附BSA的Langmuir和Freundlich的等温模型拟合参数
3 结 论
(1)创新地利用一步法合成了大孔介孔二氧化硅(LPMS)。LPMS不仅具有大的介孔尺寸(22.8 nm)以及高的孔容(2.35 cm3/g),更重要的是有机模板在合成过程中已经被完全去除,不需要后处理去除模板,简化了合成工艺的同时保留了大量的Si-OH。
(2)对LPMS的合成机理进行了分析,发现相对较高的合成温度降低了有机模板胶束的亲水性,从而减弱了硅酸物种和有机模板胶束之间的作用力,使得有机模板在合成过程中被脱除,同时介孔孔径相应扩大。另一方面,相对较低的酸浓度使硅酸物种在高温下的水解速度和有机/无机共组装过程相匹配,从而更好地形成介孔结构。
(3)选择牛血清蛋白(BSA)作为模型蛋白研究LPMS和LPMS-cal对蛋白的吸附能力。在大介孔尺寸、高孔容以及表面大量Si-OH的共同作用下,LPMS的蛋白吸附能力达到了193.2 mg/g。

