低氧诱导因子-1α 通过提高miR-210-3p 表达水平促进口腔鳞状细胞癌细胞的增殖和迁移
王 慧, 尚政军
(湖北省口腔基础医学重点实验室·省部共建国家重点实验室培育基地,武汉大学口腔生物医学教育部重点实验室,湖北 武汉 430072)
口腔鳞状细胞癌(OSCC)是口腔颌面部最常见的一类恶性肿瘤[1]。 2018 年, 口腔癌新增病例约35.4 万例,其中90%的口腔癌是OSCC[2]。 由于预后不良,OSCC 致死率较高[3]。 因此,需要在现有治疗水平的基础上进一步寻找新的治疗方法。
低氧诱导因子-1α(HIF-1α)最早由Semenza 等[4]发现,是一种对氧敏感的转录激活因子。 大多数实体瘤组织内都存在缺氧现象,细胞和组织对缺氧的适应导致一系列基因的转录诱导。 介导这种适应性反应的主要因子是HIF-1α[4]。 当局部组织缺氧状态持续存在时, 细胞内HIF-1α 的表达量就会增加,从而导致下游一系列靶基因表达发生生物效应变化[5]。
微小RNA(microRNA,miRNA)是一类单链小分子非编码RNA, 约含22 nt。 它们通过与靶点信使RNA(mRNA)的3′-UTR 进行碱基互补配对,在转录后调控靶基因表达方面发挥重要作用[6]。 自miRNA被发现以来, 大量文献报道了多种miRNA 在不同肿瘤中异常表达, 揭示了其与肿瘤之间关系密切[7]。肿瘤的发生及发展过程十分复杂,其中涉及大量基因的表达变化和分子表达水平的改变。 在OSCC 进展过程中,仅仅在迁移、增殖方面就有多种miRNA在其中担任不同角色。 更有肿瘤细胞干性、肿瘤细胞促血管生成等方面的研究提示, 大量miRNA 参与了肿瘤的发生、发展。这些研究提示,miRNA 在未来可以作为治疗靶点研发新药物。MiR-210-3p 与多种疾病发生、发展有着密切的关系,可作为一些疾病的生物标志物, 也参与了肿瘤的迁移、 增殖、分化、凋亡等过程[8-9]。 因与HIF-1α 之间的相互作用,使miR-210-3p 成为机体重要的缺氧调控因子[10]。 目前,两者之间的协调作用以及miR-210-3p 在OSCC中的生物效应尚未有相关研究。
1 材料和方法
1.1 主要试剂
胎牛血清(Gibco 公司,美国),DMEM 高糖培养基(HyClone 公司,美国),miR-210-3p 模拟物和miR-210-3p抑制物(上海吉玛制药技术有限公司,中国),RIPA裂解液(Beyotime 公司,中国),HIF-1α、β-actin 抗体(武汉三鹰生物技术有限公司, 中国),Highgene 转染试剂(Abclonal 公司,中国),CCK-8 试剂盒(同仁公司,日本)。
1.2 细胞培养
人OSCC 细胞系(CAL-27)购自中国典型培养物保藏中心。 将CAL-27 细胞置于含10%胎牛血清(fetal bovine serum, FBS)和1%双抗的DMEM 高糖培养基中,于37 ℃、5%CO2的恒温培养箱中培养。低氧培养条件为37 ℃、94%N2、5%CO2、1%O2。
1.3 逆转录聚合酶链反应
将细胞置于6 孔板中培养后丢弃培养基,磷酸缓冲盐溶液(phosphate buffer saline, PBS)洗2 遍后于每孔中各加入1 mL TRIzol 试剂, 反复吹打后转移至无酶EP 管。 每管加入200 μL 三氯甲烷溶液,充分振荡后离心,取上清液加入500 μL 异丙醇,混匀后离心。 将离心后得到的RNA 进行沉淀,DEPC(diethyl pyrocarbonate)水配制的75%的乙醇洗涤2 次后用适量65 ℃的DEPC 水溶解。测量RNA 浓度后,使用生工miRNA 逆转录试剂盒(加尾法)逆转录为cDNA,设计miR-210-3p 特异性上游引物,并以U6为内参进行逆转录聚合酶链反应(reverse transcription PCR, RT-PCR) 检测。 所用引物序列为:MiR-210-3p 上 游 引 物,5′-CTGTGCGTGTGACAGC-GG-3′;U6 上游引物,5′-ATGGACTATCATATGCTTACCGTA-3′。 下游引物由生工生物miRNA 逆转录试剂盒(加尾法)提供。
1.4 Western 印迹法
在处理后的细胞中加入100~150 μL 含蛋白酶抑制剂、磷酸酶抑制剂的蛋白裂解液,冰浴裂解,离心后取上清液,采用二喹啉甲酸(BCA)试剂盒测定蛋白浓度。 加入20%体积的蛋白上样缓冲液。 使用12.5%十二烷基硫酸钠(sodium dodecyl sulfate, SDS)-聚丙烯酰胺凝胶(polyacrylamide gel electrophoresis,PAGE) 进行电泳并转移至聚偏二氟乙烯膜(PVDF膜)上,使用5%脱脂牛奶封闭2 h,一抗于4 ℃下孵育过夜。 TBST 缓冲液洗膜,二抗孵育1 h,再次洗膜后孵育于发光液中,并通过发光仪器进行检测。
1.5 细胞转染
细胞接种并贴壁后, 根据说明书提示使用Highgene 转染试剂将miR-210-3p 模拟物和miR-210-3p 抑制物及其相应的阴性对照(NC)转染至细胞中, 得到miR-210-3p 模拟物组、miR-210-3p 模拟物-NC 组、miR-210-3p 抑制物组及miR-210-3p 抑制物-NC 组。 继续培养24 h,RT-PCR 检测其转染效率。
1.6 CCK-8 法检测细胞增殖
将分组处理过的细胞以5 000 个/孔的密度接种于96 孔板中, 分别培养24、36、48 h 后, 按照CCK-8 试剂盒说明书提示,加入CCK-8 试剂培养2 h,使用酶标仪检测450 nm 波长处的吸光度值。
1.7 划痕实验
接种细胞至6 孔板中, 待细胞生长至80%~90%后用1 mL 无菌移液枪头垂直孔板底划3 条直线,相邻直线间距0.5 cm,确保每条直线宽度一致。PBS 洗去漂浮细胞后加入无血清培养基继续培养。分别于培养0、3、6、12 h 时显微镜下观测并拍照记录。 使用Image J 软件测量细胞迁移距离。
1.8 统计学分析
实验中所有数据均采用SPSS 21.0 分析, 样本间比较采用独立样本t检验,P<0.05 时表示差异有统计学意义。
2 结果
2.1 低氧诱导CAL-27 细胞内HIF-1ɑ 及miR-210-3p 表达水平升高
将CAL-27 细胞置于低氧培养箱分别培养12、24、48 h 后, 提取处理过的细胞及正常条件培养的CAL-27 细胞总蛋白和总RNA,用Western 印迹法检测细胞内HIF-1ɑ 的表达量。 结果显示,低氧条件下(1% O2)培养48 h 后,细胞内HIF-1ɑ 表达量明显升高(图1A)。
RT-PCR 检测上述细胞内miR-210-3p 的表达量,发现低氧条件培养24 h 和48 h 后,细胞内miR-210-3p 表达量均显著升高,并呈逐渐增加的趋势(图1B)。
2.2 HIF-1ɑ 促使CAL-27 细胞内miR-210-3p 表达水平上升
在CAL-27 培养基中加入人工合成的HIF-1ɑ,常氧条件下(20%O2)培养24 h 后,提取细胞总RNA,RT-PCR 检测细胞中miR-210-3p 的表达量。 结果显示,HIF-1ɑ 刺激细胞后,细胞内miR-210-3p 表达量升高(图2)。
2.3 CAL-27 细胞内miR-210-3p 水平的变化导致细胞迁移能力的改变
将miR-210-3p 模拟物和miR-210-3p 抑制物及其相应的NC 组转染至细胞中,转染24 h 后提取细胞总RNA,检测转染效率。 RT-PCR 结果显示,相比各自的NC 组,miR-210-3p 模拟物组转染24 h 后,CAL-27 细胞内miR-210-3p 表达量显著上升(图3A);转染miR-210-3p 抑制物的细胞内miR-210-3p 表达量下降(图3A)。
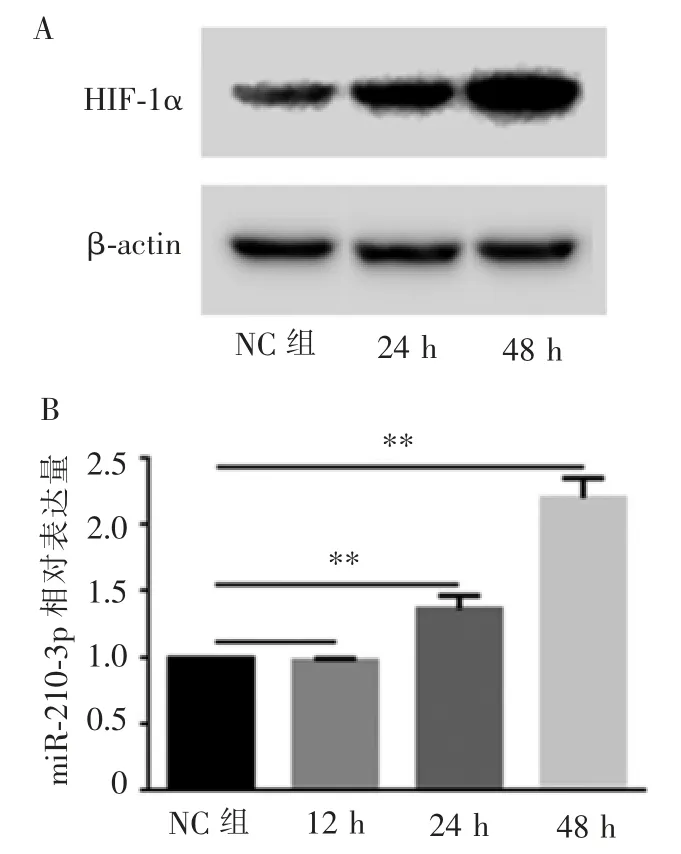
图1 低氧诱导后CAL-27 细胞内HIF-1ɑ 与miR-210-3p 的水平变化Figure 1 Changes of HIF-1ɑ and miR-210-3p levels in CAL-27 cells after hypoxia induction
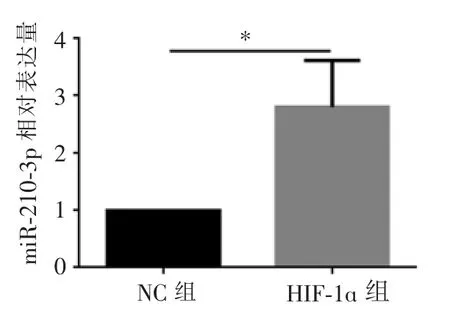
图2 经HIF-1ɑ 刺激后的CAL-27 细胞内miR-210-3p 的表达水平Figure 2 Expression level of miR-210-3p in CAL-27 cells after HIF-1ɑ stimulation
转染后的细胞用划痕实验检测其迁移能力是否发生了改变。 结果显示,相同时间内相比各自的NC 组, 转染miR-210-3p 模拟物的CAL-27 细胞迁移能力提升(图3B、图4A~4F);而转染miR-210-3p抑制物的细胞迁移能力下降(图3B、图4G~4L)。
2.4 CAL-27 细胞内miR-210-3p 水平的变化导致细胞增殖能力的改变
用CCK-8 实验检测上述转染后细胞增殖能力的改变。 结果显示,转染24、48、72 h 后,相比对照组,miR-210-3p 模拟物可以促进CAL-27 细胞增殖(图5A);miR-210-3p 抑制物降低细胞内miR-210-3p 表达量后,CAL-27 细胞的增殖能力则受到显著抑制(图5B)。
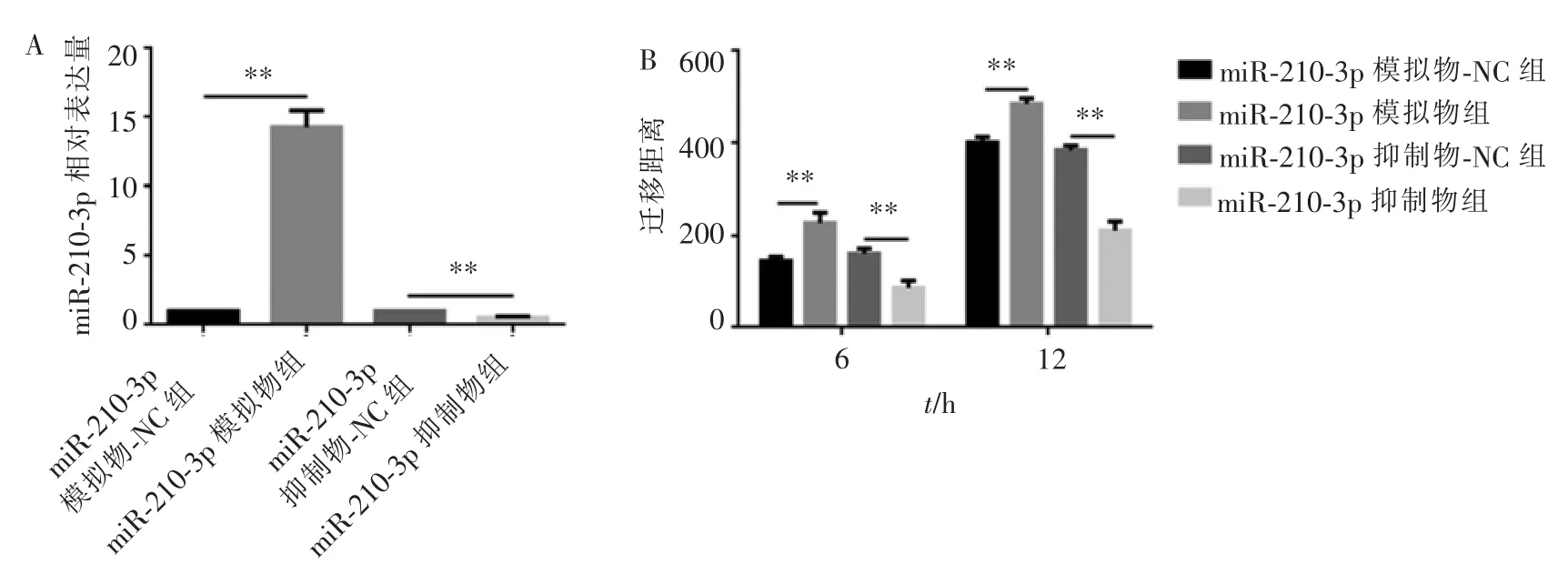
图3 不同处理组CAL-27 细胞内miR-210-3p 的水平及细胞迁移能力的改变Figure 3 Changes in miR-210-3p level and cell migration ability in CAL-27 cells of different treatment groups

图4 细胞迁移实验(×100)Figure 4 Cell migration experiment(×100)
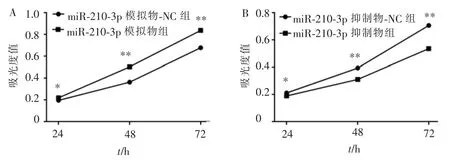
图5 CAL-27 细胞内miR-210-3p 水平的变化后细胞增殖能力的改变Figure 5 Changes in cell proliferation ability after changes in miR-210-3p levels in CAL-27 cells
3 讨论
虽然近年来关于肿瘤各个方面的研究越来越多,但大多数癌症发生、发展的具体分子机制和致病机制至今尚不明确。OSCC 生长速度较快,其生长时需大量供氧。 因此,肿瘤组织的生长必然伴随着缺氧环境的形成。HIF-1ɑ 是肿瘤组织在低氧状态下调节自身适应环境的关键因子[6-7,11-12]。
MiR-210-3p 在多种肿瘤组织及患者血清中存在异常表达,提示miR-210-3p 可能在肿瘤发生或发展过程中起一定作用。因miR-210-3p 在肺腺癌组织中的高表达使其可能成为预测及诊断肺腺癌的标志物; 在非小细胞肺癌患者中,miR-210-3p 高表达者比低表达者的无瘤生存率低,预后更差[13];卵巢癌患者血清中miR-210-3p 表达增高,且其表达水平与患者淋巴结转移程度、 国际妇产科联盟(FIGO)分期、分化程度及组织类型相关[14]。 已有研究表明,miR-210-3p 与OSCC 也相关, 与正常口腔上皮组织相比,OSCC 组织中miR-210-3p 表达量更多[15-16]。 但有关miR-210-3p 在OSCC 发生、发展中扮演角色的研究,至今尚无报道。
有学者从对围绕HIF-1ɑ 的低氧相关通路的研究中发现,与HIF-1ɑ 关系最密切的miRNA 是miR-210-3p[10]。 据已有研究证明, HIF-1ɑ 与miR-210-3p之间存在正反馈通路, 两者相互作用抑制对方降解,从而实现浓度积累[17-18]。 而沉默HIF-1ɑ 后,低氧条件不能导致施万细胞内miR-210-3p 的积累[19]。
实验证实,低氧状态下,OSCC 细胞中表达了更多的HIF-1ɑ, 而增多了的HIF-1ɑ 导致细胞内miR-210-3p 表达量升高。我们发现上调miR-210-3p 可以促进CAL-27 细胞增殖和迁移, 而下调miR-210-3p则导致CAL-27 细胞增殖和迁移能力下降。可推断,OSCC 组织内持续存在的低氧状态必然导致HIF-1ɑ水平升高, 而HIF-1ɑ 带来了一系列应对缺氧环境的改变,其中一个就是通过上调miR-210-3p 的表达量来促进肿瘤生长及进展。MiR-210-3p 可以作为研究OSCC 治疗方法的新靶点。

