胃癌及胃高级别上皮内瘤变多灶现象的临床研究*
尹启航 许梦情 王莉杰 孙珂 马苗苗 岳汶 张丹丹 陶林 张文杰
2018年国内数据显示,中国胃癌发病特点为早期胃癌比例低、进展期胃癌比例高(80%以上)、5年生存率低(35.1%)[1]。因此中国胃癌防治工作形势仍然严峻,提高胃癌的早诊率是当务之急,目前内窥镜诊疗技术的进展使早期胃癌检测成为可能。Yalamarthi等[2]总结了内窥镜下胃癌漏诊的原因,其中胃镜检查时观察不够充分是漏诊的原因之一,因此胃镜检查时是否能够找到所有病灶尤为重要。多发性胃癌指胃内存在不止1个胃癌病灶的现象,对于同时或6个月内发现2个及以上癌性病灶,将其称为同时性多发性胃癌。目前同时性多发性胃癌的发病率较低,原因之一在于内镜检查时,较小或较为平坦的病灶不易发现,部分内镜医师通常停留于仅发现1 个病灶,从而使得其他病灶漏诊,造成治疗时机延误。目前,鲜有研究分析同时性多发性胃癌中病灶间的关联性。本研究对56例同时性多发性胃癌及癌前病变的临床病理特征进行分析,探究病灶间的关联性,以期帮助临床医师更加方便、高效、准确地找到所有病灶,从而降低漏诊率。
1 材料与方法
1.1 研究对象
收集2007年11月至2017年12月在石河子大学医学院第一附属医院经胃镜活检病理确诊为胃癌或胃高级别上皮内瘤变的病例1 490例中,行内镜下黏膜剥脱术或外科手术且术后病理确诊为胃癌或胃高级别上皮内瘤变的患者资料,以病历记录中胃镜所见、术中所见及术后病理报告为依据,从中筛选符合Moertel 标准[3]的患者,最终56例同时性多发性胃癌和(或)高级别上皮内瘤变患者纳入研究。同时随机选取同一时期收治的单发性胃癌患者100例和单发性高级别上皮内瘤变患者20例作为对照。
1.2 方法
1.2.1 研究定义 根据Moertel 标准[3]将同时性多发性胃癌定义为:1)各病灶均可从病理组织学上证明为恶性;2)所有病灶在显微镜下均有正常黏膜组织间隔;3)各个病灶并非转移或直接浸润所致。在此基础上,同时性多发性胃癌和(或)高级别上皮内瘤变定义为胃内同时或6个月内发现的2个或2以上的高级别上皮内瘤变和(或)胃癌病灶。主、副病灶的定义同样根据Moertel 标准[3]:1)若多发病灶具有相同的浸润深度,直径最大的被定义为主病灶,其他病灶为副病灶;2)若多发病灶浸润深度不同,浸润程度最深的被定义为主病灶,其他病灶为副病灶;如病灶数目超过2个,第二主病灶被定义为副病灶。
1.2.2 研究方法 由2名胃肠病理学医师对活检组织切片进行显微镜检查,组织学诊断出现不一致意见的病例交由第3名胃肠病理学专家复片。病理描述包括病灶性质与组织学类型、大小、浸润深度、是否合并溃疡、有无脉管浸润、切缘或基底是否阳性及癌周黏膜状况。本研究对组织病理学分型按照2000年世界卫生组织(WHO)肿瘤新分类进行[4]。对病灶空间位置、肉眼形态等的记录均采用2011年第3版日本胃癌协会分类标准[5]:在垂直方位上将胃分为上1/3、中1/3和下1/3,在水平方向上分为前壁、小弯侧、后壁和大弯侧共4个象限。内镜形态分为隆起型、平坦型和凹陷型;以病灶最大直径量化病灶大小。本研究中所纳入分析的病例的病理类型中不包含印戒细胞癌和黏液腺癌。
1.3 统计学分析
采用SPSS 22.0软件进行统计学分析。计数资料采用频数或百分比(%)描述,计量资料采用描述;计数资料的比较采用χ2检验,计量资料的比较采用独立样本t检验;主、副病灶大小之间的相关性分析采用Pearson直线相关分析,主、副病灶属性之间的相关性分析采用列联相关分析法。以P<0.05为差异具有统计学意义。
2 结果
2.1 临床病理特点
1 490例患者中高级别上皮内瘤变为197例、胃癌1 293例,56例(3.76%)被诊断为同时性多发性胃癌和(或)高级别上皮内瘤变的患者纳入本研究。56例患者平均年龄为(63.82±11.88)岁,男性42例(75%)、女性14例(25%);55例有2个病灶(98.21%),1例有3个病灶(1.79%)。幽门螺旋杆菌(Hp)感染为10例(17.86%),周围黏膜合并萎缩患者为25例(44.64%),合并肠上皮化生有18例(32.14%)。
病理结果显示,在浸润深度上,T1期32例,T2期15例,T3期12例,T4期7例,主、副病灶的肿瘤浸润深度以T1期多见(图1)。56例患者中48例(85.71%)患者有淋巴结转移,其中N0期23例,N1期17例,N2期8例,N3 期0例。TNM 分期Ⅰ期23例,Ⅱ期16例,Ⅲ期9例,无Ⅳ期。
2.2 主、副病灶大小的相关性分析
主、副病灶的平均直径分别为(2.82±2.02)cm 和(2.27±1.80)cm,二者大小呈正相关(r=0.797,P<0.001),当主病灶增大时,副病灶的大小也随之增大(图2)。
2.3 主、副病灶在空间位置上的关联性分析
主、副病灶在空间位置上的关联性分析见表1和表2。在垂直位置上,主病灶(71.43%)和副病灶(73.21%)主要位于中位胃体。当主病灶位于低位胃体,66.67%的副病灶出现在中位胃体;当主病灶位于中位胃体时,87.50%的副病灶出现在中位胃体;当主病灶位于高位胃体,61.54%的副病灶出现在高位胃体。主、副病灶在垂直位置上具有关联性(列联相关系数c=0.484,P=0.002)。在水平位置上,主病灶(57.14%)和副病灶(62.5%)主要位于小弯侧。当主病灶位于前壁,副病灶较大可能位于小弯侧(42.86%);当主病灶位于大弯侧,副病灶较大可能位于小弯侧(42.86%);当主病灶位于小弯侧,副病灶较大可能位于小弯侧(81.25%);当主病灶位于后壁时,副病灶较大可能位于后壁(60%)。主、副病灶在水平位置上具有关联性(列联相关系数c=0.535,P=0.007)。
2.4 主、副病灶在内镜分型上的关联性分析
在内镜分型方面,主病灶主要为凹陷型(46.43%),副病灶同样主要为凹陷型(46.43%)。当主病灶为隆起型,副病灶以隆起型居多(75%);当主病灶为平坦型,副病灶以平坦型居多(90.91%);当主病灶为凹陷型,副病灶以凹陷型居多(84.62%)。主、副病灶在内镜分型上具有一致性(列联相关系数c=0.731,P<0.001),见表3。
2.5 主、副病灶在病理类型上的关联性分析
在病理类型方面,主病灶主要为低分化腺癌(51.79%),副病灶主要为高级别上皮内瘤变(66.07%)。当主病灶为中分化腺癌,副病灶以高级别上皮内瘤变居多(85.71%);当主病灶为低分化腺癌,副病灶为高级别上皮内瘤变与低分化腺癌的可能性相近,分别为41.38%和37.93%。主、副病灶在病理类型上具有关联性(列联相关系数c=0.535,P=0.007),见表4。
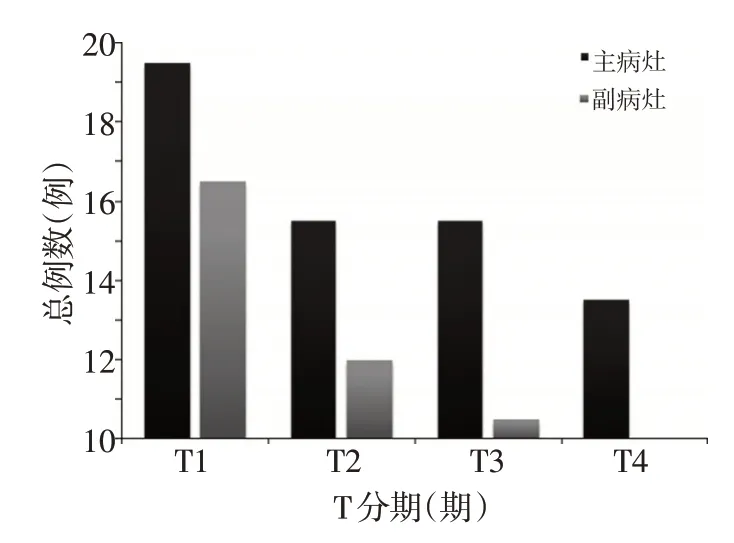
图1 主、副病灶肿瘤浸润深度分期分布特点
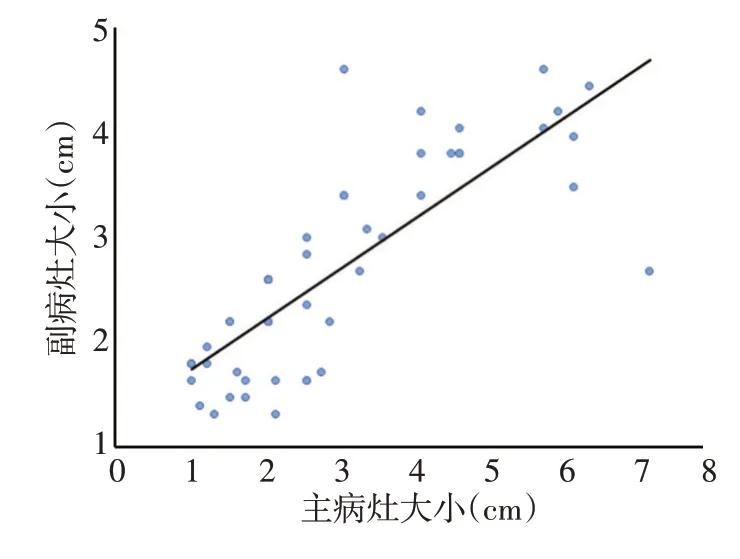
图2 主、副病灶大小相关性分析
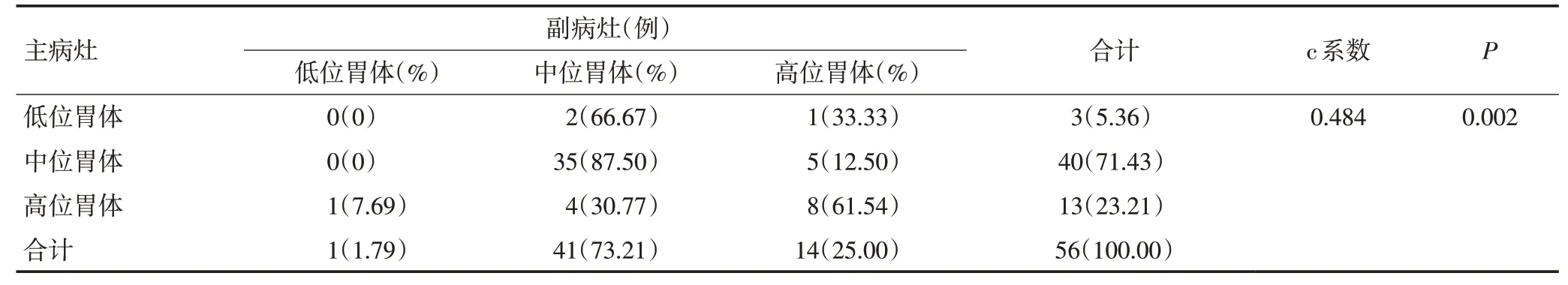
表1 主、副病灶垂直位置相关性分析
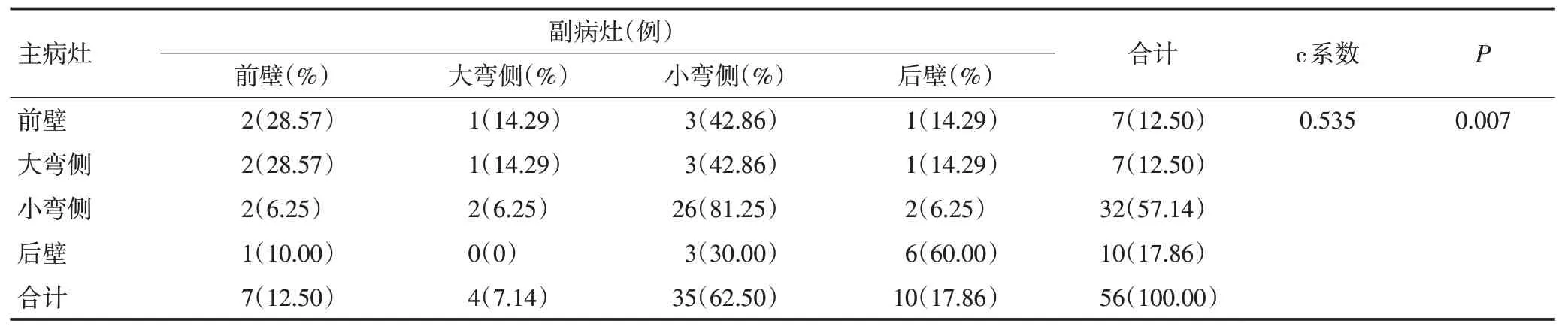
表2 主、副病灶水平位置相关性分析
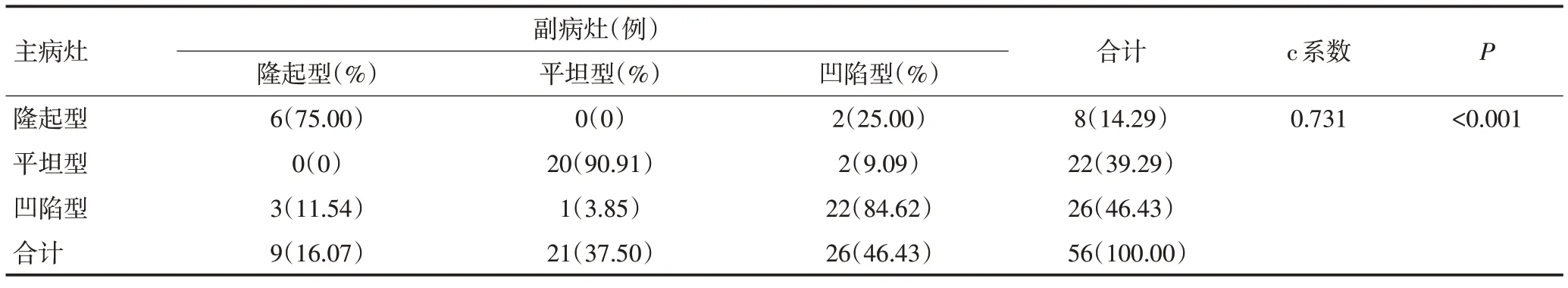
表3 主、副病灶内镜分型相关性分析
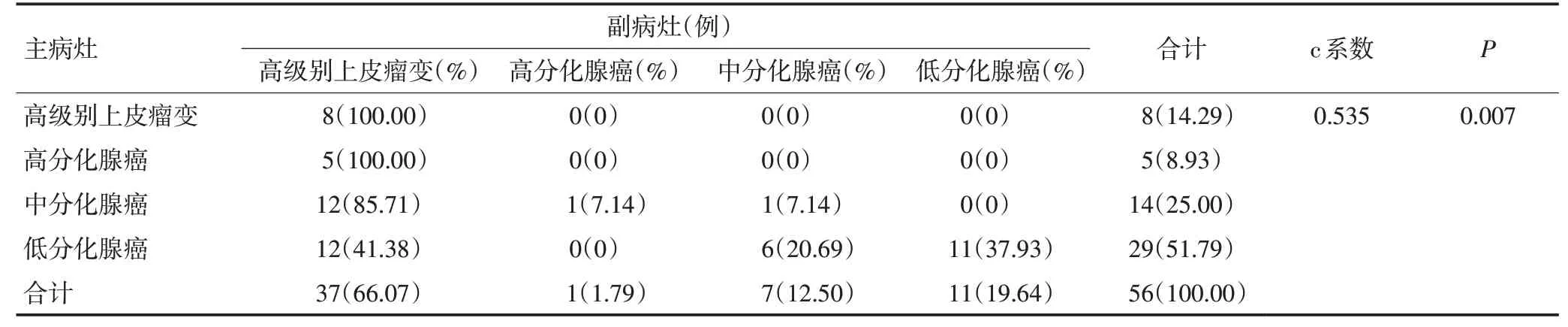
表4 主、副病灶病理类型相关性分析
2.6 主、副病灶匹配率分析
85.71%的病例中,主、副病灶具有相同的内镜分型。66.07%的病例表现出相同的内镜分型和垂直位置。46.43%的病例中,主、副病灶在内镜分型、垂直位置和水平位置三方面一致。随着匹配条件的增多,主副病灶在相应的匹配属性上完全一致的比例越来越低(图3)。

图3 不同匹配条件下主、副病灶之间匹配率比较
2.7 单发性与多发性胃高级别上皮内瘤变临床病理特征的比较
多发性胃高级别上皮内瘤变中主病灶与单发性胃高级别上皮内瘤变临床病理特征之间具有差异(表5)。多发组患者平均年龄为(65.50±10.76)岁,单发组患者平均年龄为(66.75±10.79)岁,两组间差异无统计学意义(P=0.850)。多发组主病灶多伴有周围黏膜萎缩(P=0.030),但在合并肠上皮化生方面与单发组相比无特异性(P=0.209)。多发组主病灶与单发组在胃腔分布上相比无显著性差异(垂直位置P=0.429,水平位置P=0.336)。多发组主病灶内镜分型中平坦型比例明显高于单发组,凹陷型和隆起型比例则明显低于单发组(P=0.020)。
2.8 单发性与多发性胃癌临床病理特征的比较
多发性胃癌主病灶与单发性胃癌临床病理特征之间具有差异(表6)。多发组患者平均年龄为(63.54±12.13)岁,单发组患者平均年龄为(62.92±11.37)岁,两组间差异无统计学意义(P=0.655)。多发组主病灶N0 和N1 期比例明显高于单发组,N2 和N3 期比例则明显低于单发组(P<0.001)。多发组主病灶Ⅰ期比例明显高于单发组,Ⅲ期比例则明显低于单发组(P<0.001)。多发组主病灶多伴有周围黏膜萎缩(P<0.001),但在合并肠上皮化生方面与单发组相比无显著性差异(P=0.321)。多发组主病灶与单发组在胃腔分布以及内镜分型上相比无显著性差异(垂直位置P=0.329,水平位置P=0.059,内镜分型P=0.208)。
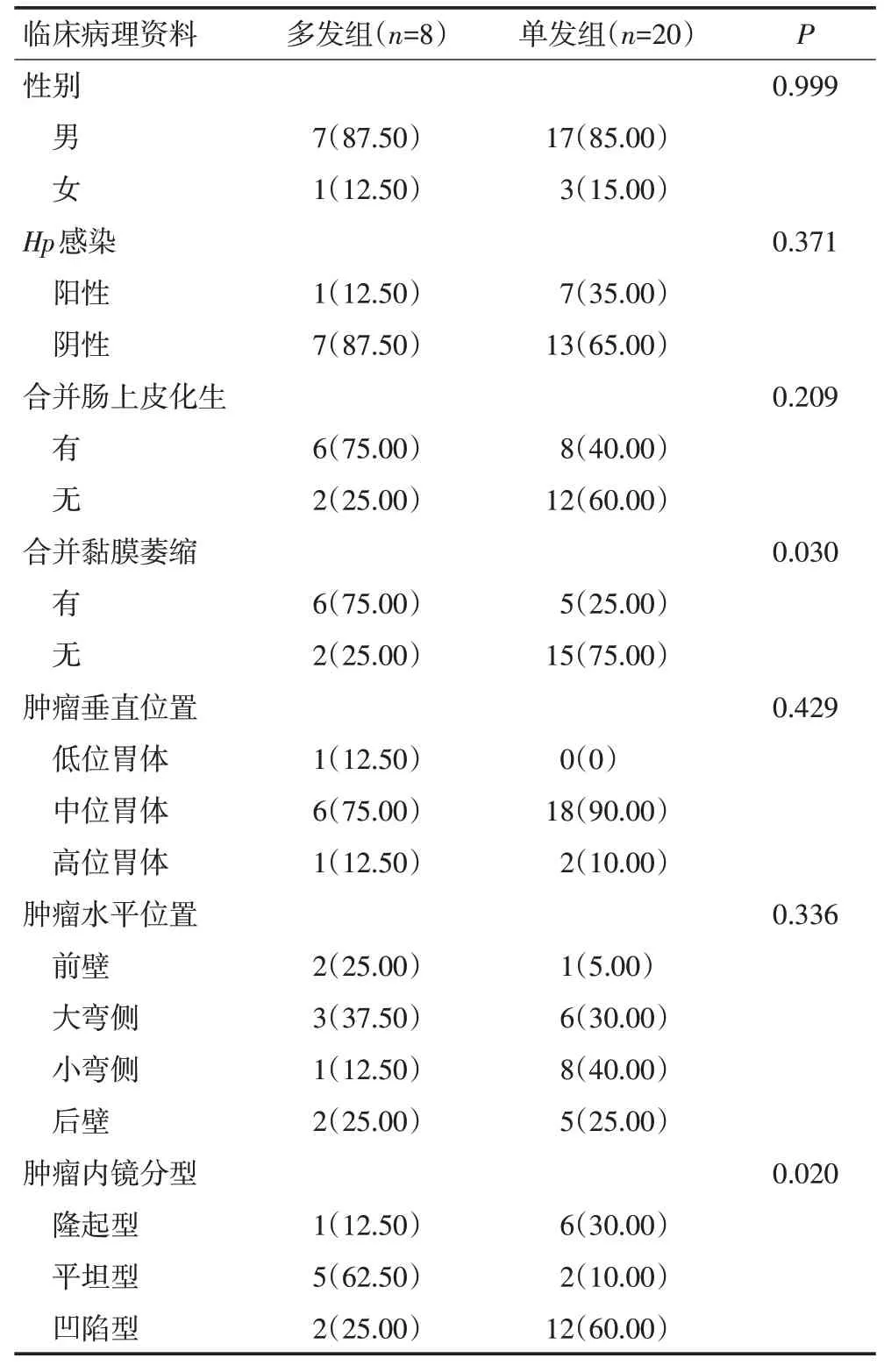
表5 多发性与单发性胃高级别上皮内瘤变临床病理特征的比较例(%)
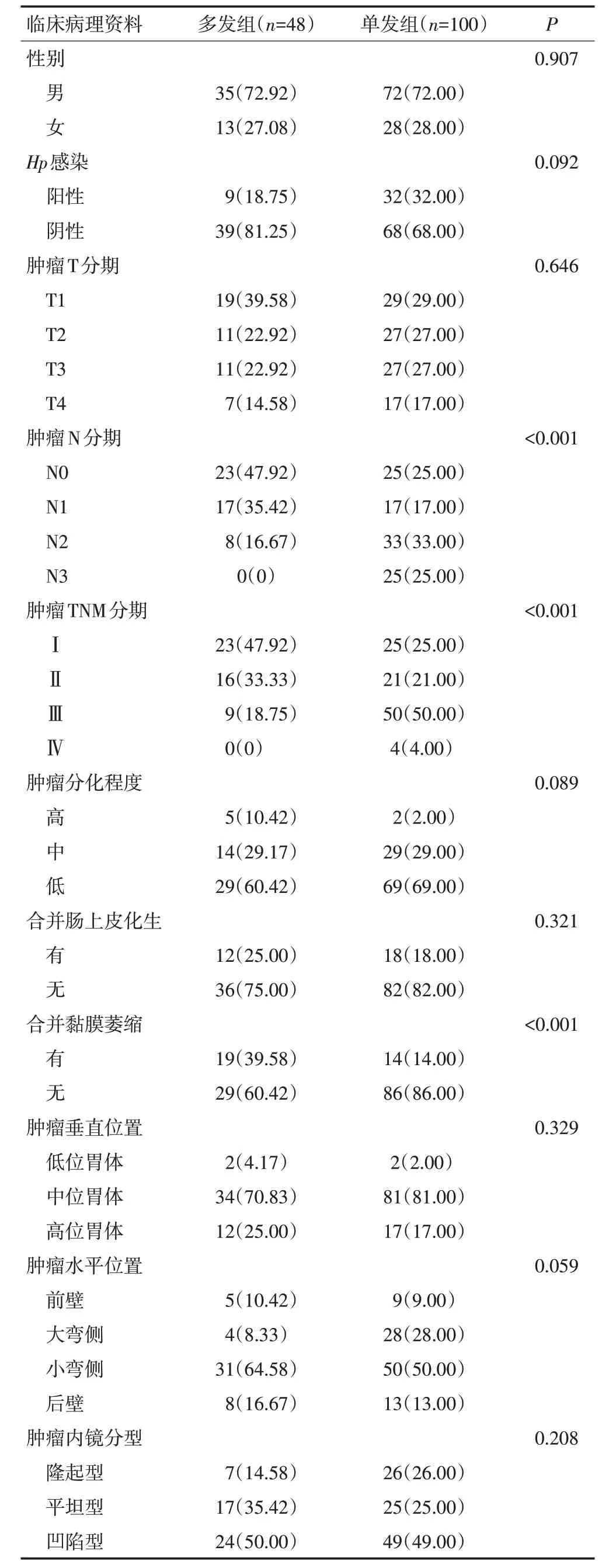
表6 多发性与单发性胃癌临床病理特征的比较例(%)
3 讨论
同时性多发性胃癌是一个不容忽视的疾病,若在早期治疗时期未能发现其存在,便会延误治疗时机,对预后产生不良影响。在2014年第4版日本胃癌治疗指南定义中,胃高级别上皮内瘤变属于早期胃癌,可并存侵袭性腺癌,且有25%的胃高级别上皮内瘤变患者会在1年内进展为腺癌[6]。本研究回顾分析同时性多发性胃癌和(或)高级别上皮内瘤变56例患者的多发病灶特征,将关注范围扩大到胃高级别上皮内瘤变,以期了解早期胃癌过程中的病灶特征。
本研究中同时性多发性胃癌和(或)高级别上皮内瘤变的发病率(3.76%)低于既往研究(5%~15%)[7]。这可能与以下原因有关:首先,本研究纳入的均是同时发现多个病灶进行内镜下黏膜剥脱术或外科手术的病例,这与异时发现多个病灶的病例[8-9]不同;其次,种族和地区的差异也可能导致发病率的差异,有韩国报道的发病率为3%~8%[10],与本研究的发病率相吻合。
既往有研究发现同时性多发性胃癌好发于老年男性,尤其是伴有严重肠上皮化生的人群[11-12]。Otsuji等[13]对76例多发性胃癌的分析研究中显示,发病人群平均年龄在60 岁以上。Toshikatsu 等[14]报道的94例多发性胃癌的分析结果显示年龄≥65岁、合并肠上皮化生和黏膜萎缩为多发性胃癌的独立危险因素,与本研究合并周围黏膜萎缩的老年男性为该疾病高危人群结论相似。另外,本研究纳入病例中有10例(17.86%)发生Hp感染,这与国内相关报道(53.13%)不同[15]。结合本课题组前期研究发现,Hp感染随着胃部疾病进展而出现降低的趋势,认为Hp感染可能是诱导癌变的早期事件[16]。
本研究结果表明,主病灶平均直径大于副病灶,随着主病灶增大,副病灶也会增大(r=0.797,P<0.001)。主、副病灶关联性分析显示,二者在空间分布方面具有关联性,无论在垂直位置或水平位置上,主、副病灶的发病位置都具有较大相似性,与既往的研究结果一致[9]。对此现象,有学者支持“肿瘤碰撞”理论,即进展期胃癌由2个或更多的同时性早期胃癌融合而成[17]。
关于主、副病灶在内镜下的形态,本研究结果与Kim 等[18]的研究结果一致,但有国内研究认为主、副病灶在内镜分型方面无关联性[15]。值得关注的是,无论主病灶如何,副病灶内镜下多表现为平坦或浅表凹陷型病灶,导致该病极易漏诊[19]。有研究表明,即使是经验丰富的内镜医师,对于该疾病的漏诊率也高达14.7%[20-21]。在组织病理类型方面,48例患者主病灶为分化型腺癌,占同时性多发性胃癌和(或)高级别上皮内瘤变的85.71%,分化型腺癌中以低分化腺癌居多。主、副病灶在病理类型上具有关联性(列联相关系数c=0.535,P=0.007)。有研究以“区域癌变”假说解释该现象,即胃内所有黏膜处在相同的致癌背景,局部会同时或接连形成肿瘤[22]。
在与单发性胃高级别上皮内瘤变的比较中,多发性胃高级别上皮内瘤变中主病灶在合并黏膜萎缩、内镜分型等方面存在差异。在与单发性胃癌的比较中,多发性胃癌中主病灶在合并黏膜萎缩、TNM分期、淋巴结转移等方面存在差异。合并黏膜萎缩方面的差异可能与遗传因素和内分泌因素有关[23],也可能是副病灶的存在对主病灶的发生发展产生了一定影响。TNM分期以及淋巴结转移方面的差异可能是由于胃癌属于多中心起源,在早期阶段肿瘤呈多中心发生,大多数癌灶间距离也较近;随着肿瘤不断生长,至肿瘤进展期癌灶逐渐靠近并融合为单个癌灶,因此多发性胃癌病理分期大多较早[24]。
本研究探讨了主、副病灶的关联性和客观规律。同时性多发性胃癌和(或)高级别上皮内瘤变的特定好发人群是伴有黏膜萎缩的老年男性。主、副病灶在病灶直径、病理类型以及内镜分型方面具有关联性,并且在空间位置上的分布也有一定规律,但仍需进一步收集患者预后资料并在生存预后层面分析二者在疾病进展过程中可能发挥的相互作用,以深入了解二者的关联性。为进一步了解多发病灶特点提供理论基础,以期帮助内镜医师发现更多的肿瘤病变,从而有效减少漏诊,进而有效减少术后复发及不良预后。

