子宫内膜癌中长链非编码RNA 表达谱的生物信息学分析
建方方,车晓霞,冯炜炜
1. 上海交通大学医学院附属瑞金医院妇产科,上海 200025;2. 复旦大学附属妇产科医院妇科,上海 200011
子宫内膜癌(endometrial cancer,EC)是女性生殖系统中常见的三大恶性肿瘤之一,其在女性生殖道恶性肿瘤中占比20%~30%,在女性恶性肿瘤中占比约7%。据2016 年流行病学统计显示,在全球范围内该疾病每年约有320 000 例新发病例、76 000 例死亡病例,严重威胁着女性的生命健康[1]。目前,临床上针对EC 的治疗手段主要有手术、化学治疗及放射治疗等,但上述方法对晚期及复发患者而言,治疗效果并不理想。因此,全面了解EC 发病的分子机制对其临床治疗的开展具有举足轻重的作用。
长 链 非 编 码RNA(long noncoding RNA,lncRNA)是一类转录物长度超过200 个核苷酸的RNA,其本身不编码蛋白质,而是以RNA 的形式在多种层面上调控基因的表达,参与多种生物学功能的发挥[2]。越来越多的证据表明,lncRNAs 可在人类肿瘤组织中异常表达,并在肿瘤的发生及发展过程中起促癌或抑癌作用[3]。研究[4]表明,HOTAIR 在EC 中高表达,且和肿瘤分期、子宫肌层浸润以及淋巴转移有关。Guo 等[5]发现MEG3 在EC 中表达下调,并能够通过调控Notch 信号通路抑制内膜癌细胞增殖。然而目前已发现的与EC 有关的lncRNAs 相对较少,且其如何在内膜癌组织中发挥作用尚待深入研究。基于此,本研究采用转录组测序技术对21 例EC 组织和5 例正常内膜组织进行分析,获得lncRNAs 和mRNA 的差异表达谱。随后,仅就lncRNAs 部分进行探讨,即通过生物信息分析初步探索lncRNAs 可能涉及的生物学过程及信号通路,以期在转录组水平了解EC 中lncRNAs 的表达变化情况,为进一步探索EC 的发病机制及治疗靶点提供科学证据。
1 材料与方法
1.1 组织标本
EC 组织标本源于2013 年5 月—2018 年12 月于上海交通大学医学院附属瑞金医院诊治的且经术后病理诊断为EC 的患者,共计21 例;其中,高级别腺癌6 例、浆液性癌6 例、内膜样腺癌8 例和透明细胞癌1 例。正常内膜组织源于同期因异常子宫出血于我院就诊的,经诊刮及术后病理诊断为处于子宫内膜增生期或分泌期的患者,共计 5 例。本研究已获得上海交通大学医学院附属瑞金医院伦理委员会审批。所有被采集的患者均签署了知情同 意书。
1.2 主要试剂
TRIzol 总RNA 抽提试剂、SuperscriptTMⅢ 反转录酶试剂盒及实时荧光定量 PCR 试剂盒均购自宝生物工程(大连)有限公司,异丙醇、氯仿、无水乙醇、甲醇均购自上海振兴化工一厂。
1.3 研究方法
1.3.1 组织标本的RNA 抽提及纯化 依据试剂说明书的标准操作流程进行。采用TRIzol 总RNA 抽提试剂提取EC 组织标本及正常内膜组织标本的总RNA,经Agilent Bioanalyzer 2100(美国安捷伦公司)电泳质检合格后使用RNeasy Micro Kit 和 RNase-Free DNase Set 纯化总RNA。而后,经NanoDrop 2000 分光光度计及Agilent Bioanalyzer 2100 对其浓度进行测定,合格的RNA 可用于后续测序实验。
1.3.2 转录组测序及数据分析 本研究数据来源于HiSeq×Ten(美国Illumina 公司),采用150 bp 双端测序。通过 FASTQC(v0.11.5)软件对原始数据进行质量评估,使用Cutadapt(v1.10)软件去除接头序列,再使用Hisat2(v2.0.5)软件将读序比对至基因组(基因组版本为hg19),使用Stringtie(v1.3.3b)软件进行组装。使用R 语言中DESeq2 对EC 组织标本及正常内膜组织标本的lncRNAs的差异表达进行分析。基因表达的差异用P 值和差异倍数(fold change,FC)的对数(logFC)表示。设置参数P<0.05 且|log2FC|>1 为阈值,筛选差异表达的lncRNAs。对上述获得的lncRNAs 进行GO(Gene Ontology)功能分析和KEGG(Kyoto Encyclopedia of Genes and Genome)通路分析。
1.3.3 反转录及实时荧光定量PCR 验证分析 为了验证测序结果,本研究将样本量进行扩大,即纳入47 例EC组织标本及19 例正常内膜组织标本,抽提RNA 的步骤见1.3.1。根据反转录试剂盒说明,将相关试剂与0.5 μg 总RNA 混合均匀(总体积为20 μL,加入RNA 体积根据浓度计算)进行反应,条件如下:42 ℃ 1 h,95 ℃ 5 min。而后使用SYBR Premix Ex Taq 试剂盒,将1 μL cDNA 与相关试剂混合配置10 μL 反应体系进行实时荧光定量PCR(quantitative real-time PCR,qPCR)反应,条件如下:90 ℃ 30 s;95 ℃ 5 s,60 ℃ 20 s,共20 个循环。以甘油醛-3-磷 酸 脱 氢 酶(glyceraldehyde-3-phosphate dehydrogenase,Gapdh) 为内参,基因的相对量用2-△△CT进行分析。所有数据均进行3 次分析(即设置3 个复孔)。lncRNAs 引物均由上海冠泰生物科技有限公司合成,引物序列见表1。
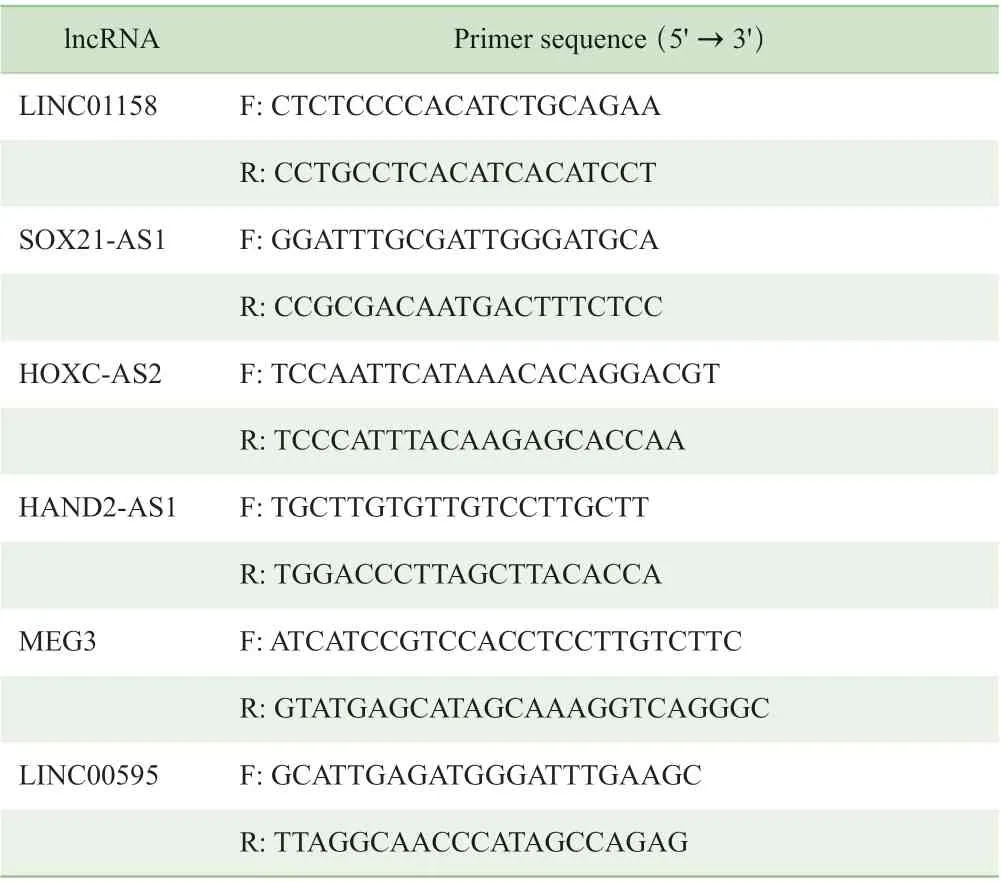
表1 qPCR 引物序列Tab 1 Primer sequences for qPCR
1.4 统计学方法
采用 GraphPad Prism 6.0 软件对研究数据进行统计分析。qPCR 数据以±s 表示,采用t 检验进行比较。P<0.05 表示差异具有统计学意义。
2 结果
2.1 差异表达lncRNAs 的筛选
本研究采用R 语言中DESeq2 对EC 组织标本及正常内膜组织标本中的差异表达lncRNAs 进行筛选,并采用聚类热图进行分析。结果显示,共筛选出3 060 个差异表达lncRNAs,其中上调表达2 046 个、下调表达1 014 个 (图1、表2、表3);在2 个组织中差异表达10 倍以上的lncRNAs 共859 个,其中上调表达的lncRNAs 占 比75%。

图1 差异表达lncRNAs 的聚类热图Fig 1 Heat map of differentially expressed lncRNAs
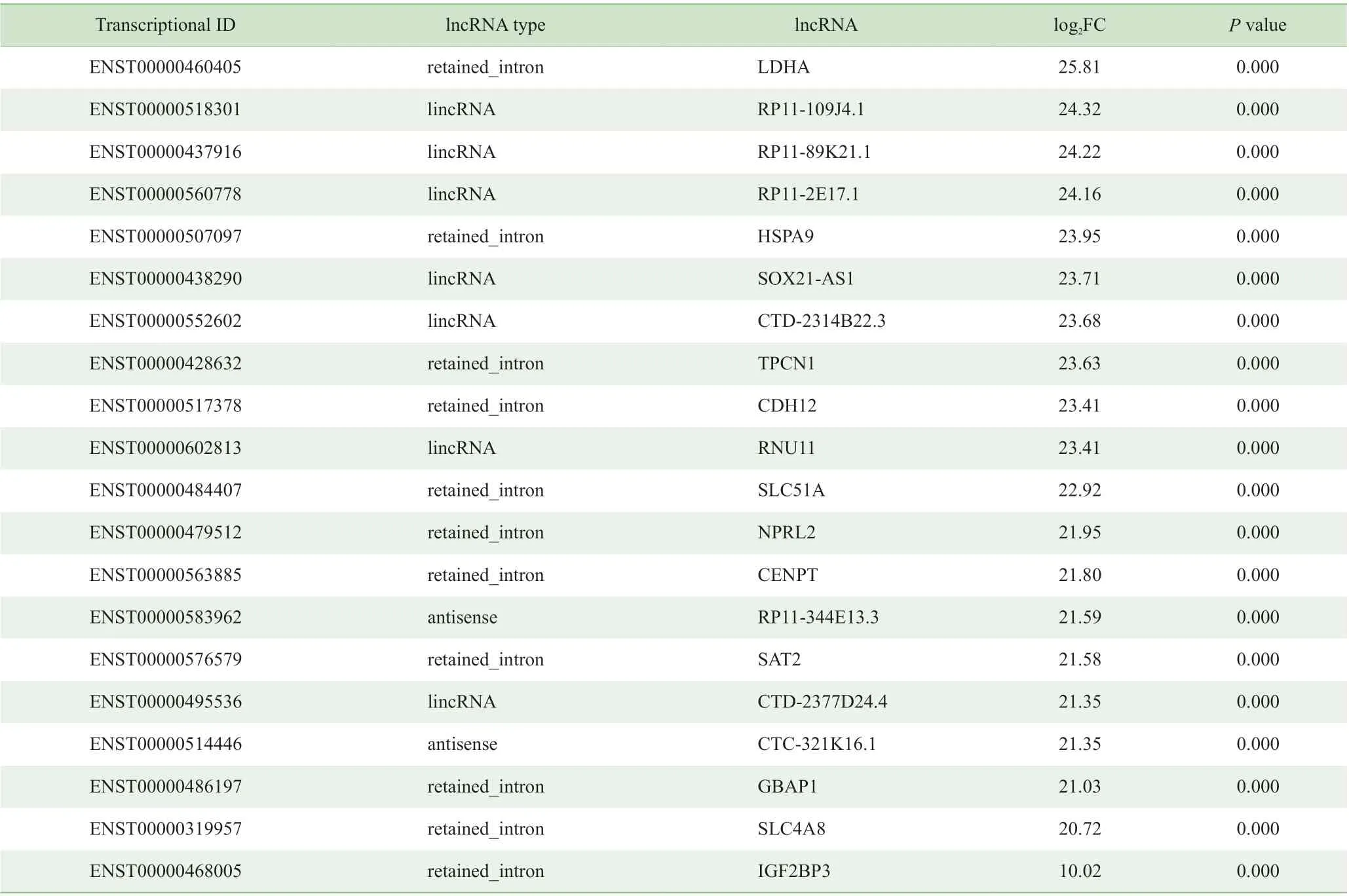
表2 表达上调最显著的前20 个lncRNAsTab 2 Top 20 of the most significant up-regulated lncRNAs

表3 表达下调最显著的前20 个lncRNAsTab 3 Top 20 of the most significant down-regulated lncRNAs
2.2 qPCR 验证
为了验证上述测序结果,本研究随机筛选了6 个lncRNAs, 包 括3 个 上 调 表 达lncRNAs(LINC01158、SOX21-AS1、HOXC-AS2) 和3 个 下 调 表 达lncRNAs(HAND2-AS1、MEG3、LINC00595),于47 例EC 组 织标本和19 例正常内膜组织标本中进行qPCR 验证。结果(图2)显示,这些lncRNAs 的表达情况和本研究的测序结果相一致,从而证实上述测序结果较为可靠。
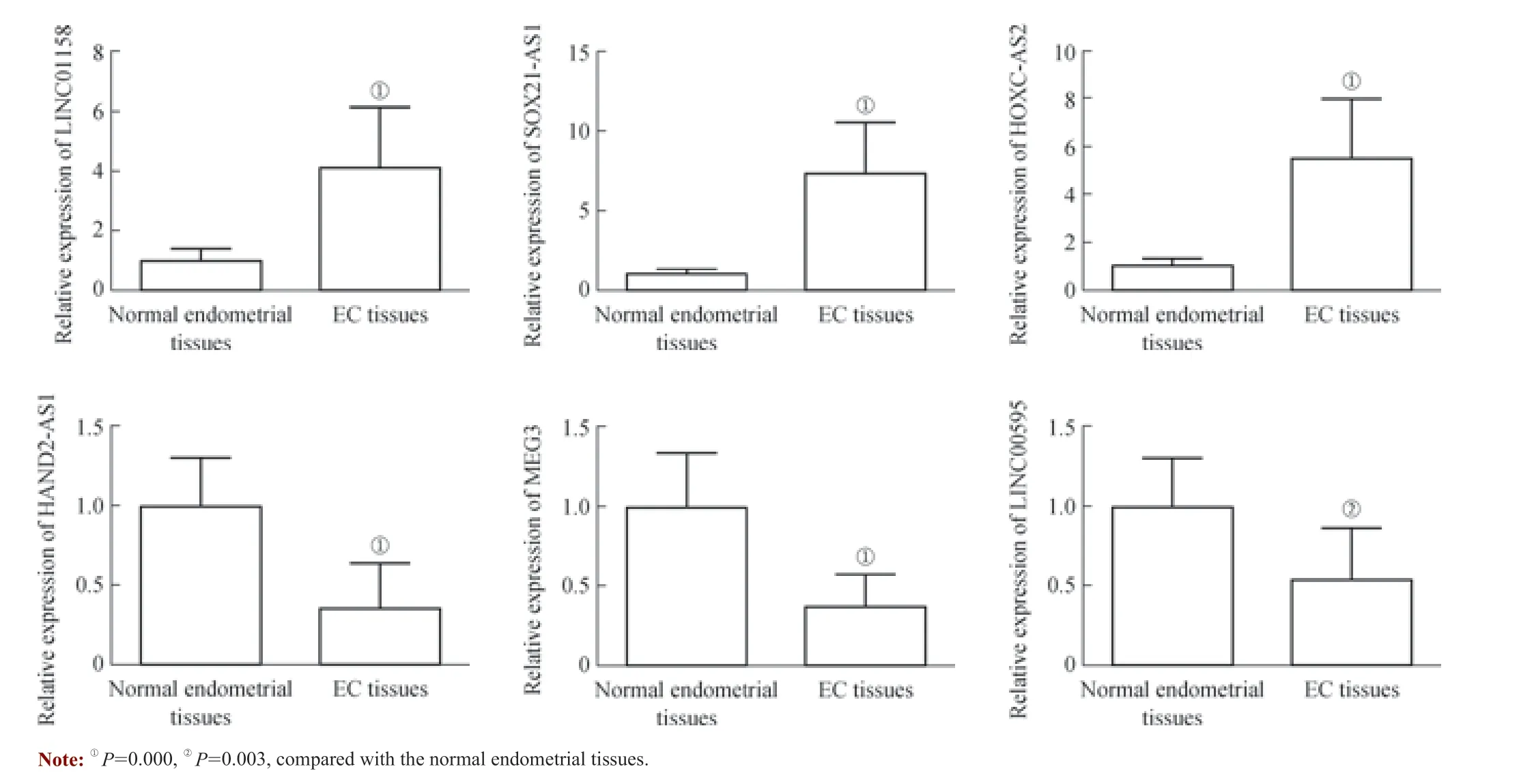
图2 qPCR 检测EC 组织标本和正常内膜组织标本中6 个lncRNAs 的表达差异Fig 2 Expression differences of 6 lncRNAs in EC tissues and normal endometrial tissues by qPCR
2.3 差异表达lncRNAs 在2 组测序数据中的交集分析
为进一步挖掘参与EC 的发生与发展的重要lncRNAs,本研究结合癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中EC 转录组测序数据,就差异表达lncRNAs 在本研究转录组测序与TCGA 数据库中的表达差异进行比较分析,结果显示共有33 个lncRNAs在上述2 组测序数据中均表达上调,包括TFAP2AAS1、SOX21-AS1、SIX3-AS1、RHPN1-AS1、OSTM1-AS1、NAALADL2-AS2、MNX1-AS1、MIR210HG、MIR205HG、 LINC01158、LINC01143、LINC01093、LINC01037、LINC00958、LINC00898、LINC00885、LINC00668、LINC00648、LINC00511、LINC00355、LINC00336、LINC00237、HOXC-AS3、HOXC13-AS、GS1-594A7.3、DLEU7-AS1、CASC9、AFAP1AS1、AC123023.1、AC112721.2、AC106875.1、AC092168.2及AC007128.1;同 时, 有24 个lncRNAs 在 上 述2 组测序数据中均表达下调,包括WT1-AS、PRICKLE2-AS2、NR2F2-AS1、MIR503HG、MIR497HG、MEG3、MEF2C-AS1、MAGI2-AS3、MAGG1-AS1、LINC01140、LINCO1016、LINC00994、LINC00629、JAZF1-AS1、HAND2-AS1、GAS6-AS2、DIO3OS、CTD-2270F17.1、CACNA1G-AS1、ADAMTS9-AS2、 SOCS2-AS1、ACTA2-AS1、AC009110.1 及A2M-AS1。
2.4 GO 功能分析和KEGG 通路分析
为更好地分析差异表达lncRNAs 涉及的生物学过程、分子功能及细胞成分,本研究对差异表达lncRNAs 进行GO 功能分析,结果(图3)显示其主要与细胞黏附、免疫反应、炎症反应及细胞增殖等相关。同时,采用KEGG通路分析对差异表达lncRNAs 进行研究,结果(图4)显示其主要富集在PI3K-Akt 信号通路、细胞黏附分子、细胞因子受体等相关通路。
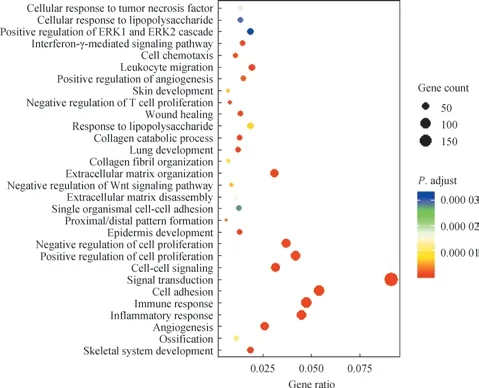
图3 差异表达lncRNAs 的GO 功能分析Fig 3 GO function analysis of differentially expressed lncRNAs
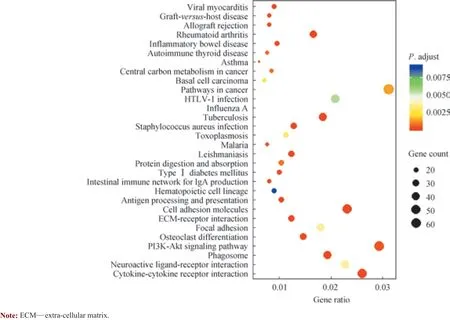
图4 差异表达lncRNAs 的KEGG 通路分析Fig 4 KEGG pathway analysis of differentially expressed lncRNAs
3 讨论
既往研究[2]认为,lncRNAs 是RNA 聚合酶Ⅱ转录的副产物,是基因组转录的“噪音”,不具有生物学功能。然而,近年来的大量研究[6]表明,lncRNAs 参与了DNA 甲基化、染色质重塑、组蛋白修饰、细胞周期调控、mRNA降解和翻译调控等多种生物学过程;且部分lncRNAs 还在肿瘤的发生与发展中发挥了重要作用[7]。
目前,鲜少有关于EC 的lncRNAs 的表达谱的相关分析。Chen 等[8]对6 例早期低级别Ⅰ型EC 组织及癌旁组织的lncRNAs 表达谱进行测序分析,研究lncRNAs 的微肽翻译潜能,结果发现部分lncRNAs 具有微肽翻译潜力,其可能通过自身翻译产物发挥调控功能;该研究结合既往卵巢癌及宫颈癌lncRNAs 测序结果,对妇科生殖系统三大肿瘤的差异表达lncRNAs 进行meta 分析,结果显示部分lncRNAs 在2 种以上肿瘤中均存在差异表达,如在EC 中有4 个特异表达的lncRNAs,包括上调表达的LINC00645、LINC01480 以 及 下 调 表 达 的LINC00702、LINC00891,其中LINC00645 在本研究的测序结果中显示上调表达近5 倍。Li 等[9]研究发现LINC00645 在脑胶质瘤中表达上调,且与患者的生存率及预后相关;继而提示,LINC00645 也可能在EC 的发生及发展中扮演了重要角色。
本研究利用转录组测序技术分析了21 例EC 组织标本及5 例正常内膜组织标本的lncRNAs 的差异表达谱。结果发现,共筛选出上调表达lncRNAs 2 046 个、下调表达lncRNAs 1 014 个,即在EC 中存在一系列异常表达的lncRNAs,继而表明lncRNAs 在EC 的发病机制中可能具有潜在作用。同时,有部分lncRNAs 在EC 中的作用已被报道,如H19、MEG3 等[5,8]。另外,本研究的测序结果中还发现了大量新的差异表达lncRNAs,且大部分的lncRNAs 功能尚不清楚。
随后,本研究采用GO 功能分析和KEGG 通路分析对测序数据进行初步分析。GO 功能分析结果显示,差异表达lncRNAs 主要涉及的生物学过程包括细胞黏附、免疫反应、炎症反应及细胞增殖等;继而提示,免疫及炎症反应可能在调节EC 生长过程中发挥了重要作用。同时,KEGG 通路分析结果显示,差异表达lncRNAs 主要与PI3K-Akt 信号通路、肿瘤相关信号通路、细胞黏附分子、细胞因子受体等信号通路,这些所涉及的生物学过程与信号通路均与肿瘤特性相关。
本研究结合TCGA 数据库中EC 转录组测序数据进行分析,结果发现共有57 个lncRNAs 同时在TCGA 数据库及本研究测序结果中表达上调或下调,提示这些lncRNAs 可能参与EC 的发生;其中,有少数lncRNAs 在EC 的相关研究中已被报道[5,8],但其是否可作为EC 的特异性lncRNAs 以及诊断、治疗的靶标,尚需体内外实验等进一步验证。2018 年Yang 等[10]研究发现,HAND2-AS1 在子宫内膜样癌中的表达显著下调,且与该疾病的组织分级、转移及复发相关;且在体外模型中,过表达HAND2-AS1 能明显抑制EC 细胞的迁移及侵袭。在本研究中,qPCR 验证结果提示SOX21-AS1 在EC 中表达明显上调。既往研究[11-13]显示,SOX21-AS1 在肝癌、结直肠癌、肺癌及宫颈癌等多种恶性肿瘤中表达上调;且在宫颈癌中SOX21-AS1 甲基化水平有明显降低,但其表达水平则明显升高,就临床样本分析发现其与国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期、淋巴结转移及宫颈浸润深度均呈正相关。另 外,WT1-AS、 HOXC-AS3、 AFAP1-AS1、HAND2-AS1等多个lncRNAs 在宫颈癌、肝癌、乳腺癌、胃癌等肿瘤中均有相关研究报道[14-18]。目前,上述lncRNAs 在EC 中的作用尚未见报道,有待后续进一步探究。
综上,本研究通过对EC 组织和正常内膜组织的转录组进行测序分析其lncRNAs 差异表达谱,结果显示2 个 组织样本中lncRNAs 的表达存在显著差异;进一步的功能分析提示,部分lncRNAs 可能参与EC 的发生及发展过程。由于lncRNAs 具有较高的组织特异性,深入分析这些lncRNAs 或将为EC 的研究及靶向治疗提供新思路。
参·考·文·献
[1] Morice P, Leary A, Creutzberg C, et al. Endometrial cancer[J]. Lancet, 2016, 387(10023): 1094-1108.
[2] Flynn RA, Chang HY. Long noncoding RNAs in cell-fate programming and reprogramming[J]. Cell Stem Cell, 2014, 14(6): 752-761.
[3] Arun G, Diermeier SD, Spector DL. Therapeutic targeting of long non-coding RNAs in cancer[J]. Trends Mol Med, 2018, 24(3): 257-277.
[4] He XY, Bao W, Li XC, et al. The long non-coding RNA HOTAIR is upregulated in endometrial carcinoma and correlates with poor prognosis[J]. Int J Mol Med, 2014, 33(2): 325-332.
[5] Guo QY, Qian ZD, Yan DD, et al. LncRNA-MEG3 inhibits cell proliferation of endometrial carcinoma by repressing Notch signaling[J]. Biomedecine Pharmacother, 2016, 82: 589-594.
[6] Rinn JL, Chang HY. Genome regulation by long noncoding RNAs[J]. Annu Rev Biochem, 2012, 81: 145-166.
[7] Schmitt AM, Chang HY. Long noncoding RNAs in cancer pathways[J]. Cancer Cell, 2016, 29(4): 452-463.
[8] Chen BJ, Byrne FL, Takenaka K, et al. Transcriptome landscape of long intergenic non-coding RNAs in endometrial cancer[J]. Gynecol Oncol, 2017, 147(3): 654-662.
[9] Li CL, Zheng HS, Hou WL, et al. Long non-coding RNA linc00645 promotes TGF-β-induced epithelial-mesenchymal transition by regulating miR-205-3p-ZEB1 axis in glioma[J]. Cell Death Dis, 2019, 10(10): 717.
[10] Yang XY, Wang CC, Lee WYW, et al. Long non-coding RNA HAND2-AS1 inhibits invasion and metastasis in endometrioid endometrial carcinoma through inactivating neuromedin U[J]. Cancer Lett, 2018, 413: 23-34.
[11] Wang RJ, Li Y, Du PP, et al. Hypomethylation of the lncRNA SOX21-AS1 has clinical prognostic value in cervical cancer[J]. Life Sci, 2019, 233: 116708.
[12] Wei AW, Li LF. Long non-coding RNA SOX21-AS1 sponges miR-145 to promote the tumorigenesis of colorectal cancer by targeting MYO6[J]. Biomedecine Pharmacother, 2017, 96: 953-959.
[13] Lu XY, Huang CJ, He XZ, et al. A novel long non-coding RNA, SOX21-AS1, indicates a poor prognosis and promotes lung adenocarcinoma proliferation[J]. Cell Physiol Biochem, 2017, 42(5): 1857-1869.
[14] Zhang XY, Zhao XL, Li Y, et al. Long noncoding RNA SOX21-AS1 promotes cervical cancer progression by competitively sponging miR-7/VDAC1[J]. J Cell Physiol, 2019, 234(10): 17494-17504.
[15] Zhang FY, Li JF, Xiao HZ, et al. AFAP1-AS1: a novel oncogenic long noncoding RNA in human cancers[J]. Cell Prolif, 2018, 51(1). DOI: 10.1111/cpr. 12397.
[16] Li XW, Wang Q, Rui YQ, et al. HOXC13-AS promotes breast cancer cell growth through regulating miR-497-5p/PTEN axis[J]. J Cell Physiol, 2019, 234(12): 22343-22351.
[17] Zhang YX, Na RH, Wang XL. LncRNA WT1-AS up-regulates p53 to inhibit the proliferation of cervical squamous carcinoma cells[J]. BMC Cancer, 2019, 19(1): 1052.
[18] Yang Y, Chen L, Gu J, et al. Recurrently deregulated lncRNAs in hepatocellular carcinoma[J]. Nat Commun, 2017, 8: 14421.

