不同测试指标及观测时段对情景条件恐惧实验检测5XFAD 转基因小鼠行为学效力的影响
张 童,张莹林,姚俊岩
上海交通大学附属第一人民医院麻醉科,上海200080
阿尔茨海默病(Alzheimer's disease,AD)是一种进展性的神经退行性疾病,主要表现为学习、记忆及运动能力随年龄增长不断恶化。AD 患者脑内β 淀粉样蛋白(β-amyloid,Aβ)的大量聚集所产生的神经毒性是其产生认知和运动功能障碍的主要原因。近年来,围绕Aβ 的研究一直是AD 领域关注的热点。
在AD 相关的动物实验中,行为学研究往往是后续机制研究的重要前提。目前行为学研究采用较多的是旷场(open field,OF)实验和条件恐惧(fear conditioning,FC)实验。OF 实验主要用于评价AD 小鼠的运动状态,即将实验小鼠放置在四周封闭的空旷场域内任其进行自由活动,在此过程中观察小鼠探索旷场的周边区域产生的一系列自发活动,记录其运动路程和运动速度,即可得出实验小鼠自发活动性[1-2]。情景条件恐惧(contextual fear conditioning,CFC)实验则用于测试AD 小鼠学习和记忆能力。该实验分为训练和测试2 个阶段,主要原理为在训练阶段通过恐惧刺激使实验小鼠形成相关记忆,继而在测试阶段根据实验小鼠对环境刺激做出的恐惧反应,判断其学习和记忆能力是否受损。
据报道[3-5],5XFAD 小鼠在1.5 月龄时,脑内已经有大量的Aβ 聚集;在2 月龄时,即出现淀粉样斑块的沉积;4 ~5 月龄时已可检测到其学习与记忆功能障碍,是研究AD 发生和发展机制的重要工具小鼠。然而,国内外学者采用CFC 实验检测5XFAD 小鼠学习和记忆功能障碍时,采用的评价指标和观测时段各不相同。在CFC 实验中,评价小鼠对恐惧反应记忆能力最常用的2 个指标分别为僵直时间百分比(percent freeze,PF)和活动抑制率(activity suppression ratio,ASR)。PF 是指在特定的观测时段内小鼠处于僵直姿势的时间占比。虽然PF 是经典指标,但有学者提出仅采用PF 反映实验小鼠学习与记忆能力,无法避免自发活动性不同对检测结果造成的偏倚,采用ASR 似乎更为精确[6-7]。上述评价指标和观测时段设定的不同,则将导致CFC 实验的检测结果出现明显差异。如何提高CFC实验对已经存在一定程度认知障碍的5XFAD 小鼠学习和记忆受损的检出效力,值得进一步探讨。
本研究采用已出现认知功能障碍的4 月龄5XFAD 转基因小鼠及其Littermates 小鼠(与5XFAD 小鼠同窝出生但基因型鉴定为阴性的小鼠,即LM 小鼠)为实验对象,首先采用OF 实验测定2 种小鼠自发活动性,继而采用CFC 实验评估小鼠的学习和记忆能力。通过分析2 种小鼠在OF 实验中的总路程和速度以及在CFC 实验训练阶段前60 s 的平均运动指数(average motion index,AMI),比较2 种小鼠自发活动性的差异,以及PF 和ASR 对2 种小鼠学习记忆能力差异性的检出效力。在CFC 测试阶段,分别选取测试阶段前180 s、181 ~360 s 或前300 s 观测实验小鼠的运动状态,比较测试阶段时间段的选择对2 种小鼠PF 和ASR 的影响。
1 对象与方法
1.1 实验动物
将4 只2 月龄、体质量20 ~24 g 的雄性SPF 级5XFAD小鼠 [购自苏州昭衍新药研究中心有限公司,生产许可证号为SCXK(苏)2018-0006]与16 只3 月龄、体质量18 ~23 g 的雌性SPF 级C57BL/6J 野生型小鼠[购自上海西普尔-必凯实验动物有限公司,生产许可证号为SCXK(沪)2018-0006]置于复旦大学实验动物中心SPF 级环境中饲养繁育,并按雌雄比4:1 进行合笼扩群(每笼5 只)。饲养过程严格按照SPF 级动物饲养标准进行,实行自由采食和饮水,每周更换3 次垫料并补充饲料和饮用水。饲养环境内的温度控制在22 ~28 ℃,湿度控制在40%~60%,通风良好,环境安静,室内每日昼夜明暗交替时间为12 h/12 h。所有动物相关操作均遵循国家及上海交通大学医学院附属第一人民医院有关动物伦理规定及条例。
1.2 转基因小鼠基因型鉴定
1.2.1 主要试剂 组织裂解试剂盒(KG205)购自天根生化科技有限公司,2×Taq PCR 预混试剂Ⅱ(KT211)购自天根生化科技有限公司,100 bp DNA 相对分子质量标准(MD109-01)购自天根生化科技有限公司,琼脂糖(A9539)购自美国Sigma 公司,GeneRed 核酸染料(RT211)购自天根生化科技有限公司,50×TAE Buffer(RT204)购自天根生化科技有限公司。
1.2.2 主要仪器 PCR 扩增仪(ProFlex)购自美国ABI公司,低温离心机(Microfuge20R)购自美国Beckman 公司,涡旋仪(S1010E)购自美国Scilogex 公司,凝胶电泳系统(170-4406)美国购自Bio-Rad 公司。
1.2.3 PCR 引物 所有引物均由上海生工生物工程有限公司合成(表1)。

表1 基因鉴定引物序列 Tab 1 DNA identification primer sequences
1.2.4 基因鉴定方法 5XFAD 雄鼠与C57BL/6J 野生型雌鼠繁殖的子代小鼠生长达3 ~4 周龄时,剪取其尾组织0.5 ~1 cm 放入1.5 mL 的无菌EP 管中,使用乙醇棉球按压鼠尾止血。取材期间冰浴放置存放鼠尾的EP 管。每个EP 管中加入组织裂解液48 μL 后离心震荡,于65 ℃消化30 min,其间每隔10 min 弹拨管底使组织和裂解液充分混匀。后于100 ℃煮沸5 min 以灭活消化酶。置于4 ℃降温后,于4 ℃ 9 168×g 离心20 min。取上清液即为DNA 模 板。PCR 反 应 体 系(20 μL):2×Taq PCR Master Mix 10 μL、模板DNA 1 μL、引物2.4 μL 和RNase-free 水6.6 μL。体系配置完毕后,使用PCR 仪进行扩增。扩增反应条件:94 ℃预变性3 min;94 ℃变性30 s,56 ℃退火60 s,72 ℃延伸60 s,循环35 次;72 ℃,5 min 后终止反应。进行PCR 扩增反应的同时,制备1.6%琼脂糖凝胶,凝胶溶液凝固前按1:20 000 加入GeneRed 核酸染料。将扩增产物加入琼脂糖凝胶孔道中电泳,电泳参数设置为电压110 V,持续30 min。电泳过程中使用100 bp DNA 相对分子质量标准标注DNA 相对分子质量梯度。电泳结束后将凝胶置于凝胶成像仪中进行成像分析。当PCR 引物扩增产物长度同时存在377 bp 和608 bp 时,表明该动物同时表达APP 和PS1 基因,判定为5XFAD 转基因小鼠;而其扩增产物长度仅为324 bp 时,表明该动物不表达上述2 种基因,判定为同窝同龄LM 小鼠。
1.3 实验分组
将小鼠按基因表型分类,于SPF 级环境内饲养至4 月龄。选取雌性5XFAD 转基因小鼠12 只为AD 组,雌性同窝同龄LM 小鼠14 只为对照组,进行后续研究。先将实验动物进行OF 实验,结束后使其休息1 d,再进行 CFC实验的训练和测试。
1.4 OF 实验
1.4.1 OF 实验动物行为学分析系统 采用 Noldus 旷场实验分析系统进行行为学测试。该系统包括敞箱、视频记录系统和视频分析系统3 个部分。敞箱为尺寸40 cm×40 cm×60 cm 的封闭箱子,顶部中央安置摄像机,实时拍摄实验小鼠的活动状态,并连接记录系统。
1.4.2 OF 实验过程 将实验小鼠置于敞箱内,任其自由探索300 s,放回原饲养笼。小鼠探索期间记录其在旷场中的运动总路程、中央区域运动路程、周边区域运动路程,以评估小鼠的自发活动性。相邻2 只小鼠实验间隔期间,使用75%乙醇擦洗敞箱内部,清理该小鼠的排泄物和气味,以减少对自发活动性的影响。
1.5 CFC 行为学训练及测试
1.5.1 CFC 训练 采用CFC 实验装置(Med Associates)进行行为学测试。该系统由测试箱、电击刺激控制系统、声音刺激控制系统、红外视频跟踪和记录系统以及动物行为分析系统5 个部分组成。红外视频跟踪和记录系统可拍摄并记录测试箱内的画面,记录频率为30 f/s,每帧画面为320×240 像素。动物行为分析软件(Video Freeze)可综合“空白”画面(未放置小鼠的测试箱画面)以及相邻2 帧画面,计算出相邻2 帧画面中改变的像素数目,该数目即小鼠的运动指数(Δpixels/f)。在选定观测时段后,动物行为分析软件即可完成上述计算并得出该时段内小鼠的平均运动指数(average motion index,AMI)。AMI 可反映小鼠在选定观测时段内的运动情况。本实验中,将小鼠置于情景条件恐惧箱中熟悉环境180 s 后,给予小鼠60 s 声音刺激(3.6 kHz,80 dB),在声音刺激结束前0.5 s,给予0.5 s 不可逃避的足底电击(0.8 mA),间隔120 s 后,重复上述刺激过程一次,使小鼠产生情景条件恐惧。条件刺激结束后使小鼠在箱中停留90 s,随后放回日常饲养笼。将动物行为分析软件(Video Freeze)的参数运动阈值设置为18 pixels/f,最小僵直状态持续时间设置为30 f,选定训练阶段的前60 s 作为观测时段,即可得到2 组小鼠在该时段内的AMI 值,据此比较2 组小鼠自发活动性的差异。
1.5.2 CFC 记忆测试 在CFC 训练结束后的第6日,对2 组实验小鼠分别进行测试,评估小鼠对于情景恐惧的记忆能力。将小鼠置于训练阶段的测试箱箱体内390 s,其间不给予声音和电击刺激,其他测试箱内条件与训练阶段相同。将动物行为分析软件(Video Freeze)的参数运动阈值设置为18 pixels/f,最小僵直状态持续时间设置为30 f,选定测试阶段的前180 s、181 ~360 s 或前300 s 作为观测时段,即可得到小鼠在该时段内的PF 和AMI。测试阶段不同观测时段内的ASR 由以下公式计算:ASR=测试阶段选定时段的AMI/(测试阶段选定时段的AMI+训练阶段前60 s 的AMI)。
1.6 统计学方法
采用GraphPad Prism7.0 软件进行数据分析。PF 实测值和ASR 以±s 表示。采用单因素方差分析比较3 个不同观测时段的PF 实测值和ASR。采用独立t 检验比较2 组小鼠的PF 和ASR。P<0.05 表示差异有统计学意义。
2 结果
2.1 扩群繁育
3 月龄雌性C57BL/6J 野生型小鼠与2 月龄雄性5XFAD 小鼠交配后,成功繁殖出子代幼鼠。每只母鼠孕期为19 ~21 d,哺乳期为18 ~23 d。每胎平均产4 ~6 只幼鼠,成活率>95%。新生小鼠达4 月龄,基因表型鉴定后,随机抽取26 只雌性子代小鼠以备后续实验。
2.2 小鼠基因表型鉴定结果
选取亲代C57BL/6J 野生型小鼠作为阴性对照,亲代5XFAD 转基因小鼠作为阳性对照。部分实验小鼠基因表型鉴定结果如图1 所示,其中携带APP 和PS1 基因者为5XFAD 转基因小鼠(即泳道2、4 ~14、16 ~18 和20),2 种基因均不携带者为LM 小鼠(即泳道1、3、15和19)。
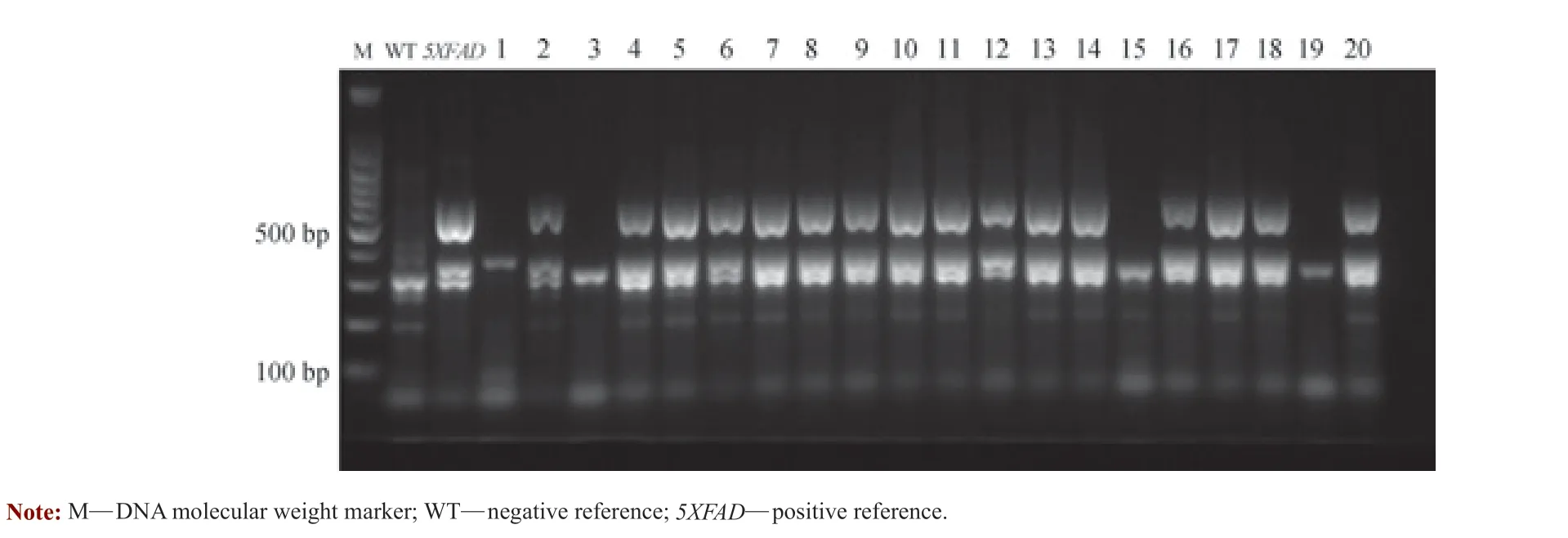
图1 PCR 基因鉴定部分结果示意图Fig 1 Schematic diagram of partial results of PCR geno-typing
2.3 5XFAD 小鼠和LM 小鼠自发活动性的差异
OF 实验中,5XFAD 小鼠和LM 小鼠的总路程分别为(2 077.0±584.7)cm 和(1 997.0±580.3)cm, 速度分别为(8.446±1.733)cm/s 和(8.149±1.599)cm/s,2 组 差异均无统计学意义(P=0.785,P=0.725)。CFC 实验训练阶段的前60 s 中,2 组小鼠的AMI 分别为78.43±30.04和127.50±66.54,差异有统计学意义(P=0.027)(图2)。
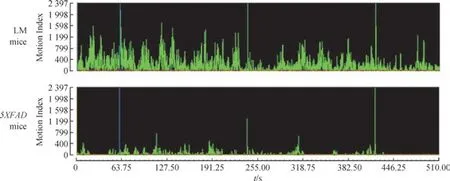
图2 CFC 实验检测2 组小鼠的自发活动性Fig 2 Locomotor activity of the two groups by CFC test
2.4 不同观测时段2 组小鼠PF 和ASR 的比较
评估3 个观测时段内LM 小鼠和5XFAD 小鼠的PF 和ASR,结果显示(图3):LM 组小鼠在3 个观测时段下的PF 间差异有统计学意义(均P<0.05),其ASR 间差异无统计学意义;5XFAD 小鼠在3 个观测时段下的PF 和ASR比较,差异均无统计学意义。3 个观测时段下,2 组小鼠的PF 间差异均无统计学意义;仅在观测时段设定为前180 s时,2 组小鼠的ASR 间差异有统计学意义(P=0.038)。
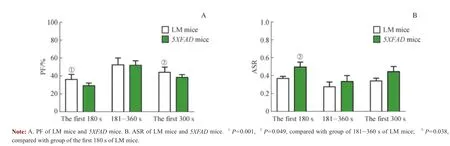
图3 每组小鼠不同观测时段下PF 和ASRFig 3 PF and ASR among different observation periods in each group of mice
3 讨论
本研究采用的5XFAD 转基因小鼠是由Oakley 等[5]通过在AD 模型小鼠APP/PS1 转基因小鼠中引入5 个家族性AD 的突变位点繁育而成。5 个家族性AD 的突变位点包 括APP695 基 因 的K670N/M671L、1716V 和V717I 位点,以及PS1 基因的M146L、L286V 位点。与其他种类AD 小鼠相比,5XFAD 转基因小鼠的斑块沉积更加迅速,并可在脑内产生极高水平的β 淀粉样蛋白42(β-amyloid,Aβ42)。5XFAD 转基因小鼠在1.5 月龄时,脑内即出现大量的Aβ42;生长到2 月龄时,出现淀粉样斑块沉积、胶质增多、突触损伤和神经元丢失,随后出现学习、记忆及运动能力的损害。因此,5XFAD 转基因小鼠在早期即可模拟AD 患者晚期的神经病理过程及行为学表现,常用于AD发病机制和治疗效果的实验研究。本研究成功繁育并且得到表型明确的5XFAD 小鼠和其同窝同龄的野生型对照LM小鼠。
临床研究[8-10]表明,女性更易患有AD,且女性AD患者的临床症状更为严重。此外,已有动物研究[11]表明,同龄雌性AD 小鼠较雄性更易发生认知功能障碍。因此,本研究选用雌性5XFAD 小鼠进行实验,以提高5XFAD 小鼠与LM 小鼠认知行为差异的检出率。
OF 实验中,小鼠在旷场内运动的总路程和速度可一定程度反映其自发活动性[1-2]。临床研究[12-16]表明,已发生认知功能损害的早期AD 患者较未出现认知功能改变的患者更易发生运动功能障碍,运动功能异常的早期AD 患者在远期也更易发生认知功能障碍。因此,小鼠的自发活动性可一定程度反映其学习和记忆能力。本研究采用4 月龄5XFAD 小鼠和LM 小鼠为研究对象,结果发现OF 实验中2 组小鼠运动的总路程和速度无差异,这与O'Leary 等[17]的报道一致。同时该研究还发现,OF 实验无法检测出 6 月龄5XFAD 小鼠的活动性降低。Wagner 等[18]的研究表明,5XFAD 小鼠在7 月龄时,OF 实验才可检测出其自发活动性较LM 鼠小鼠显著下降;而在4 月龄时,5XFAD 小鼠的认知功能已发生损害,并可能因此发生自发活动性降低[5]。因此,OF 实验中小鼠活动的总路程和速度可能并不能反映其真实的自发活动性,是否有更敏感的方法用于检测出年龄较低的5XFAD 小鼠可能存在的活动性降低一直是研究的难点。本研究在进行经典OF 实验后,测定了CFC实验训练阶段的前60 s 内2 组小鼠的AMI。为避免CFC实验受OF 实验影响,将其安排于OF 实验结束1 d 后进行;且在进行CFC 实验前,将小鼠提前1 h 置于实验环境中进行适应。CFC 实验结果表明,5XFAD 小鼠的AMI 值显著低于LM 小鼠,这说明使用AMI 值较总路程和速度可以更好地反映AD 小鼠的自发活动性。
CFC 实验中,实验小鼠在受到伤害性刺激后做出的主要防御行为表现为保持僵直姿势,因此可通过小鼠保持僵直姿势的时长反映其对情景恐惧的学习和记忆能力。该实验最初应用于检测WT 小鼠的认知功能水平,其准确性和可靠性已得到验证,目前正逐渐应用于检测AD 转基因小鼠的认知功能障碍[19]。本研究中,实验小鼠在训练阶段和测试阶段均被置于测试箱中,红外视频跟踪和记录系统记录小鼠在训练和测试阶段中每个时间点的活动状态。该方法可方便研究者任意选取2 个阶段中的特定时段进行观测和研究。研究者在选取目标时段并设定运动阈值和最小僵直状态持续时间后,即可通过动物行为分析软件评估在观测时段内的每个时间点小鼠是否处于僵直状态,继而得到相应的PF。
如上所述,测定PF 首先需要确定观测时段,因此观测时段的设定方法可对行为学实验结果产生重要影响。如测试观测时段设定较长,LM 小鼠和5XFAD 小鼠在观测时段的后期已对环境产生了新的适应,因而降低了检出两者情景恐惧记忆差异的敏感度,导致实验结果准确性降低;如设定为测试阶段的中间某时段,又可能丢失小鼠初始进入环境时对环境产生的情景恐惧记忆反应,对实验结果仍会造成偏倚。因此,如何针对特殊的5XFAD 小鼠选择合适的检测指标和观测时段值得深入研究。
据报道,不同学者选择的观测时段存在明显差异[20-21]。观测时段设定的不同,可导致CFC 测试结果存在明显差异。因此本研究选取了较为常用的3 个观测时段,即前180 s、181 ~360 s 和前300 s,分别测定了LM 小鼠和5XFAD 小鼠于3 个观测时段的PF。结果发现,选取不同观测时段,LM 小鼠的PF 存在显著差异。鉴于上述结果,本研究进一步比较了3 种观测时段下LM 小鼠与5XFAD小鼠的PF 的差异,结果表明差异均无统计学意义。这说明,对于自发活动性降低的5XFAD 小鼠,PF 无法准确反映其对于恐惧伤害的真实记忆,单纯选择PF 将导致实验结果出现假阴性。鉴于PF 的检测效力可能受到自发活动性的影响,本研究测定了2 种小鼠的ASR。ASR 由小鼠在训练阶段和测试阶段的AMI 值计算获得,可以去除个体自发活动性差异的影响,较PF 能够更准确地反映恐惧记忆引起的行为改变[6]。本研究首先测定了LM 小鼠和5XFAD 小鼠3 个观测时段的ASR,结果发现,2 种小鼠分别在3 个观测时段间的差异均无统计学意义。为进一步明确2 种小鼠ASR 间是否存在差异,分别比较了3 个观测时段下2 组小鼠的ASR;结果提示在观测时段设定为181 ~360 s 或前300 s 时,LM 小鼠和5XFAD 小鼠ASR的差异均无统计学意义,而当观测时段选取为测试阶段的前180 s 时,5XFAD 小鼠的ASR 较LM 小鼠明显升高。上述结果说明,虽然观测时段的选取对单一品系小鼠的ASR 无显著影响,但在比较不同品系小鼠的ASR 差异时,选取不同的观测时段可对比较结果产生影响。在常用的 3 个观测时段中,测试阶段的前180 s 较另外2 个观测时段可提高2 种小鼠ASR 的差异检出率。另外,在小鼠自发活动性存在差异时,ASR 较PF 能够更准确地反映行为学实验结果,与相关研究[6-7]结论一致。但上述结果提示,在观测时段设定为181 ~360 s 或前300 s 时,5XFAD 小鼠和LM 小鼠的ASR 间差异无统计学意义;这可能说明在测试阶段的前180 s 内,LM 小鼠的情景恐惧记忆较AD组小鼠更强,而在之后的更长的时间段内,LM 小鼠逐渐对环境产生适应,导致2 种小鼠的ASR 差异减小。
综上所述,本研究发现,4 月龄5XFAD 小鼠的自发活动性较LM 小鼠已出现明显降低,采用CFC 训练阶段前60 s内的AMI 值较经典的OF 实验中的总路程和速度能更灵敏地检测出5XFAD 小鼠的自发活动性降低;采用CFC 实验评估5XFAD 小鼠的学习与记忆能力时,选用ASR 较PF 能够更真实地反映5XFAD 小鼠的学习和记忆能力受损;选取不同的观测时段可对不同品系小鼠ASR 的组间比较产生明显影响,且将观测时段设定为测试阶段的前180 s 更为合理。
参·考·文·献
[1] Leyland M, Robbins T, Iversen SD. Locomotor activity and exploration: the use of traditional manipulators to dissociate these two behaviors in the rat[J]. Anim Learn Behav, 1976, 4(3): 261-265.
[2] Prut L, Belzung C. The open field as a paradigm to measure the effects of drugs on anxiety-like behaviors: a review[J]. Eur J Pharmacol, 2003, 463(1/2/3): 3-33.
[3] Mariani MM, Malm T, Lamb R, et al. Neuronally-directed effects of RXR activation in a mouse model of Alzheimer's disease[J]. Sci Rep, 2017, 7: 42270.
[4] Mast N, Saadane A, Valencia-Olvera A, et al. Cholesterol-metabolizing enzyme cytochrome P450 46A1 as a pharmacologic target for Alzheimer's disease[J]. Neuropharmacology, 2017, 123: 465-476.
[5] Oakley H, Cole S L, Logan S, et al. Intraneuronal β-amyloid aggregates, neurodegeneration, and neuron loss in transgenic mice with five familial Alzheimer's disease mutations: potential factors in amyloid plaque formation[J]. J Neurosci, 2006, 26(40): 10129-10140.
[6] Anagnostaras SG, Wood SC, Shuman T, et al. Automated assessment of pavlovian conditioned freezing and shock reactivity in mice using the video freeze system[J]. Front Behav Neurosci, 2010, 4(158): 1-11.
[7] Paesler K, Xie K, Hettich MM, et al. Limited effects of an eIF2alphaS51A allele on neurological impairments in the 5xFAD mouse model of Alzheimer's disease[J]. Neural Plast, 2015, 2015: 825157.
[8] Winblad B, Amouyel P, Andrieu S, et al. Defeating Alzheimer's disease and other dementias: a priority for European science and society[J]. Lancet Neurol, 2016, 15(5): 455-532.
[9] Xing Y, Tang Y, Jia J. Sex differences in neuropsychiatric symptoms of Alzheimer's disease: the modifying effect of apolipoprotein E epsilon4 status[J]. Behav Neurol, 2015, 2015: 275256.
[10] Altmann A, Tian L, Henderson VW, et al. Sex modifies the APOE-related risk of developing Alzheimer disease[J]. Ann Neurol, 2014, 75(4): 563-573.
[11] Zhang C, Zhang Y, Shen Y, et al. Anesthesia/surgery induces cognitive impairment in female Alzheimer's disease transgenic mice[J]. J Alzheimers Dis, 2017, 57(2): 505-518.
[12] Camicioli R, Howieson D, Oken B, et al. Motor slowing precedes cognitive impairment in the oldest old[J]. Neurology, 1998, 50(5): 1496-1498.
[13] Buracchio T, Dodge HH, Howieson D, et al. The trajectory of gait speed preceding mild cognitive impairment[J]. Arch Neurol, 2010, 67(8): 980-986.
[14] Boyle PA, Wilson RS, Buchman AS, et al. Lower extremity motor function and disability in mild cognitive impairment[J]. Exp Aging Res, 2007, 33(3): 355-371.
[15] Aggarwal NT, Wilson RS, Beck TL, et al. Motor dysfunction in mild cognitive impairment and the risk of incident Alzheimer disease[J]. Arch Neurol, 2006, 63(12): 1763-1769.
[16] Buchman AS, Bennett DA. Loss of motor function in preclinical Alzheimer's disease[J]. Exp Rev Neurother, 2011, 11(5): 665-676.
[17] O'Leary TP, Mantolino HM, Stover KR, et al. Age-related deterioration of motor function in male and female 5xFAD mice from 3 to 16 months of age[J]. Gen Brain Behav, 2018, 19(3): e12538.
[18] Wagner JM, Sichler ME, Schleicher EM, et al. Analysis of motor function in the Tg4-42 mouse model of Alzheimer's disease[J]. Front Behav Neurosci, 2019, 13(107): 1-13.
[19] Bromberg PM. Something wicked this way comes: trauma, dissociation, and conflict: the space where psychoanalysis, cognitive science, and neuroscience overlap[J]. Psychoanal Psychol, 2003, 20(3): 558-574.
[20] Hwang KD, Bak MS, Kim SJ, et al. Restoring synaptic plasticity and memory in mouse models of Alzheimer's disease by PKR inhibition[J]. Mol Brain, 2017, 10(1): 57.
[21] Dinkins MB, Enasko J, Hernandez C, et al. Neutral sphingomyelinase-2 deficiency ameliorates Alzheimer's disease pathology and improves cognition in the 5XFAD mouse[J]. J Neurosci, 2016, 36(33): 8653-8667.

