OX40/FcγR 多基因人源化小鼠模型的构建及在激动型OX40抗体研究中应用的验证
刘明东,刘小波,赵英杰,张 燕,张慧慧,李福彬
上海交通大学基础医学院免疫学与微生物学系,上海市免疫学研究所,上海200025
单克隆抗体免疫治疗是一种新兴且十分有效的肿瘤治疗方法。以抗细胞毒性T 淋巴细胞相关蛋白 -4(cytotoxic T-lymphocyte-associated protein-4,CTLA-4)抗体和程序性死亡受体 -1(programmed death-1,PD-1)抗体为代表的免疫检查点抑制型抗体已经被广泛应用于临床,James P. Allison 和Tasuku Honjo 作为主要贡献者被授予2018 年诺贝尔生理学或医学奖。然而,免疫检查点抑制型抗体在临床治疗中存在部分患者无效以及出现严重不良反应等问题[1-2],亟需进一步研发其他治疗手段。作用于免疫共刺激分子,如肿瘤坏死因子受体超家族成员5(tumor necrosis factor receptor superfamily member 5,CD40)、 肿 瘤 坏死因子受体超家族成员4(tumor necrosis factor receptor superfamily member 4,OX40)的激动型抗体被认为是一类具有广泛潜力的抗体,它们能够激活免疫检查点的细胞信号通路[3-4],进而激活免疫细胞增加免疫系统的反应性,发挥抗肿瘤作用。但是目前激动型抗体尚未被成功应用于临床,需要进一步研发。为此,构建能够有效评估抗体活性的动物模型成为关键。
OX40 是一类表达在T 细胞上的共刺激分子[5-6],属于肿瘤坏死因子受体超家族(tumor necrosis factor receptor superfamily,TNFRSF)。激活T 细胞上的OX40 能够明显促进T 细胞增殖,提高T 细胞的反应活性[7-10]。2000 年,Weinberg 等[11]首次在小鼠体内验证了抗OX40 抗体的抗肿瘤作用。虽然目前已经有数种抗OX40 抗体药物进入了临床试验阶段[12],但抗OX40 抗体的抗肿瘤机制并未被完全阐明。一般认为,抗OX40 抗体可直接激活效应T 细胞的OX40 信号通路,提高免疫细胞对肿瘤细胞的杀伤作用[11]。近年来有研究[13]表明,抗OX40 抗体分子可以通过结合活化型Fcγ 受体(Fcγ receptor,FcγR)来清除肿瘤微环境中高表达OX40 的调节性T 细胞(regulatory T cell,Treg 细胞),解除Treg 细胞对于免疫应答的抑制。也有学者认为,作用于TNFRSF 成员的抗体可能会通过抑制型FcγR 来激活靶点分子的信号通路[13-14]。因此,一个适合抗人OX40 抗体实验的小鼠模型除了要表达人源化的OX40分子,应该同时表达人源化的FcγR。
目前,用于研究适用于人类靶点分子的人类激动型抗体的小鼠模型主要有靶点分子人源化小鼠、人源化小鼠(接受了人类免疫细胞移植的免疫缺陷小鼠)、靶点分子和FcγR 人源化的小鼠,这几种模型具有不同的特点。靶点分子人源化小鼠由于只是将靶点分子进行了人源化,获取相对简单,但是因为小鼠体内没有人源化的FcγR,所以靶点分子人源化小鼠并不能为人类激动型抗体发挥作用提供完整的环境。人源化小鼠体内存在人类的免疫细胞,理论上可以满足人类激动型抗体的作用条件,但是受体小鼠本身存在免疫缺陷,并且人类免疫细胞和小鼠免疫细胞生存和发育条件有很大的差异性,所以不能保证人类免疫细胞在小鼠体内正常发生免疫应答[15]。只有当与抗体直接结合的靶点分子OX40 和FcγR 人源化了,抗体的工作环境才更接近人体环境,因此构建OX40/FcγR 多基因人源化小鼠模型研究抗人OX40 抗体很有必要。OX40/FcγR 多基因人源化小鼠不但可以为人类激动型抗体提供完整的结合位点,并且拥有健全的免疫系统[16],是目前研究人类激动型抗体最为理想的模型。但是由于FcγR 人源化涉及的基因较多,基因型为Fcgrα-/-/Fcgr1-/-/hFCGR1+/hFCGR2A131R+/hFCGR2B+/hFCGR3A158F+/hFCGR3B+[16][Fcgrα 为编码小鼠Fcγ 受体Ⅱ、Ⅲ和Ⅳ的α 链的基因,Fcgr1 为编码小鼠Fcγ 受体Ⅰ的α 链的基因;hFCGR1、hFCGR2A131R、hFCGR2B、hFCGR3A158F、hFCGR3B 分别为编码人类Fcγ 受体Ⅰ、ⅡA(131R)、ⅡB、ⅢA(158F)、ⅢB 的α 链的基因],使得这种小鼠难以通过常规的杂交繁殖法快速构建。为了能够快速获得OX40/FcγR多基因人源化小鼠,本研究初步验证了骨髓嵌合法的可行性。通过骨髓细胞嵌合法建立的OX40/FcγR 多基因人源化小鼠模型拥有相对正常的免疫系统,可同时提供人源FcγR 和人源OX40 分子,并且模型小鼠制作过程简单、耗时短,可以较好地满足人类激动型抗人OX40 抗体的肿瘤治疗研究。
1 材料与方法
1.1 实验动物及主要试剂
C57BL/6 野生型小鼠,雌性,8 ~10 周龄,体质量20 ~25 g,购自上海灵畅生物技术动物有限责任公司,生产许可证号为SCXK(沪)2018-0003;mFcγR-/-hFcγRtg转 基 因 小 鼠(Fcgrα-/-/Fcgr1-/-/hFCGR1+/hFCGR2A131R+/hFCGR2B+/hFCGR3A158F+/hFCGR3B+) 由 美 国Rockefeller大学Jeffrey V. Ravetch 教授惠赠;hOX40tg转基因小鼠购自上海南方模式生物科技股份有限公司,生产许可证号为SCXK(沪)2014-0002。以上小鼠均饲养于上海交通大学医学院实验动物科学部SPF 级动物房,使用许可证号为SYXK(沪)2018-0027。所有实验动物相关操作均获得上海交通大学医学院实验动物使用和管理委员会 批准。
流式细胞实验中使用的抗体信息见表1。人类抗人OX40 抗体A、人类抗人OX40 抗体B、DEC-OVA 蛋白[抗DEC205 抗体和卵清蛋白(OVA)的融合蛋白,用于提呈OVA 抗原]均购自信达生物制药有限公司。红细胞裂解液、蛋白转运抑制剂Brefeldin A 购自上海碧云天生物技术有限公司,人IgG 同型对照抗体购自美国BioLegend公司,青链霉素购自北京四季青生物科技有限责任公司,SIINFEKL 抗原肽购自美国BioLegend 公司,抗CD28 抗体、抗CD3 抗体购自美国BD 公司。
表1 流式抗体列表Tab 1 List of antibodies for flow cytometry
1.2 实验方法
1.2.1 骨髓嵌合小鼠的制备方法 取8~24周龄的mFcγR-/-hFcγRtg转基因小鼠或者hOX40tg转基因小鼠。处死后,取小鼠股骨、胫骨。用剪刀去除骨的两端。用1 mL 注射器吸取无菌PBS 缓冲液,反复冲洗骨髓腔中的骨髓至六孔板中。用孔径70 μm 细胞滤网过滤骨髓细胞悬液,将骨髓细胞悬液移至15 mL 离心管中400×g 离心5 min。弃去上清液,向离心管中加入4 mL 红细胞裂解液,置于冰上裂解红细胞。5 min 后,向离心管中加入10 mL PBS 终止反应。离心管400×g 离心5 min 后,弃上清液,重复操作 2 遍。使用细胞计数板计数,将细胞密度调节到1×107/mL。 然后将2 种小鼠的骨髓悬液按照1:1 的比例混合。把混合好的骨髓细胞悬液经尾静脉注射到经过8 Gy 辐照的8 周龄的C57BL/6 野生型小鼠体内,每只小鼠注射200 μL 骨髓细胞悬液。小鼠正常饮食,饮用水中含有1×青链霉素,2 个月后进行实验。
1.2.2 外周血和脾脏淋巴细胞的采集及处理 通过眼眶采集外周血约100 μL,加入肝素抗凝。处死小鼠,取小鼠右侧腹股沟淋巴结、脾脏。取下的淋巴结、脾脏经孔径70 μm 的细胞滤网研磨,在研磨液中加入 1×PBS 溶液制成细胞悬液。外周血和脾细胞悬液采集后均需要使用红细胞裂解液裂解红细胞。①hCD32 的检测:获取的外周血、脾细胞悬液、淋巴结细胞悬液使用流式抗体染色。所有抗体均稀释400 倍使用,染色后的细胞通过流式细胞仪检测。②γ-干扰素(interferon γ,IFN-γ)的流式检测:将制备好的脾细胞悬液200 μL 置于96 孔板中,每孔细胞数为2×106个。向 每 孔 加 入1 μg/mL 抗CD28 抗 体、1 μg/mL SIINFEKL 抗原肽。在细胞培养箱中37 ℃孵育1 h 后每孔细胞中加入10 μg/mL 蛋白转运抑制剂Brefeldin A。继续孵育5 h 后根据流式抗体说明书进行染色。③人源OX40分子表达的流式检测:将制备好的外周血、淋巴细胞悬液、脾细胞悬液置于96 孔板中,每孔细胞数为2×106个。用 含 有2 μg/mL 的 抗CD28 抗 体、2 μg/mL 抗CD3 抗 体的培养基200 μL 重悬细胞。将96 孔板置于细胞培养箱中37 ℃孵育。48 h 后使用流式细胞术进行检测。在检测人源OX40 分子时,使用抗体A 作为一抗,再使用BV421标记的抗hIgG-Fc 流式抗体进行染色。同时使用人类抗人CD40 抗体作为同型对照。
1.2.3 小鼠体内的抗体活性检测 第1 日,将人类抗人OX40 抗体B 和人IgG 同型对照抗体分别与DEC-OVA 蛋白混合,并通过小鼠腹腔(3 只/组)进行注射。其中抗体剂量为每只小鼠250 μg,DEC-OVA 蛋白为每只小鼠5 μg。7 d 后,通过流式细胞术检测CD4+和CD8+T 细胞的IFN-γ 表达水平以及CD4+T 细胞上的人源OX40 的表达水平。
1.3 统计学方法
采用GraphPad Prism 6.0 软件对流式细胞术检测结果进行统计学分析。定量资料以±s 表示。2 组间比较采用t 检验,多组间比较采用单因素方差分析。P<0.05 表示差异具有统计学意义。
2 结果
2.1 骨髓嵌合小鼠中hCD32 的检测
分别将野生型小鼠组(n=3)和骨髓嵌合小鼠组(n=3)的外周血、脾脏及淋巴结中的免疫细胞应用流式细胞术进行分析,以检测骨髓嵌合小鼠中人源FcγR 的表达情况。实验选取人类FcγR 成员中的FcγR Ⅱ A 和FcγR Ⅱ B(统称hCD32)为代表进行流式细胞检测。结果显示,在骨髓嵌合小鼠的外周血、脾脏和淋巴结中,有较高比例的髓系细胞(图1A)和B 淋巴细胞(图1B)表达hCD32。髓系细胞和B 淋巴细胞分别以CD11b 阳性和B220 阳性的免疫细胞表示。这一结果说明,骨髓嵌合小鼠可以正常表达人源FcγR 分子。
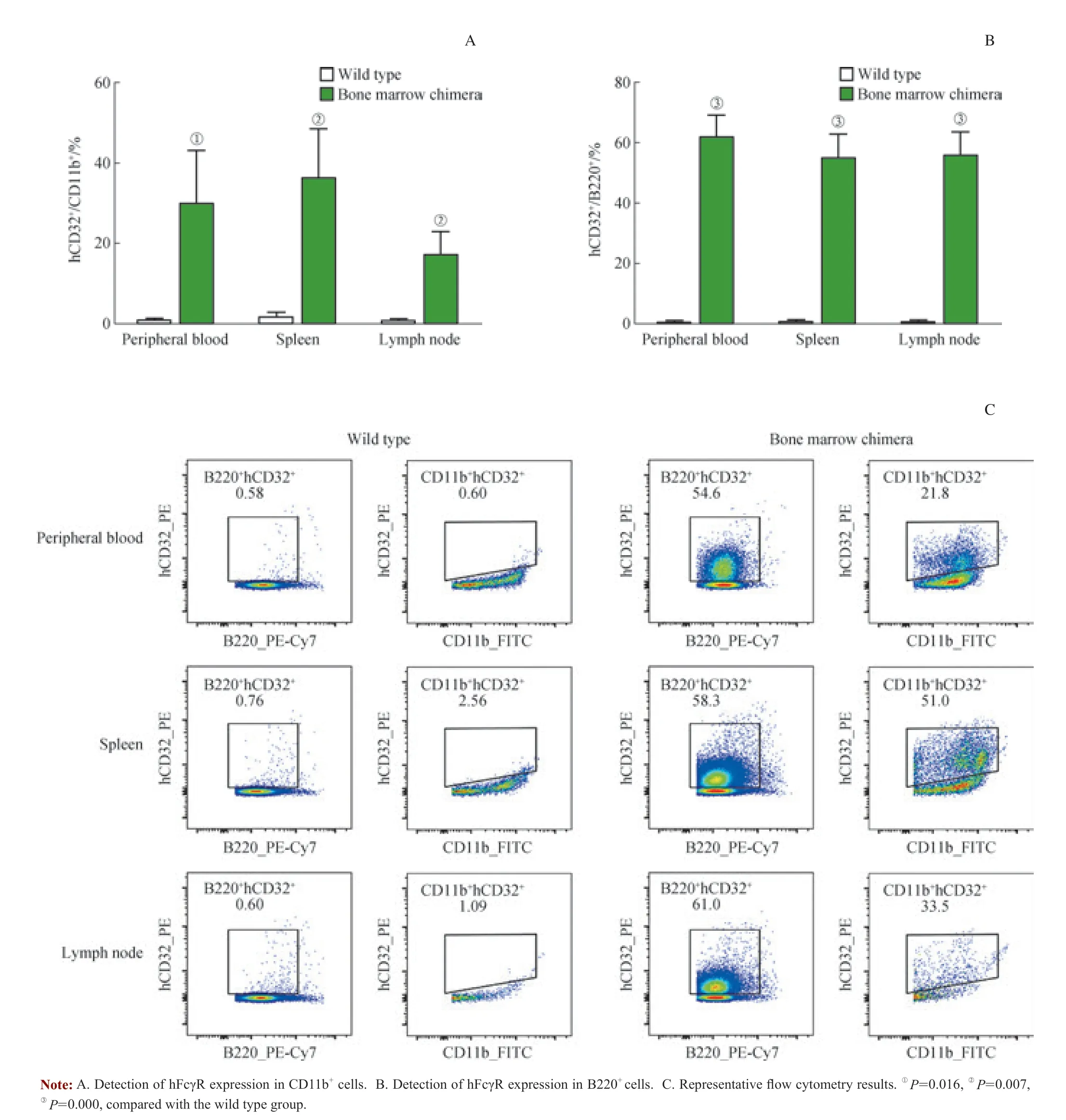
图1 骨髓嵌合小鼠体内表达人源FcγR 的检测Fig 1 Detection of hFcγR expression in bone marrow chimera mice
2.2 骨髓嵌合小鼠中人源OX40 的检测
使用含抗CD3 抗体、抗CD28 抗体的培养基对野生型小鼠(n=3)和骨髓嵌合小鼠(n=3)的脾细胞进行刺激培养。2 d 后,用流式细胞术对脾细胞中CD4+T 细胞和CD8+T 细胞表面的人源OX40 分子进行检测。结果显示,抗体刺激后的脾细胞中有将近50%的CD4+T 细胞和CD8+T 细胞表达人源OX40 分子(图2)。
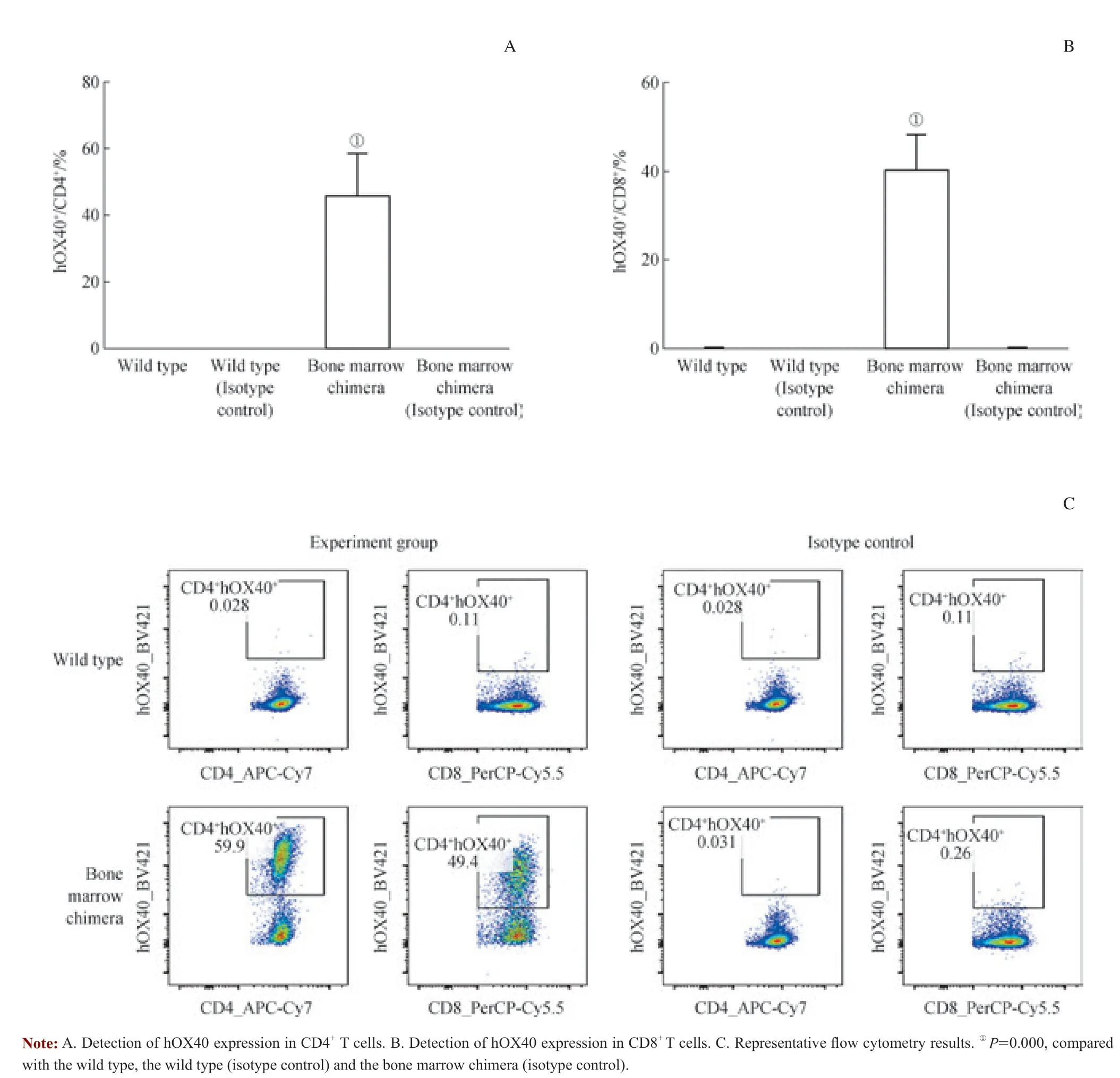
图2 骨髓嵌合小鼠体内人源OX40 的检测Fig 2 Detection of hOX40 expression in bone marrow chimera mice
2.3 检测人类抗人OX40 抗体对CD4+ T 细胞活性的促进作用
抗体B 为人类抗人OX40 抗体。第1 日,将抗体与DEC-OVA 蛋白的混合液对小鼠(n=3)进行腹腔注射。7 d 后,检测CD4+T 细胞的IFN-γ 和人源OX40 分子的表达水平,两者均出现了明显升高,表明人类抗人OX40 抗体对CD4+T 细胞有明显的激活能力(图3)。
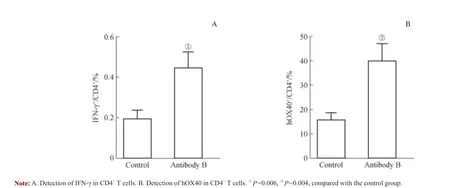
图3 骨髓嵌合小鼠CD4+ T 淋巴细胞活性检测Fig 3 Detection of activity of CD4+ T lymphocyte in bone marrow chimera mice
2.4 检测人类抗人OX40 抗体对CD8+ T 细胞活性的促进作用
第1 日,将抗体B 与DEC-OVA 蛋白的混合液对小鼠(n=3)进行腹腔注射。7 d 后,通过检测CD8+T 细胞的IFN-γ 表达水平分析人类抗人OX40 抗体对CD8+T 细胞的激活水平。实验结果表明抗体B 对骨髓嵌合小鼠CD8+T细胞具有明显的激活能力(图4)。
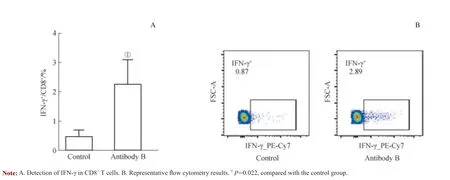
图4 骨髓嵌合小鼠CD8+ T 细胞活性检测Fig 4 Detection of activity of CD8+ T in bone marrow chimera mice
3 讨论
抗OX40 抗体的肿瘤治疗效果已经在临床前实验和临床试验中得到了验证[17-18]。为了继续对抗OX40 抗体的肿瘤治疗机制进行研究和进一步优化抗体的治疗效果,迫切需要建立一个拥有健全免疫系统并且表达有人源FcγR 和人源OX40 分子的小鼠模型。结合现有条件,本研究组获得这种小鼠模型有2 种方法:一种是通过OX40 人源化小鼠与FcγR 人源化小鼠的不断回交获得;另一种是通过将骨髓嵌合的方法获得,即将人源OX40 分子和人源FcγR的小鼠的骨髓细胞按照1:1 的比例混合,然后通过尾静脉将骨髓细胞混合液注射到辐照过的野生型小鼠体内,形成嵌合小鼠。
通过对比2 种方法的优缺点,我们发现与杂交繁殖法相比,骨髓嵌合法可以在短时间内满足实验需求,并且组内差异更小。这是因为基因型纯合小鼠的繁殖率较低,很难在短时间内获得足够数量的实验用小鼠,并且人源化FcγR 小鼠涉及的基因较多,需要较长的繁殖时间才可以获得基因型纯合小鼠。而作为骨髓嵌合受体的野生型小鼠可以直接从公司大量订购,能够节省大量时间。同时,同一批次的小鼠年龄、性别、生理状态非常接近,可以在一定程度上降低无关因素对实验结果的影响。虽然骨髓嵌合法的一些实验操作要求较高,比如尾静脉注射,但是如果加上实验操作练习的时间,骨髓嵌合法仍然要比杂交繁殖法高效。此外,已有研究[3]证明这种依赖于FcγR 的抗肿瘤效应为顺式作用,即需要通过OX40 分子和FcγR 分子分别表达在不同的细胞上。因此,骨髓嵌合小鼠中人源OX40 分子和FcγR 分子在2 种细胞上的分别表达并不会影响抗体依赖FcγR 发挥作用。
因为骨髓嵌合法具有一定复杂性,所以我们对模型是否建立成功进行了进一步的实验验证。我们首先确认了供体小鼠的人源化分子表达情况。通过流式细胞术检测骨髓嵌合小鼠脾脏、外周血和淋巴结中的免疫细胞,我们发现约50%的B 淋巴细胞和髓系细胞表达人源hCD32。这一结果表明骨髓嵌合小鼠可以正常表达人源FcγR;同时,骨髓嵌合小鼠的脾脏细胞在经过抗CD3 和抗CD28 抗体激活后,CD4+T 细胞和CD8+T 细胞表面会表达高水平的人源化OX40 分子。最后,我们使用了人类抗人OX40 抗体对骨髓嵌合小鼠进行了检测。抗体B 在骨髓嵌合小鼠体内表现出了对CD8+T 细胞较强的激活能力。这说明骨髓嵌合小鼠拥有较为完整的免疫系统,可以为人类抗人OX40 抗体发挥作用提供条件。
综上所述,本研究成功构建了一种可以模拟人类抗人OX40 抗体的人体作用环境的OX40/FcγR 多基因人源化小鼠模型。通过骨髓嵌合法获得的小鼠不仅可以同时表达人源化的OX40 分子和FcγR 分子,拥有类似于人体的抗体作用环境,而且个体之间在性别、年龄和人类FcγR 基因型(来自相同的骨髓细胞)方面的差异较杂交繁殖法小,且耗时短,为探究不同人类抗人OX40 抗体的作用机制,筛选高效的抗体提供了条件。同时,对于同种类型的其他抗体,如抗CTLA-4 抗体、抗4-1BB(肿瘤坏死因子受体超家族成员9,tumor necrosis factor receptor superfamily member 9)抗体和抗PD-1 抗体,本方法也有应用潜力。今后,对构建其他多基因人源化小鼠的有效性,以及骨髓嵌合小鼠与杂交繁殖策略产生的小鼠之间的差异性将做进一步研究。
参·考·文·献
[1] Ribas A, Wolchok JD. Cancer immunotherapy using checkpoint blockade[J]. Science, 2018, 359(6382): 1350-1355.
[2] Ott PA, Hodi FS, Kaufman HL, et al. Combination immunotherapy: a road map[J]. J Immunother Cancer, 2017, 5: 16.
[3] Li FB, Ravetch JV. Antitumor activities of agonistic anti-TNFR antibodies require differential FcγR Ⅱ B coengagement in vivo[J]. Proc Natl Acad Sci U S A, 2013, 110(48): 19501-19506.
[4] Beers SA, Glennie MJ, White AL. Influence of immunoglobulin isotype on therapeutic antibody function[J]. Blood, 2016, 127(9): 1097-1101.
[5] Redmond WL, Ruby CE, Weinberg AD. The role of OX40-mediated Costimulation in T-cell activation and survival[J]. Crit Rev Immunol, 2009, 29(3): 187-201.
[6] Croft M. Control of immunity by the TNFR-related molecule OX40 (CD134)[J]. Annu Rev Immunol, 2010, 28: 57-78.
[7] So T, Song JX, Sugie K, et al. Signals from OX40 regulate nuclear factor of activated T cells c1 and T cell helper 2 lineage commitment[J]. Proc Natl Acad Sci U S A, 2006, 103(10): 3740-3745.
[8] Ruby CE, Montler R, Zheng R, et al. IL-12 is required for anti-OX40-mediated CD4 T cell survival[J]. J Immunol, 2008, 180(4): 2140-2148.
[9] Valzasina B, Guiducci C, Dislich H, et al. Triggering of OX40 (CD134) on CD4+CD25+T cells blocks their inhibitory activity: a novel regulatory role for OX40 and its comparison with GITR[J]. Blood, 2005, 105(7): 2845-2851.
[10] Lei FY, Song JY, Haque R, et al. Regulation of A1 by OX40 contributes to CD8+T cell survival and anti-tumor activity[J]. PLoS One, 2013, 8(8): E70635.
[11] Weinberg AD, Rivera MM, Prell R, et al. Engagement of the OX-40 receptor in vivo enhances antitumor immunity[J]. J Immunol, 2000, 164(4): 2160-2169.
[12] Aspeslagh S, Postel-Vinay S, Rusakiewicz S, et al. Rationale for anti-OX40 cancer immunotherapy[J]. Eur J Cancer, 2016, 52: 50-66.
[13] Bulliard Y, Jolicoeur R, Zhang JM, et al. OX40 engagement depletes intratumoral Tregs via activating FcγRs, leading to antitumor efficacy[J]. Immunol Cell Biol, 2014, 92(6): 475-480.
[14] Li FB, Ravetch JV. A general requirement for FcγR Ⅱ B co-engagement of agonistic anti-TNFR antibodies[J]. Cell Cycle, 2012, 11(18): 3343-3344.
[15] Shultz LD, Brehm MA, Garcia-Martinez JV, et al. Humanized mice for immune system investigation: progress, promise and challenges[J]. Nat Rev Immunol, 2012, 12(11): 786-798.
[16] Smith P, DiLillo DJ, Bournazos S, et al. Mouse model recapitulating human Fcγ receptor structural and functional diversity[J]. Proc Natl Acad Sci U S A, 2012, 109(16): 6181-6186.
[17] Aspeslagh S, Postel-Vinay S, Rusakiewicz S, et al. Rationale for anti-OX40 cancer immunotherapy[J]. Eur J Cancer, 2016, 52: 50-66.
[18] Curti BD, Kovacsovics-Bankowski M, Morris N, et al. OX40 is a potent immune-stimulating target in late-stage cancer patients[J]. Cancer Research, 2013, 73(24): 7189-7198.

