西酞普兰对抑郁症患者外周血miRNA-16/5- 羟色胺转运体 通路的影响
钱时兴,房 圆,孙 琳,仇 琦,林治光,肖世富,李 霞
上海交通大学医学院附属精神卫生中心老年科,上海 200030
抑郁症是一种有明显的复发和慢性化趋向的精神疾病,终生患病率高达15%~20%[1]。在众多抑郁症发病的生化机制假说中,5-羟色胺(5-hydroxytryptamine,5-HT)功能低下是较公认的一种观点。5-HT 是一种抑制性神经递质,使交感神经节前纤维兴奋及副交感神经节前纤维抑制,参与多种中枢神经活动,如情绪控制、调节睡眠、焦虑、酗酒、摄食、性行为等[1]。在中枢系统,上述调节作用主要由突触间隙的5-HT 完成。当神经元受到刺激兴奋时,细胞内囊泡前移与突触前膜融合并释放5-HT 至突触间隙,作用于突触后靶细胞受体或突触前自身受体。5-HT 与受体结合发挥作用后即迅速解离。为防止5-HT 在突触间隙堆积,其最主要的失活方式是被突触前膜5-HT 转运体 (serotonin transporter,SERT)摄取入轴突内并再次进入囊泡储存。因此,对于突出间隙的5-HT 而言,SERT 是一种关键调节蛋白,是5-HT 功能低下假说重要组成部分。目前使用的主流抗抑郁药物5-HT 再摄取抑制剂(selective serotonin reuptake inhibitors,SSRIs)也是通过调节SERT进一步调控抑郁症患者中枢5-HT,从而起到抗抑郁作用。
近年来,在5-HT 功能低下假说基础上,一些研究进一步探讨了微小RNA(microRNA,miRNA)在抑郁症发病机制中的作用。miRNA 是一类真核生物内源性的非编码单链RNA,能够通过结合或调节特定mRNA 的蛋白翻译过程调控基因表达。miRNA 具有很强的细胞、组织及疾病特异性[2],现有多项抑郁相关的动物实验研究结果表明miRNA-16 是SSRIs 药物的治疗靶点[3]。SSRIs 类药物通过miRNA-16 对动物中缝核等脑区SERT 蛋白的翻译进行调控,进而影响突触间隙5-HT 浓度,但此结论尚缺乏临床研究证据。
虽然抑郁症发病机制涉及抑郁症患者大脑中枢神经,但miRNA-16 / SERT 通路相关指标在外周血浆及血小板中均存在,为临床研究抑郁症的发病机制提供了可能。自发现外周血血小板和中枢系统的5-HT 能神经元都可以释放5-HT,有相同的囊胞单氨转运体和5-HT 受体,编码SERT 的基因也相同后,临床研究中反映人类中枢系统5-HT 功能的外周血指标多用血小板5-HT 相关指标取代,如血小板内5-HT 递质及血小板膜SERT 蛋白。
本研究拟通过检测服用(艾司)西酞普兰的抑郁症患者与未用药患者的外周血miRNA-16 表达水平及血小板膜SERT 蛋白水平,探讨西酞普兰对抑郁症患者外周血miRNA-16/SERT 通路相关指标的影响,希冀为进一步探讨抑郁症的病因及建立抑郁症外周血生物标志物提供依据。
1 对象与方法
1.1 研究对象及分组
抑郁症病例均来源于2012 年3—10 月就诊于上海交通大学医学院附属精神卫生中心心理咨询门诊的患者,健康对照者来源于附属精神卫生中心的工作人员。
未服药病例组入组标准:①符合《美国精神疾病诊断与统计手册(第四版)》[Diagnostic and Statistical Manual of Mental Disorders(Fourth Edition),DSM- Ⅳ]修订版中抑郁症诊断标准,目前处于发作期的30 d 内且未服药。② 年龄18 ~65 岁,男女不限。③筛查和基线的汉密尔顿抑郁量表17 项(Hamilton Depression Scale-17 items,HAMD-17)评分>17 分。④患者本人签署知情同意书。
药物治疗组入组标准:①抑郁发作期符合DSM- Ⅳ修订版抑郁症诊断标准。② 单药服用(艾司)西酞普兰治疗 6 周及以上。③西酞普兰治疗或维持剂量10 ~40 mg,每日1 次(艾司西酞普兰5 ~20 mg,每日1 次),规律服药。④ 年龄18 ~65 岁,男女不限。⑤患者本人签署知情同意书。
健康对照组入组标准:①年龄18 ~65 岁,男女不限。②无抑郁症病史或其他精神疾病史。③本人签署知情同意书。④30 d 内无用药史。⑤抽血前3 d 未服用动物血液、内脏以及牛蛙、海蜇、菠萝、香蕉、咖啡、奶酪等影响外周血5-HT 水平的食物。
1.2 随访研究流程
在首诊完成后对抑郁症患者的处方进行查询。未服药的抑郁症患者45 例中,有14 例医师处方予以(艾司)西酞普兰治疗,其余31 例分别被医师处方予以氟西汀 (4 例)、帕罗西汀(1 例)、舍曲林(12 例)、文拉法辛(6 例)和其他药物(8 例)治疗。与被医师处方予以(艾司)西酞普兰的14 例患者保持约2 周一次的电话联络进行随访,于8 周后进行第2 次随访。
1.3 诊断及评估方法
《DSM- Ⅳ -TR 轴Ⅰ障碍定式临床检查》(患者版)[4]为定式诊断工具。HAMD-17 是临床最常用的抑郁障碍评估工具,用于抑郁严重程度和疗效评估。中文版HAMD-17 的Cronbach's α 系数为0.714,平行效度和结构效度均较理想。共17 个条目,主要采用 0 ~4 分的5 级评分法:0 分为该条目无症状,1 分为轻度症状,2 分为中度症状,3 分为重度症状,4 分为极重度症状。部分条目为0 ~2 分的 3 级评分法:0 分为该条目无症状,1 分为轻至中度症状,2 分为重度症状。HAMD-17 评分总分<7 分判断为无抑郁症状,总分>17 分判断为存在抑郁症状。
1.4 血浆miRNA-16 及血小板SERT 蛋白表达的检测
荧光定量PCR 检测血浆miRNA-16 相对表达量。取5 mL EDTA 抗凝外周血,充分摇匀,4 ℃下536×g 离心30 min,将取得的血浆置于-80 ℃冰箱保存备用。按照miRcute miRNA Isolation Kit 说明书从血浆中提取miRNA。依照PrimeScript 1st Strand cDNA Synthesis Kit 结合颈环引物进行反转录,按照TaqMan 通用试剂盒Ⅱ说明书进行荧光定量PCR 反应,通过ABI 7500 型PCR 仪测定CT值,每个反应重复3 次。以5 S RNA 为看家基因,按照2-△△CT方法计算检测miRNA 的相对表达水平。
Western blotting 检测血小板中SERT 蛋白水平。主要试剂:一 抗 为Anti-Serotonin Transporter(AB10514P,CBA 公司),按照说明书稀释;二抗为辣根过氧化酶标记的羊抗兔IgG-HRP(上海西唐公司),工作浓度1:5 000。检测标本上样量均为校正后的15 μg 血清蛋白。内参GAPDH 的稀释终浓度为1:2 000,上样量为15 μg。根据SERT 蛋白与内参蛋白GAPDH 条带灰度的比值,计算SERT 蛋白的相对表达量。
1.5 统计学方法
采用SPSS 17.0 软件进行统计分析。采用Kolmogorov- Smirnov 检验进行正态分布检验,符合正态分布的定量资料以±s 表示;组间样本的年龄比较采用方差分析,组间性别构成比较采用χ2检验。miRNA-16 采用常用对数相关转换使其符合正态分布,血小板SERT 蛋白相对表达量符合正态分布。对正态分布的资料采用方差分析进行组间比较,组间存在差异采用独立样本t 检验进行两两比较。定性资料以频数表示。对于14 例未服药抑郁症患者进行随访,随访数据和基线数据的比较采用配对样本t 检验。所有统计检验均为双侧检验,P<0.05 表示差异具有统计学意义。
2 结果
2.1 组间基本资料比较
未服药病例组入组47 例患者,其中剔除1 例合并精神发育迟缓患者、1 例原发性血小板减少患者,最后入组45 例;药物治疗组入组33 例患者,其中剔除1 例不规律服药患者,最后入组32 例(其中服用西酞普兰19 例,艾司西酞普兰13 例);健康对照组匹配性别、年龄、文化程度,招募入组32 例。未服药病例组、药物治疗组、健康对照组之间性别、年龄的差异无统计学意义,HAMD-17评分差异有统计学意义(P=0.000)(表1)。
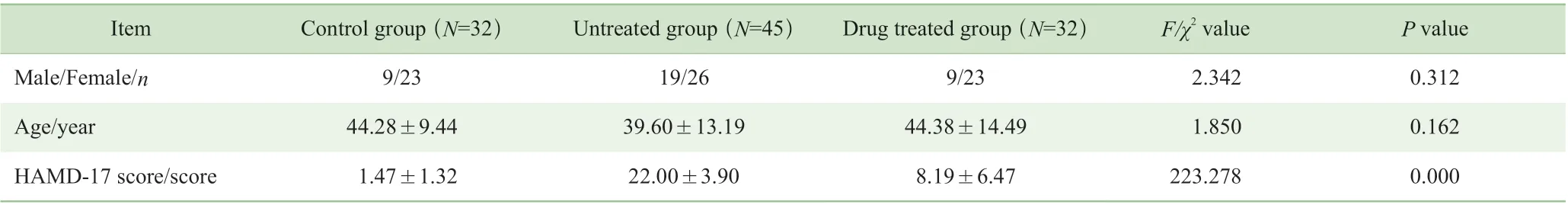
表1 3 组一般资料比较Tab 1 Comparison of general data among the three groups
2.2 血浆miRNA-16 及血小板SERT 蛋白表达水平
健康对照组miRNA-16 相对表达量为1.00±1.18,未服药病例组为0.81±0.85,药物治疗组为1.08±1.78, 3 组间差异无统计学意义(F=0.421,P=0.657)。健康对照组血小板SERT 蛋白的相对表达量为0.96±0.31,未服药病例组为 0.93±0.35,药物治疗组为0.89±0.35,3 组间差异亦无统计学意义(F=0.112,P=0.894)。
2.3 随访研究结果
被随访患者与未被随访患者的性别、年龄、HAMD-17 评分、服药前miRNA-16 相对表达量比较,差异均无统计学意义。
未 服 药 病 例 组 男 性7 例, 女 性7 例, 平 均 年 龄(39.57±14.55)岁。未服药病例组患者经过2 个月治疗,HAMD-17 评分从(21.43±3.37)分降至(10.07±6.91)分,差异有统计学意义(Z=-3.187,P=0.001);未服药病例组14 例患者中, 7 例(50%)患者减分率大于50% 。患者服药前后血小板 SERT蛋白表达水平比较,差异无统计学意义(t=-0.750,P=0.470);经过2 个月的(艾司)西酞普兰治疗,患者血浆miRNA-16 相对表达量升高,差异有统计学意义(t=2.455,P=0.032)(表2)。
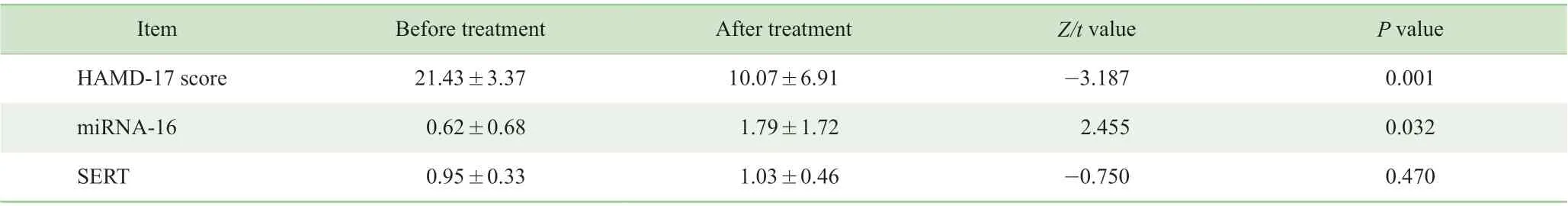
表2 (艾司)西酞普兰治疗前后抑郁症患者HAMD-17 评分及血浆miRNA-16 和血小板SERT 蛋白表达水平的比较(N=14)Tab 2 Comparison of HAMD-17 score, plasma miRNA-16 and platelet SERT levels before and after citalopram treatment for patients with depression (N=14)
3 讨论
(艾司)西酞普兰是一种选择性较高的 SSRIs 类抗抑郁药物,只对5-HT 系统产生影响,对其他神经递质系统影响较小,故本研究仅选择此药进行“5-HT 功能低下假说”相关通路探讨。本研究分为2 个步骤:第一步以未服药的抑郁症患者和规律服用(艾司)西酞普兰6 周及以上患者作为研究对象,探讨(艾司)西酞普兰对抑郁症患者外周血miRNA-16 / SERT 通路相关指标的影响,结果显示被试外周血miRNA-16 分布离散度很大,miRNA-16 及其下游调控蛋白SERT 在3 组中无明显差异;第二步对在第一步中收录的未服药抑郁症患者进行了8 周随访,结果显示在药物治疗后miRNA-16 的表达升高。(艾司)西酞普兰药物作用导致此结果的可能性很大,与动物实验结果有相似性。近年来多项对动物大脑的研究发现miRNA-16 与SSRIs 类抗抑郁剂和SERT 的表达有密切关系。Baudry 等[3]系统论证了在小鼠大脑中miRNA-16 是SERT 转录后的阻抑物以及SSRIs类药物的药理学靶点,为miRNA 的研究提供新的思路。之后Launay 等[5]在小鼠、海马中的研究也部分验证了此观点。动物实验研究[6]发现,慢性SSRIs 刺激会提高小鼠大脑中缝核miRNA-16 水平、降低SERT 蛋白水平,在SSRIs 的疗效中miRNA-16 起重要作用。总体上,目前的研究结果支持miRNA-16 广泛参与大脑对SSRIs 的反应,或者说正是SSRIs 导致的miRNA-16 的变化使抗抑郁剂产生了疗效。
在本研究的病例对照研究部分,结果显示与对照组相比,miRNA-16 在未服药抑郁患者和(艾司)西酞普兰治疗患者血浆中均无变化,与后续随访结果不一致。这可能与外周血浆中miRNA-16 的来源有关,因 miRNA-16 非特异性地只在脑部表达[7],血浆miRNA-16 水平可能会受到外周组织的干扰。一项研究[8]也显示,未进行药物干预的抑郁症患者血浆miRNA-16 水平未发生变化,但脑脊液中miRNA-16 水平显著降低。
血小板内的5-HT 来源于SERT 的摄入,过程与中枢5-HT 能神经元类似。在中枢系统SERT 能够清除突触间隙5-HT,对5-HT 信号的强度和持续性进行微调。既往对血小板5-HT 水平的研究结果比较一致,均观察到服用SSRIs 后血小板5-HT 显著降低,而引起这一改变的原因可能与SERT 有密切关系[5]。但是由于技术问题,在临床实验中研究人类中枢 SERT 的结合情况和功能存在难度。迄今为止只有正电子成像术可以部分实现对患者中枢SERT 活性的观察,但也有很大局限性,且在大部分5-HT神经网络中未发现合适配体[9]。但由于SERT 蛋白在血小板膜中广泛存在,结构和功能相似,故血小板膜SERT 可能是替代中枢脑组织可以选择的外周模型。本研究进一步用Western blotting 检测了血小板SERT 蛋白水平,结果显示,健康对照组、未服药病例组和药物治疗组之间SERT蛋白的表达无明显差异。针对5-HT 与血小板SERT 蛋白密度和表达量关系的相关报道,结论不一致。对血小板功能的体内研究报道,西酞普兰同时降低了SERT 的功能和蛋白表达[10]。以高血压患者为样本的病例对照研究阐述了血浆5-HT 水平与血小板SERT 蛋白水平的关系,认为外源性5-HT 可以改变血小板膜上SERT 分子密度以调控5-HT 的摄取率[11]。Little 等[12]将血小板从血浆中分离,离体状态下用氟西汀处理并保持其活性,24 h 后检测血小板SERT 免疫反应性,发现氟西汀处理组血小板SERT 免疫反应性明显降低。既往研究中也有不支持SERT 蛋白密度或表达量发生改变的结论。Ellis 等[13]对76 篇相关文献进行了系统分析,认为抑郁症患者的血小板帕罗西汀结合率与对照组相比无显著差异。关于SERT 功能降低的形式和原因,Qian 等[14]报道蛋白激酶C(protein kinase C,PKC)可通过参与SERT 的内化,即SERT 从胞膜向胞质转位,实现其对SERT 的调控。除PKC 外,对SERT 蛋白的研究发现其存在多个蛋白激酶的磷酸化位点。此后的研究证明蛋白激酶、蛋白磷酸酶、活性氧、一氧化氮等信号分子对SERT 有调控作用,彼此之间可能形成复杂的信息网络相互作用、相互制约,以实现对 SERT 的精细调节[15]。
通过对血小板SERT 的定量检测,本研究认为在慢性(艾司)西酞普兰刺激下,血小板5-HT 的减少并非是由血小板膜上SERT 蛋白量或蛋白密度降低这一简单的变化引起,有可能与SERT 功能降低有关;而抑郁症患者SERT功能降低的表现形式和原因,仍有待更深入的研究。由于miRNA-16 特异性调节SERT 蛋白的翻译过程,miRNA-16在血浆中的稳定性可以一定程度上成为血小板膜SERT 蛋白水平未发生改变的原因。
综上,本研究在抑郁症患者外周循环中观察到SSRIs类药物(艾司)西酞普兰对血浆miRNA-16 的影响。另外,通过检测SERT 蛋白水平,排除应用SSRIs 后外周血小板5-HT 水平的降低由血小板膜SERT 蛋白水平降低引起的可能,提示对外周SERT 蛋白的焦点应转向蛋白功能,为进一步研究提供了方向。本研究也存在以下局限性:①样本量较小,随访研究中仅有14 例服用(艾司)西酞普兰患者,虽然患者服药后miRNA-16 变化的一致性较高,但研究结果的证实还需要进一步扩大样本量以及扩充SSRIs 类药物使用的种类加以证实。②仅对血小板SERT 蛋白进行了定量检测,未进一步进行蛋白功能如磷酸化、甲基化等检测,尚无法明确解释服用SSRIs 后血小板5-HT 减少原因。
参·考·文·献
[1] Nordquist N, Oreland L.Serotonin genetic variability, behavior, and psychiatric disorders: a review[J].Ups J Med Sci, 2010, 115(1): 2-10.
[2] Chen X, Ba Y, Ma LJ, et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases[J]. Cell Res, 2008, 18(10): 997-1006.
[3] Baudry A, Mouillet-Richard S, Schneider B, et al. miR-16 targets the serotonin transporter: a new facet for adaptive responses to antidepressants[J]. Science, 2010, 329(5998): 1537-1541.
[4] Brown TA, Barlow DH. Comorbidity among anxiety disorders: implications for treatment and DSM- Ⅳ[J]. J Consult Clin Psychol, 1992, 60(6): 835-844.
[5] Launay JM, Mouillet-Richard S, Baudry A, et al. Raphe-mediated signals control the hippocampal response to SRI antidepressants via miR-16[J]. Transl Psychiatry, 2011, 1(11): e56.
[6] Desai SD, Shukla G, Goyal V, et al. Study of DSM- Ⅳ Axis I psychiatric disorders in patients with refractory complex partial seizures using a short structured clinical interview[J]. Epilepsy Behav, 2010, 19(3): 301-305.
[7] Burmistrova OA, Goltsov AY, Abramova LI, et al. MicroRNA in schizophrenia: genetic and expression analysis of miR-130b (22q11)[J]. Biochemistry Mosc, 2007, 72(5): 578-582.
[8] Song MF, Dong JZ, Wang YW, et al. CSF miR-16 is decreased in major depression patients and its neutralization in rats induces depression-like behaviors via a serotonin transmitter system[J]. J Affect Disord, 2015, 178: 25-31.
[9] Yubero-Lahoz S, Robledo P, Farre M, et al. Platelet SERT as a peripheral biomarker of serotonergic neurotransmission in the central nervous system[J]. Curr Med Chem, 2013, 20(11): 1382-1396.
[10] Carneiro AM, Cook EH, Murphy DL, et al. Interactions between integrin α Ⅱ bβ3 and the serotonin transporter regulate serotonin transport and platelet aggregation in mice and humans[J]. J Clin Invest, 2008, 118(4): 1544-1552.
[11] Brenner B, Harney JT, Ahmed BA, et al. Plasma serotonin levels and the platelet serotonin transporter[J]. J Neurochem, 2007, 102(1): 206-215.
[12] Little KY, Zhang L, Cook E. Fluoxetine-induced alterations in human platelet serotonin transporter expression: serotonin transporter polymorphism effects[J]. J Psychiatry Neurosci, 2006, 31(5): 333-339.
[13] Ellis PM, Salmond C. Is platelet imipramine binding reduced in depression? A meta-analysis[J]. Biol Psychiatry, 1994, 36(5): 292-299.
[14] Qian Y, Galli A, Ramamoorthy S, et al. Protein kinase C activation regulates human serotonin transporters in HEK-293 cells via altered cell surface expression[J]. J Neurosci, 1997, 17(1): 45-57.
[15] Flattem NL, Blakely RD. Modified structure of the human serotonin transporter promoter[J]. Mol Psychiatry, 2000, 5(1): 110-115.

